顺铂诱发大鼠睾丸毒性的机制及葡萄籽原花青素的防护作用
连燕娜,张海莲,赵江燕,高丽萍
(北京联合大学 生物活性物质与功能食品北京市重点实验室,北京 100191)
顺铂诱发大鼠睾丸毒性的机制及葡萄籽原花青素的防护作用
连燕娜,张海莲,赵江燕,高丽萍*
(北京联合大学 生物活性物质与功能食品北京市重点实验室,北京 100191)
目的:探究葡萄籽原花青素(grape seed proanthocyanidin extracts,GSPE)对顺铂(cisdiamminedichloroplatinum,CDDP)诱发大鼠睾丸氧化损伤和细胞凋亡的防护作用。方法:将40 只大鼠随机分为空白对照组、CDDP模型组、GSPE低剂量组(200 mg/(kg·d))、GSPE高剂量组(400 mg/(kg·d))。分别以蒸馏水和相应剂量的GSPE对大鼠连续灌胃15 d,灌胃10 d后一次性腹腔注射CDDP,剂量为7 mg/kg,空白对照组注射相同剂量的生理盐水。注射CDDP后第5天处死大鼠,检测精子指标、大鼠睾丸组织中超氧化物歧化酶(superoxide dismutase,SOD)与谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力、还原型谷胱甘肽(glutathione,GSH)与丙二醛(malondialdehyde,MDA)含量,流式细胞仪检测大鼠睾丸细胞凋亡率,并观察睾丸组织在光镜下形态的变化。结果:CDDP模型组大鼠睾丸和附睾的质量、附睾精子的浓度和活动度、GSH-Px、SOD活力以及GSH含量均显著降低,而MDA水平和睾丸细胞凋亡率显著升高。预防性口服GSPE显著改善了CDDP引起的大鼠睾丸质量减小、功能减弱以及氧化应激、脂质过氧化和细胞凋亡这些不利影响。结论:GSPE对CDDP诱发的大鼠睾丸毒性有剂量依赖性防护作用,其机制很可能与抑制体内氧化应激及细胞凋亡有密切关系。
顺铂;葡萄籽原花青素;睾丸毒性;氧化应激;细胞凋亡
顺铂(cis-diamminedichloroplatinum,CDDP)是一种有效的抗肿瘤DNA烷化剂,可以治疗多种实体肿瘤,如膀胱癌、卵巢癌、宫颈癌、子宫癌、脑癌、颈癌和肺癌等[1-2]。同时,CDDP在睾丸癌的治疗中也广泛应用,且治愈率>90%[3]。但CDDP对生殖系统产生的副作用限制了其治疗效果[4-5]。CDDP诱发睾丸损伤的机理还不清楚,但许多研究[6-9]已经证明,CDDP的副作用与产生自由基和活性氧(reactive oxygen species,ROS),从而引发氧化应激作用有关。ROS通常都是在睾丸亚细胞结构中产生,尤其是线粒体,这些ROS紧接着会被相应细胞器的抗氧化系统清除。然而,CDDP会破坏抗氧化系统的平衡,导致细胞功能紊乱[7-9]。当活性氧大量产生时,会激发DNA断裂和精子功能丧失,这与线粒体和精细胞膜的过氧化损伤有关。而且,由于精细胞多不饱和脂肪酸含量高并且抗氧化能力低,因此对过氧化损伤更敏感[10]。
鉴于ROS和氧化应激在CDDP诱发毒性途径中的重要作用,在大多数抗CDDP毒性的研究中有一种方法为使用天然或人工合成的抗氧化剂。目前所报道的具有这种保护作用的一些天然化合物[11-19]有VC、VE、VA,白藜芦醇、槲皮素、柚皮素和番茄红素,还有一些人工合成的化合物,如卡维地洛、依达拉奉等。这些抗氧化剂对CDDP毒性的防护主要是通过其自由基清除作用实现的。葡萄籽原花青素(grape seed proanthocyanidin extracts,GSPE)是具有多种药理活性的黄酮类化合物。已有报道称由于原花青素有抗氧化、抗炎、清除自由基、保护肾脏以及抗癌的作用,使其具有治疗病痛的潜能[20-22]。由于其具有很强的抗氧化活性、低毒性以及无遗传毒性,GSPE在美国市场作为一种膳食补充剂被推广[23]。本实验旨在检验大鼠经CDDP给药后造成的生殖功能损伤状况,并探究GSPE对该损伤可能的保护作用。
1 材料与方法
1.1动物、材料与试剂
成年健康雄性Sprague-Dawley(SD)大鼠40 只(SPF级),体质量140~160 g,由中国人民解放军军事科学院实验动物中心提供。
顺铂(CDDP,批号001001DF),注射用冻干型粉剂,每支10 mg,山东齐鲁制药厂生产,用时以生理盐水配制;葡萄籽原花青素(GSPE,纯度>95%),购于天津市尖峰天然产物研究开发有限公司,用时以双蒸水配制。
考马斯亮蓝蛋白试剂盒、还原型谷胱甘肽(glutathione,GSH)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒 南京建成生物工程研究所;碘化丙啶(propidium iodide,PI) 上海佳和生物科技有限公司。
1.2仪器与设备
紫外-可见分光光度计 尤尼柯上海仪器有限公司;石蜡包埋机、半自动转轮式切片机 德国Laica公司;三目摄像生物显微镜系 日本Olympus公司;流式细胞仪 美国Beckman Coulter公司。
1.3方法
1.3.1动物分组与模型建立
雄性SD大鼠在标准实验条件下饲养,保持12 h光照/12 h黑暗,温度(24±3) ℃。用普通鼠粮适应性饲养1 周后,将40 只大鼠随机分为4 组,每组10 只。实验第1天起,空白对照组、CDDP模型组每天灌胃蒸馏水(0.5 mL/100 g,以体质量计,下同),GSPE低、高剂量组分别以200、400 mg/(kg·d)的剂量连续灌胃GSPE(0.5 mL/100 g)15 d。本实验中使用的GSPE的灌胃剂量基于前期的研究报道[24-25]。此外,在实验的第10天CDDP模型组和GSPE低、高剂量组大鼠一次性腹腔注射CDDP 7 mg/kg,这是已知的能够引起大鼠睾丸毒性的剂量[26]。空白对照组注射等量的生理盐水。
1.3.2样本采集
所有大鼠在注射CDDP后第5天通过股动脉放血法处死,在冰浴条件下迅速取出两侧睾丸及附睾,去除黏连的结缔组织并称质量。1 个睾丸固定在体积分数10%福尔马林中用于组织切片,另1 个睾丸沿横切面一分为二,一半放入液氮中迅速冷冻后转移至-80 ℃条件下保存用于生化分析,另一半取一部分组织浸泡于70%的乙醇中,用于凋亡的检测,剩余部分称量质量后按1 mL/mg加入DMEM培养基匀浆,用于精子计数。
将睾丸组织从深度冷冻状态取出并称质量,转移到预冷的玻璃管中,用9 倍体积(V/m)的磷酸盐缓冲液(pH 7.4)稀释。进行酶活性分析时,将睾丸组织切碎并用冷生理盐水作为匀浆介质,冰浴条件下在聚四氟乙烯玻璃匀浆器中10 000 r/min匀浆3 min。制备好的组织匀浆4 ℃、825×g离心15 min,取上清液于-20 ℃条件下冻存,用于后续的生化指标检测。
1.3.3指标检测方法
1.3.3.1精子浓度和活动度
精子计数采用Yokoi等[27]的一种改良方法。
评估精子活动度的方法:取1~2 滴上述附睾精子悬液滴于清洁载玻片上,室温((20±2)℃)条件下,于20 min内在400×光镜下进行观察,每只大鼠分析100 个精子,并对精子的活动度进行分级。
1.3.3.2生化指标测定
取冻存于-20 ℃的组织匀浆上清液,按照试剂盒说明书方法,采用硫代巴比妥酸法测定匀浆上清液中MDA含量;二硫代二硝基苯甲酸法测定GSH含量;黄嘌呤氧化酶法测定SOD活性;二硫代二硝基苯甲酸法测定GSH-Px活性;考马斯亮蓝法测定蛋白质含量。
1.3.3.3细胞凋亡的测定
将70%乙醇固定的组织放在120 目不锈钢网上,下置一平皿,用眼科剪将组织剪碎,用镊子轻轻揉搓组织块,并用生理盐水冲洗,直至将组织搓碎为止。去除平皿中混悬液的细胞团块,收集细胞悬液,500~800 r/min离心2 min。取上述细胞悬液,调整其浓度为1×106个/mL,取0.1 mL该溶液(加入10%鸡红细胞作为内参标准,与样品同步染色),加入PI染液1 mL,在4 ℃冰箱中避光染色30 min,以500 目铜网过滤,使样品成为合格的单细胞悬液。流式细胞仪激发波长为488 nm,检测前以flowcheckTMFluorpheres(10 μm)荧光微球作为标准样品,调整仪器变异系数在2%以内。
1.3.3.4组织病理学检测
睾丸样本取出后放入10%的中性缓冲福尔马林中进行固定,经常规处理和苏木精-伊红(hematoxylineosin,HE)染色后,用光学显微镜进行检查。运用显微测微器在光学显微镜下测每个睾丸中5 个不同位置的曲细精管的直径和生发层细胞厚度,计算曲细精管的平均直径和生发层细胞的平均厚度。
1.4数据统计分析
用SPSS 12.0统计软件进行统计学处理,实验数据采用±s表示,显著水平设定为P<0.05,多个样本均数的比较采用单因素方差分析,Duncan's多重比较法用来确定组间差异的显著性。
2 结果与分析
2.1GSPE对大鼠睾丸及附睾质量的影响
表1 各组大鼠睾丸及附睾质量Table 1 Testes and epididymis weights of rats in all groups

表1 各组大鼠睾丸及附睾质量Table 1 Testes and epididymis weights of rats in all groups
注:a.与空白对照组相比,差异极显著(P<0.01);b.与CDDP模型组相比,差异显著(P<0.05);c.与CDDP模型组相比,差异极显著(P<0.01)。
组别睾丸质量/g附睾质量/g空白对照组2.533 1±0.119 50.536 2±0.064 8 CDDP模型组2.151 5±0.226 7a0.360 0±0.051 7aGSPE低剂量组2.297 7±0.091 3a0.422 5±0.080 8abGSPE高剂量组2.411 5±0.102 2c0.488 5±0.047 8c
由表1可知,CDDP模型组大鼠的睾丸、附睾质量与空白对照组相比极显著降低(P<0.01)。与CDDP模型组相比,GSPE高剂量组大鼠的睾丸质量和附睾质量极显著增加(P<0.01),GSPE低剂量组大鼠的附睾质量显著增加(P<0.05)。以上结果提示预防性给药GSPE对CDDP引起的生殖损伤有减缓效果。然而与CDDP模型组相比,GSPE低剂量组大鼠睾丸质量虽有所增加,但无显著差异(P>0.05)。
2.2GSPE对大鼠附睾精子浓度、活动度、畸形率及睾丸精子浓度的影响
表2 各组大鼠的附睾精子浓度、活动度、畸形率和睾丸精子浓度Table 2 Epididymal sperm concentration, sperm motility, abnormal sperm rate and testicular sperm concentration in rats from all groups

表2 各组大鼠的附睾精子浓度、活动度、畸形率和睾丸精子浓度Table 2 Epididymal sperm concentration, sperm motility, abnormal sperm rate and testicular sperm concentration in rats from all groups
注:a. 与空白对照组相比,差异显著(P<0.05);b. 与空白对照组相比,差异极显著(P<0.01);c. 与CDDP模型组相比,差异显著(P<0.05);d. 与CDDP模型组相比,差异极显著(P<0.01)。下同。
睾丸精子浓度/(105个/mL)空白对照组17.23±7.4770.12±7.202.14±0.8218.10±3.94 CDDP模型组8.67±4.16b49.06±14.40b3.56±0.44b9.64±2.39bGSPE低剂量组9.04±5.35b58.48±7.60bc2.96±0.43ad13.38±3.39aGSPE高剂量组15.46±3.99d63.45±7.60d2.69±0.41d17.33±3.46d组别附睾精子浓度/(105个/mL)附睾精子活动度/%附睾精子畸形率/%
由表2可知,与空白对照组相比,CDDP模型组大鼠的精子浓度和附睾精子活动度极显著降低(P<0.01),附睾精子畸形率极显著升高(P<0.01)。与CDDP模型组相比,GSPE高剂量组大鼠的附睾精子浓度、附睾精子活动度极显著增加(P<0.01),GSPE低剂量组大鼠的附睾精子活动度显著增加(P<0.05),GSPE低、高剂量组大鼠的附睾精子畸形率极显著降低(P<0.01),以上结果表明GSPE可有效抑制CDDP诱导的大鼠精子质量方面的副作用,包括附睾精子浓度、活动度和畸形率。
2.3GSPE对大鼠睾丸组织中MDA和GSH含量、GSH-Px和SOD活性的影响
表3 各组大鼠睾丸组织中MDA、GSH含量及SOD、GSH-Px活性Table 3 MDA and GSH levels and SOD and GSH-Px activities in testes tissue in rates from all groups
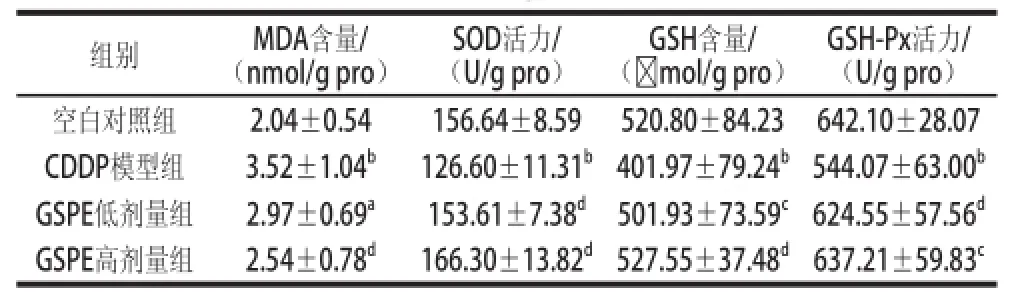
表3 各组大鼠睾丸组织中MDA、GSH含量及SOD、GSH-Px活性Table 3 MDA and GSH levels and SOD and GSH-Px activities in testes tissue in rates from all groups
GSH-Px活力/(U/g pro)空白对照组2.04±0.54156.64±8.59520.80±84.23642.10±28.07 CDDP模型组3.52±1.04b126.60±11.31b401.97±79.24b544.07±63.00bGSPE低剂量组2.97±0.69a153.61±7.38d501.93±73.59c624.55±57.56dGSPE高剂量组2.54±0.78d166.30±13.82d527.55±37.48d637.21±59.83c组别MDA含量/(nmol/g pro)SOD活力/(U/g pro)GSH含量/(☒mol/g pro)
由表3可知,与空白对照组相比,CDDP模型组大鼠的睾丸组织中MDA含量极显著升高(P<0.01),而GSH含量、GSH-Px和SOD活力极显著降低(P<0.01)。与CDDP模型组相比,GSPE高剂量组大鼠的睾丸组织中MDA含量极显著降低(P<0.01),GSPE低剂量组大鼠的睾丸组织中MDA含量降低,但无显著差异(P>0.05)。此外,与CDDP模型组相比,GSPE低剂量组大鼠睾丸组织中的GSH-Px、SOD活力及GSH含量增加(P<0.05或P<0.01)。
2.4GSPE对大鼠睾丸细胞凋亡的影响

图1 各组大鼠睾丸细胞凋亡情况Fig.1 Testicular cell apoptosis of rats in all groups
由图1可知,与空白对照组大鼠睾丸细胞凋亡率((1.02±0.09)%)相比,CDDP模型组大鼠的睾丸细胞凋亡率((3.15±0.68)%)显著升高(P<0.01)。与CDDP模型组相比,GSPE高剂量组大鼠睾丸细胞凋亡率((2.57±0.43)%)显著降低(P<0.05),GSPE低剂量组大鼠睾丸细胞凋亡率((2.88±0.55)%)降低,但差异不显著(P>0.05)。
2.5各组大鼠睾丸组织病理学的变化
由表4可知,与空白对照组相比,CDDP模型组大鼠的睾丸曲细精管直径和生发层细胞厚度极显著降低(P<0.01),GSPE低剂量组未改善这种损害,然而给药高剂量的GSPE显著或极显著地缓解了这种损害(P<0.05或P<0.01)。如图2所示,空白对照组大鼠睾丸曲细精管排列规则,管腔内有大量成熟精子。CDDP模型组大鼠的睾丸曲细精管排列不规则、生精上皮细胞层次减少、管腔内成熟精子减少、且有空泡形成。GSPE低剂量组大鼠与空白对照组相比,虽然出现了曲细精管排列较不规则、管腔内成熟精子较少的现象,但与CDDP模型组相比已有改善。GSPE高剂量组与空白对照组相比,大鼠睾丸曲细精管排列基本规则,各级生精细胞未见明显改变,较CDDP模型组明显改善。
表4 各组大鼠曲细精管直径及生发层细胞的厚度Table 4 Diameter of seminiferous tubules and germinal layer thickness of rats in all groups
组别曲细精管直径/μm生发层细胞厚度/μm空白对照组318.52±30.84106.69±12.02 CDDP模型组279.07±32.48b80.43±8.76bGSPE低剂量组281.90±16.07a89.36±13.67bGSPE高剂量组310.52±36.89c94.54±12.99ad
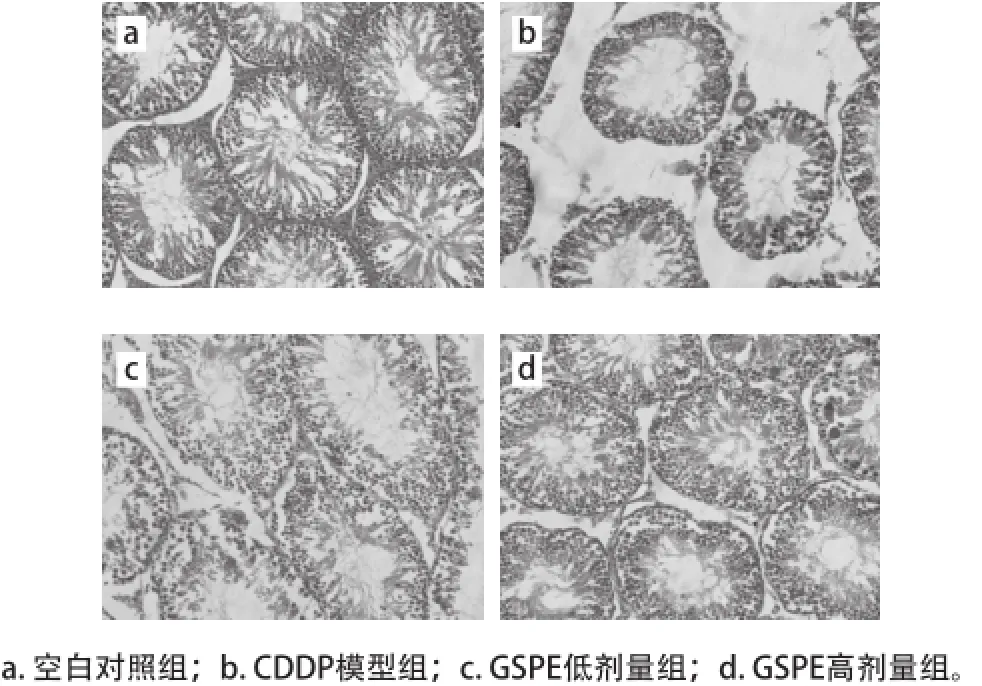
图2 各组大鼠睾丸组织病理变化(HE,×40000)Fig.2 Pathological changes of testis tissue in rats (HE, ×400)
3 讨 论
睾丸恶性肿瘤是常见的肿瘤病之一,肿瘤化疗药物在很多情况下已经提高了肿瘤患者的生存率。但是这种治疗导致副作用的发病率比较高,睾丸功能障碍就是这种治疗最常见的长期副作用之一[28]。近年来,化疗后睾丸功能损害已经引起了研究人员的广泛关注。用于化疗的许多药物尤其是烷化剂都具有生殖腺毒性作用,其生殖毒性与抗肿瘤药物基团、所用化疗药物的剂量、处理时间及个体敏感度的变化有关[28-29]。CDDP是一种用于治疗睾丸癌、卵巢癌、头颈部癌症等有效的化疗烷化剂。有研究者报道CDDP的使用引起了暂时性或永久性精子活力缺乏或精子减少[30-31]。本实验的结果表明,7 mg/kg CDDP的使用能造成大鼠精子浓度、精子活动度显著降低及精子畸形率显著增加。
生发层上皮细胞损伤而造成的精子减少或精子活力缺乏,一直被公认为是化疗药物治疗的后果之一[4,32]。化疗诱导的睾丸损伤与特定的药物种类及剂量有关[28]。本实验结果显示CDDP诱发了大鼠睾丸与附睾质量减轻。组织病理学切片也表明CDDP引起了睾丸曲细精管直径和生发层细胞厚度的减少。以上结果,尤其是精子特性和组织病理学方面的损伤与一些学者的研究报道一致[7-9],这提示CDDP可诱发睾丸损伤,从而造成了精子减少或精子活力缺乏,对大鼠产生了明显的生殖毒性。
CDDP诱发大鼠生殖毒性的分子机理尚不清楚。一些体内与体外研究[6-7,9]表明实验动物暴露于CDDP会伴随氧化应激的产生。氧化应激是一种与ROS的产生和消除有关的现象。根据药物毒性的分子生物学机制,ROS和氧化性损伤可能通过减弱精子的功能而引起雄性不育。已经发现在低生育或不育男性的精浆和精子中有过量的ROS和自由基产生[33]。
本实验中,与空白对照组相比,注射CDDP显著地增加了大鼠睾丸组织中MDA的含量,减少了GSH含量和GSH-PX、SOD活性。这些指标上的变化表明抗氧化酶的活性不足以平衡注射7 mg/kg CDDP后在指定时间内产生的自由基。此外,MDA含量增加也证实了这个结论。SOD活性的减弱导致超氧阴离子自由基含量的增加。另外,这些抗氧化酶活性的减小表明在自由基转化成损伤更小或者无损伤的代谢物的过程中这些酶的消耗和反应,其次也表明CDDP对酶活性可能有直接抑制或刺激作用。Türk等[9]研究结果显示CDDP在精液、精子和睾丸组织中引起MDA含量增加。此外,Salem等[7]也报道了CDDP引起Wistar大鼠睾丸组织中MDA含量显著增加,同时抗氧化酶活性的降低易增加精子的自由基损伤。
有研究[34-35]表明,高剂量CDDP作用下细胞DNA损伤严重以致不能修复,促使细胞发生凋亡或死亡。本研究通过DNA含量的降低粗略定量凋亡细胞百分比,不能区分早期、晚期及坏死细胞,可作为凋亡细胞的初步筛选。本研究结果显示,腹腔注射CDDP显著增加了睾丸细胞凋亡率,证明了CDDP可促进细胞凋亡或死亡的发生。
GSPE包括低聚原花青素,是有生物活性的黄酮化合物,已被广泛应用于生物、化疗等领域。本实验发现400 mg/kg剂量的GSPE能显著的改善CDDP所引起的大鼠精子质量下降。用GSPE预处理能够显著的抑制大鼠睾丸组织中由CDDP引起的MDA和GSH的耗竭,并增加SOD和GSH-Px活性。用高剂量的GSPE预处理能够比低剂量的GSPE更显著地改善睾丸功能。GSPE抑制CDDP诱导过氧化脂质增加的原因可能是由于它能够与氧代谢物反应。实验结果发现CDDP引起大鼠精子浓度和活性显著降低且精子畸形率显著增加,但GSPE的使用能够显著改善这些状况,尤其是高剂量的GSPE。由以上结果推测GSPE拮抗CDDP诱导的异常精子比率的保护作用是由于其具有抗氧化特性。以上结果或许可以说明GSPE对CDDP诱导的氧化应激有一定的缓解作用。
总之,本实验结果表明,GSPE对CDDP引起的睾丸毒性有防护作用。GSPE的这一防护作用可能与氧化应激的抑制有密切关系。因此在化学疗法中可以考虑将GSPE和CDDP同时使用进而改善CDDP诱导的精子质量下降和氧化应激损伤。
[1] COLPI G M, CONTALBI G F, NERVA F, et al. Testicular function following chemo-radio therapy[J]. European Journal of Obstetrics & Gynecology and Reproductive Biology, 2004, 113(Suppl 1): 2-6.
[2] HOWELL S J, SHALET S M. Spermatogenesis after cancer treatment:damage and recovery[J]. Journal of the National Cancer Institute. Monographs, 2005, 34: 12-17.
[3] WANG D, LIPPARD S J. Cellular processing of platinum anticancer drugs[J]. Nature Reviews Drug Discovery, 2005, 4(4): 307-320.
[4] CHERRY S M, HUNT P A, HASSOLD T J. Cisplatin disrupts mammalian spermatogenesis, but does not affect recombination or chromosome segregation[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2004, 564(2): 115-128.
[5] ISHIKAWA T, KAMIDONO S, FUJISAWA M. Fertility after high-dose chemotherapy for testicular cancer[J]. Urology, 2004,63(1): 137-140.
[6] AHMED E A, OMAR H M, RAGB S M M, et al. The antioxidant activity of vitamin C, DPPD and L-cysteine against cisplatin-induced testicular oxidative damage in rats[J]. Food and Chemical Toxicology,2011, 49(5): 1115-1121.
[7] SALEM E A, SALEM N A, MAAROUF A M, et al. Selenium and lycopene attenuate cisplatin-induced testicular toxicity associated with oxidative stress in wistar rats[J]. Urology, 2012, 79(5): 1184.e1-1184.e6. doi: 10.1016/j.urology.2011.12.006.
[8] ILBEY Y O, OZBEK E, SIMSEK A, et al. Potential chemoprotective effect of melatonin in cyclophosphamide-and cisplatin-induced testicular damage in rats[J]. Fertility and Sterility,2009, 92(3): 1124-1132.
[9] T☒RK G, ATEŞŞAHIN A, S☒NMEZ M, et al. Improvement of cisplatin-induced injuries to sperm quality, the oxidant-antioxidant system, and the histologic structure of the rat testis by ellagic acid[J]. Fertility and Sterility, 2008, 89(5): 1474-1481.
[10] VERNET P, AITKEN R J, DREVET J R. Antioxidant strategies in the epididymis[J]. Molecular and Cellular Endocrinology, 2004, 216(1): 31-39.
[11] TARLADACALISIR Y T, KANTER M, UYGUN M. Protective effects of vitamin C on cisplatin-induced renal damage: a light and electron microscopic study[J]. Renal Failure, 2008, 30(1): 1-8.
[12] AJITH T A, ABHISHEK G, ROSHNY D, et al. Co-supplementation of single and multi doses of vitamins C and E ameliorates cisplatininduced acute renal failure in mice[J]. Experimental and Toxicologic Pathology, 2009, 61(6): 565-571.
[13] DILLIOGLUGIL M O, MARAL KIR H, GULKAC M D, et al. Protective effects of increasing vitamin E and A doses on cisplatininduced oxidative damage to kidney tissue in rats[J]. Urologia Internationalis, 2005, 75(4): 340-344.
[14] do AMARAL C L, FRANCESCATO H D C, COIMBRA T M, et al. Resveratrol attenuates cisplatin-induced nephrotoxicity in rats[J]. Archives of Toxicology, 2008, 82(6): 363-370.
[15] FRANCESCATO H D C, COIMBRA T M, COSTA R S, et al. Protective effect of quercetin on the evolution of cisplatin-induced acute tubular necrosis[J]. Kidney and Blood Pressure Research, 2004,27(3): 148-158.
[16] BADARY O A, ABDEL-MAKSOUD S, AHMED W A, et al. Naringenin attenuates cisplatin nephrotoxicity in rats[J]. Life Sciences,2005, 76(18): 2125-2135.
[17] ATESSAHIN A, YILMAZ S, KARAHAN I, et al. Effects of lycopene against cisplatin-induced nephrotoxicity and oxidative stress in rats[J]. Toxicology, 2005, 212(2): 116-123.
[18] RODRIGUES C, RODRIGUES J L, MARTINS N M, et al. Carvedilol protects against the renal mitochondrial toxicity induced by cisplatin in rats[J]. Mitochondrion, 2010, 10(1): 46-53.
[19] IGUCHI T, NISHIKAWA M, CHANG B J, et al. Edaravone inhibits acute renal injury and cyst formation in cisplatin-treated rat kidney[J]. Free Radical Research, 2004, 38(4): 333-341.
[20] HOUDE V, GRENIER D, CHANDAD F. Protective effects of grape seed proanthocyanidins against oxidative stress induced by lipopolysaccharides of periodontopathogens[J]. Journal of Periodontology, 2006, 77(8): 1371-1379.
[21] SHAO Zuohui, BECKER L B, VANDEN HOEK T L, et al. Grape seed proanthocyanidin extract attenuates oxidant injury in cardiomyocytes[J]. Pharmacological Research, 2003, 47(6): 463-469.
[22] VAYALIL P K, MITTAL A, KATIYAR S K. Proanthocyanidins from grape seeds inhibit expression of matrix metalloproteinases in human prostate carcinoma cells, which is associated with the inhibition of activation of MAPK and NFκB[J]. Carcinogenesis,2004, 25(6): 987-995.
[23] RAY S, BAGCHI D, LIM P M, et al. Acute and long-term safety evaluation of a novel IH636 grape seed proanthocyanidin extract[J]. Research Communications in Molecular Pathology and Pharmacology,2000, 109(3/4): 165-197.
[24] YOUSEF M I, SAAD A A, EL-SHENNAWY L K. Protective effect of grape seed proanthocyanidin extract against oxidative stress induced by cisplatin in rats[J]. Food and Chemical Toxicology, 2009, 47(6):1176-1183.
[25] SAAD A A, YOUSSEF M I, EL-SHENNAWY L K. Cisplatin induced damage in kidney genomic DNA and nephrotoxicity in male rats: the protective effect of grape seed proanthocyanidin extract[J]. Food and Chemical Toxicology, 2009, 47(7): 1499-1506.
[26] SILVA C ☒ R, GREGGI ANTUNES L M, BIANCHI M L P. Antioxidant action of bixin against cisplatin-induced chromosome aberrations and lipid peroxidation in rats[J]. Pharmacological Research, 2001, 43(6): 561-566.
[27] YOKOI K, UTHUS E O, NIELSEN F H. Nickel deficiency diminishes sperm quantity and movement in rats[J]. Biological Trace Element Research, 2003, 93(1/3): 141-153.
[28] HOWELL S J, SHALET S M. Testicular function following chemotherapy[J]. Human Reproduction Update, 2001, 7(4): 363-369.
[29] MARTIN R H, ERNST S, RADEMAKER A, et al. Analysis of sperm chromosome complements before, during, and after chemotherapy[J]. Cancer Genetics and Cytogenetics, 1999, 108(2): 133-136.
[30] CHERRY S M, HUNT P A, HASSOLD T J. Cisplatin disrupts mammalian spermatogenesis, but does not affect recombination or chromosome segregation[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2004, 564(2): 115-128.
[31] COLPI G M, CONTALBI G F, NERVA F, et al. Testicular function following chemo-radiotherapy[J]. European Journal of Obstetrics & Gynecology and Reproductive Biology, 2004, 113(Suppl 1): 2-6.
[32] ATEŞŞAHIN A, KARAHAN İ, T☒RK G, et al. Protective role of lycopene on cisplatin-induced changes in sperm characteristics,testicular damage and oxidative stress in rats[J]. Reproductive Toxicology, 2006, 21(1): 42-47.
[33] BAKER M A, AITKEN R J. Reactive oxygen species in spermatozoa:methods for monitoring and significance for the origins of genetic disease and infertility[J]. Reproductive Biology and Endocrinology,2005, 3(1): 67. doi: 10.1186/1477-7827-3-67.
[34] 刘玲, 张娟娟, 何蕊玲, 等. 黄芪注射液对顺铂所致小鼠肾损害的保护作用[J]. 中国中药杂志, 2010, 35(20): 2736-2740.
[35] RYU H G, JEONG S J, KWON H Y, et al. Penta-O-galloyl-β-D-glucose attenuates cisplatin-induced nephrotoxicity via reactive oxygen species reduction in renal epithelial cells and enhances antitumor activity in Caki-2 renal cancer cells[J]. Toxicology in Vitro, 2012, 26:206-214.
Mechanism of cis-Diamminedichloroplatinum-Induced Testicular Toxicity and Protective Effect of Grape Seed Proanthocyanidin Extract in Rats
LIAN Yanna, ZHANG Hailian, ZHAO Jiangyan, GAO Liping*
(Beijing Municipal Key Laboratory of Biological Active Substance and Functional Food, Beijing Union University, Beijing 100191, China)
Objective: To investigate the possible protective role of grape seed proanthocyanidin extract (GSPE) on cisdiamminedichloroplatinum (CDDP)-induced spermiotoxicity. Methods: A total of 40 rats were randomly divided into 4 groups: blank control group, CDDP model group, and low-dose GSPE + CDDP group, high-dose GSPE + CDDP group(orally administered at doses of 200 mg/(kg·d) and 400 mg/(kg·d), respectively, daily for 15 days), each group containing ten rats. After 10 days of administration, the blank control group was given normal saline by intraperitoneal injection, while a single intraperitoneal i njection of CDDP (7 mg/kg) was carried out in the remaining groups. At the end of the administration period, all rats were sacrificed to determine testicular and epididymal weights, epididymal sperm count and motility, GSH-Px and SOD activities, and GSH contents. Apoptosis rates of testicular cells were tested by flow cytometer, and histopathological characteristics were observed under a microscope. Results: Testicular and epididymal weights, epididymal sperm count and motility, GSH-Px and SOD activities, and GSH levels were signi☒cantly decreased whereas the level of MDA and apoptosis rates were signi☒cantly increased in rats from the CDDP group. GSPE treatment signi☒cantly attenuated the CDDP-induced loss of testicular and epididymal weights and the dysfunction of reproductive organs, oxidative stress, lipid peroxidation and cell apoptosis. Conclusion: GSPE has a dose-dependent protective effect against CDDP-induced testicular toxicity in rats. This protective effect seems to be closely associated with the suppression of oxidative stress and cell apoptosis.
cisplatin; grape seed proanthocyanidin extracts; testicular toxicity; oxidative stress; apoptosis
R318.0
A
1002-6630(2015)15-0189-06
10.7506/spkx1002-6630-201515035
2014-01-29
北京联合大学校级科研项目重点实验室开放课题(Zk70201502)
连燕娜(1987—),女,硕士研究生,研究方向为功能性食品生化作用。E-mail:l ianyanna2009@sina.com
高丽萍(1962—),女,教授,博士,研究方向为功能性食品生化作用。E-mail:gaolip62@163.com

