鸭肝乳酸脱氢酶的分离纯化及部分性质研究
方 玲,孙才云,唐云明
(西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,三峡库区生态环境教育部重点实验室,重庆 400715)
鸭肝乳酸脱氢酶的分离纯化及部分性质研究
方 玲,孙才云,唐云明*
(西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,三峡库区生态环境教育部重点实验室,重庆 400715)
新鲜鸭肝经匀浆、磷酸盐缓冲液抽提,乙醇和硫酸铵分级沉淀,DEAE-Sepharose离子交换层析及Superdex-200凝胶过滤层析,获得电泳纯的乳酸脱氢酶。该酶经纯化后酶比活力达到668.82 U/mg,酶活回收率为25.79%,纯化倍数为185.78。该酶的全分子质量约为170.93 kD,亚基分子质量为44.72 kD;最适反应温度为45 ℃,最适pH值为7.4,在25~45 ℃及pH 5~10的范围内稳定性较好;在45 ℃、pH 7.4条件下,测得该酶对底物还原型烟酰胺腺嘌呤二核苷酸(reduced form of nicotinamide-adenine dinucleotid,NADH)的Km值为3.407 μmol/L,对丙酮酸钠的Km值为8.431 μmol/L;草酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、Cu2+、Ag+对该酶的抑制作用最强,Co2+、K+对该酶有双重作用,低浓度时有激活作用,而高浓度时具有抑制酶活性的作用。
鸭肝;乳酸脱氢酶;分离纯化;性质
乳酸脱氢酶(lactate dehydrogenase,LDH,EC1.1.1.27)又称烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)氧化酶,广泛存在于动植物体内,是生物体内进行糖酵解过程的重要酶之一,主要催化丙酮酸和乳酸之间的可逆转化[1-2]。该酶在动物体内主要存在H、M、C 3 种亚基,H、M两个亚基组成了LDH1(H4)、LDH2(H3M)、LDH3(H2M2)、LDH4(HM3)、LDH5(M4)5 种同工酶,LDH-C4是由C亚基组成的四聚体,LDH同工酶在生物体内的分布具有组织特异性[2-3],LDH1在动物心脏及肾中含量较高,LDH5在骨骼肌及肝脏中占主要优势,肺中以LDH3、 LDH4为主,而LDH-C4主要存在于雄性成熟个体的精子及睾丸中[4]。
LDH是重要的医学诊断用酶,现广泛用于生产丙氨酸氨基转移酶测定试剂盒,丙酮酸盐的检测,肝病、心肌梗死、白血病及肺梗塞的诊断,还可用作发酵奶制品、盐渍品和饮料生产中的食品添加剂。目前已有多种来源的LDH同工酶的研究报道[5-9],但对鸭肝中LDH分离纯化的研究未见报道。我国鸭肉的年总产量约占世界总量的70%,是世界上最大的鸭肉生产和消费国[10]。鸭肝是鸭肉加工过程中总量较多的副产品,价格低廉、易取材,而且LDH在鸭肝中含量十分丰富。故本研究以来源广泛的鸭肝为材料,从中分离纯化LDH并对其部分酶学性质进行研究,旨在为LDH的更深入研究及工业化生产提供参考。
1 材料与方法
1.1材料与试剂
四川麻鸭(Anas platynchos)肝脏:将购自重庆市北碚区菜市场活的四川麻鸭杀死后立即取出肝脏,于-20 ℃保存备用。
考马斯亮蓝R-250 美国Bio-Rad公司;三羟甲基氨基甲烷(Tris) 香港Farco公司;DEAE-Sepharose离子交换层析标准品、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)蛋白质标准品、Superdex-200凝胶层析分子质量标准品 美国GE Healthcare公司;甲叉双丙烯酰胺、丙烯酰胺 瑞士Fluka公司;其余试剂均为国产分析纯。
1.2仪器与设备
UV-2550型分光光度计、蛋白核酸定量仪 日本岛津公司;MC4L冷冻干燥机 德国Uni Equip公司;Mill-Q plus超纯水仪 美国Millipore公司;PHS-32W微电路pH计 上海理达仪器厂;精密电子天平 瑞士Mettler-Toledo公司;GL-21M高速冷冻离心机 湖南长沙湘仪检测设备有限公司;AKTA Prime Plus蛋白质纯化系统 美国GE公司;垂直板电泳槽和电泳仪 美国Bio-Rad公司。
1.3方法
1.3.1鸭肝LDH粗酶液的制备
将新鲜的鸭肝除去结缔组织和脂肪,称取100 g,按1∶4(m/V)的比例加入预冷的0.05 mmol/L磷酸盐缓冲液(pH 7.4),匀浆后放于4 ℃冰箱中静置抽提4 h,然后12 000 r/min离心40 min,收集上清液即为粗酶液。
1.3.2乙醇及硫酸铵分级盐析
向粗酶液中加入体积分数30%的无水乙醇,4 ℃冰箱静置1 h,12 000 r/min离心35 min,弃沉淀取上清液,向上清液中加入硫酸铵粉末至35%饱和度,4 ℃冰箱中静置盐析2 h,12 000 r/min离心35 min,弃沉淀收集上清液,再向其中加入硫酸铵粉末至60%的饱和度,4 ℃静置盐析2 h,6 000 r/min离心30 min,收集沉淀,沉淀用0.05 mol/L磷酸盐缓冲液(pH 7.4)溶解,4 ℃透析24 h即为初酶液。
1.3.3DEAE-Sepharose离子交换层析
用0.05 mol/L磷酸盐缓冲液(pH 7.4)平衡好离子交换层析柱后,取初酶液10 mL上柱,用0~0.5 mol/L的NaCl溶液(含0.05 mol/L的磷酸盐缓冲液(pH 7.4))进行线性梯度洗脱,流速0.65 mL/min,每管收集6.5 mL;测定各管LDH活力和蛋白质含量,收集活性较高的各管酶液,于4 ℃冰箱中保存备用。
1.3.4Superdex-200凝胶过滤层析
用0.05 mol/L磷酸盐缓冲液(pH 7.4)平衡Superdex-200凝胶过滤层析柱后,取1.3.3节收集的活力较高的LDH酶液4 mL上柱,用0.05 mol/L磷酸盐缓冲液(pH 7.4)洗脱,流速0.5 mL/min,每管收集3 mL;测定各管LDH活力和蛋白质含量;收集活性较高的酶液,4 ℃超纯水透析脱盐24 h,冷冻干燥后于-20 ℃冰箱保存备用。
1.3.5鸭肝LDH活力的测定
参照文献[11-12]的方法测定LDH活力:LDH在催化丙酮酸盐转化为乳酸盐的同时,将还原型烟酰胺腺嘌呤二核苷酸(reduced form of nicotinamide-adenine dinucleotid,NADH)氧化为NAD,使得体系在340 nm波长处的吸光度不断减小。酶活力单位(U)定义为:在25 ℃、pH 7.4条件下,每分钟氧化分解1 μmol NADH所需的酶量为一个酶活力单位。反应体系:0.05 mmol/L磷酸盐缓冲液(pH 7.4)2.8 mL、6.6 mmol/L NADH 0.1 mL、30 mmol/L丙酮酸钠0.1 mL、酶液0.1 mL,25 ℃水浴5 min。连续测定反应体系在340 nm波长处吸光度的变化,根据下式计算酶活力。
酶活力/U=5.145×ΔA340nm×稀释倍数
式中:ΔA340nm为每分钟吸光度的变化值。
1.3.6鸭肝LDH纯度鉴定与分子质量测定[13]
鸭肝LDH的纯度鉴定采用SDS-PAGE(12%分离胶和5%浓缩胶),上样量10 μL。采用SDS-PAGE测定鸭肝LDH的亚基分子质量,Superdex-200凝胶过滤层析测定该酶的全分子质量。
1.3.7蛋白质含量的测定
用Bradford染料法与紫外分光光度法进行蛋白质含量的测定[13]。
1.3.8鸭肝LDH酶学性质测定
1.3.8.1鸭肝LDH的最适反应温度和热稳定性测定
在pH 7.4条件下,测定LDH在不同反应温度(25~65 ℃)下的酶活力(每组实验重复3 次取平均值,以下实验重复次数相同),以酶活力最高值为100%,计算相对酶活力,以研究LDH的最适反应温度。
将LDH酶液分别置于不同温度(25~75 ℃)下保温不同时间(0~60 min)后,在pH 7.4、25 ℃条件下测定LDH活力,以酶液不保温时的酶活力为100%,计算相对酶活力,以研究LDH的热稳定性。
1.3.8.2鸭肝LDH的最适反应pH值和pH值稳定性测定
配制不同pH值(3.0~10.0)的缓冲液,在25 ℃条件下,测定LDH在不同pH值反应体系中酶活力,以酶活力最高值为100%,计算相对酶活力,以研究LDH的最适反应pH值。
将酶液与不同pH值(4.0~10.0)的缓冲液等体积混合,4 ℃放置1.3 h后,测定LDH活力,以酶活力最高值为100%,计算其在不同pH值条件下的相对酶活力,研究LDH的pH值稳定性。
1.3.8.3鸭肝LDH米氏常数(Km)的测定
鸭肝LDH Km的测定采用双倒数法(Lineweaver-Burk法)[14],在最适条件下(45 ℃、pH 7.4),分别测定LDH对不同浓度(0.5~2.5 mmol/L)NADH和不同浓度(5~25 mmol/L)丙酮酸钠两种底物的Km值。
1.3.8.4不同化合物对鸭肝LDH活性的影响
将LDH酶液分别与等体积不同浓度的草酸、尿素、抗坏血酸(ascorbic acid,ASA)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、SDS混合后,在4 ℃冰箱中作用30 min后测定其酶活力,以不加化合物时的酶活力为100%,计算LDH的相对酶活力。
1.3.8.5不同有机溶剂对鸭肝LDH活性的影响
分别将酶液与等体积不同体积分数的异丙醇、甲醇、氯仿、乙醇混合,在4 ℃条件下作用30 min后测定酶活力,以不加有机物时的酶活力为100%,计算LDH的相对酶活力。
1.3.8.6部分金属离子对鸭肝LDH活性的影响
将不同金属离子(Zn2+、K+、Pb2+、Co2+、Mg2+、Ca2+、Li+、Ag+、Cd2+、Cu2+、Ba2+)配成100 mmol/L母液,用时稀释成所需要的浓度即可,将酶液分别与等体积不同浓度的各种金属离子溶液混合,在4 ℃条件下作用30 min后测定酶活力,以不加金属离子时的酶活力为100%,计算LDH的相对酶活力。
2 结果与分析
2.1鸭肝LDH的分离纯化结果

图1 鸭肝LDH的DEAE-Sepharose离子交换层析结果Fig.1 DEAE-Sepharose ion-exchange chromatography of LDH from duck liver

图2 鸭肝LDH的Superdex-200凝胶过滤层析结果Fig.2 Superdex-200 chromatography of LDH from duck liver
如图1所示,鸭肝LDH初酶液经DEAE-Sepharose离子交换层析后,酶活力较高的峰主要集中在第14~19管,收集酶活力较高管的酶液,直接用于Superdex-200凝胶过滤层析,洗脱图谱如图2所示,酶活力较高的峰主要集中在第28~34管,收集高酶活力管的酶液,用双蒸水透析后冷冻干燥,通过SDS-PAGE,显示为单一条带(图3),说明该酶经纯化后达到了电泳纯。该酶的整个分离纯化结果如表1所示,最终得到鸭肝LDH的酶活回收率为25.79%,纯化倍数为185.78,酶比活力为668.82 U/mg。

图3 鸭肝LDH的SDS-PAGEE图谱Fig.3 SDS-PAGE of puri☒ed LDH from duck liver

表1 鸭肝LDH的分离纯化结果Table 1 Summary of isolation and purification of LDH from duck liver
2.2鸭肝LDH的分子质量
纯化后的LDH经SDS-PAGE显示为单一条带(图3),鸭肝LDH的亚基分子质量为44.72 kD;经Superdex-200凝胶过滤层析测得全酶分子质量为170.93 kD (图4),由此可以推断该酶由4 个相同的亚基组成。
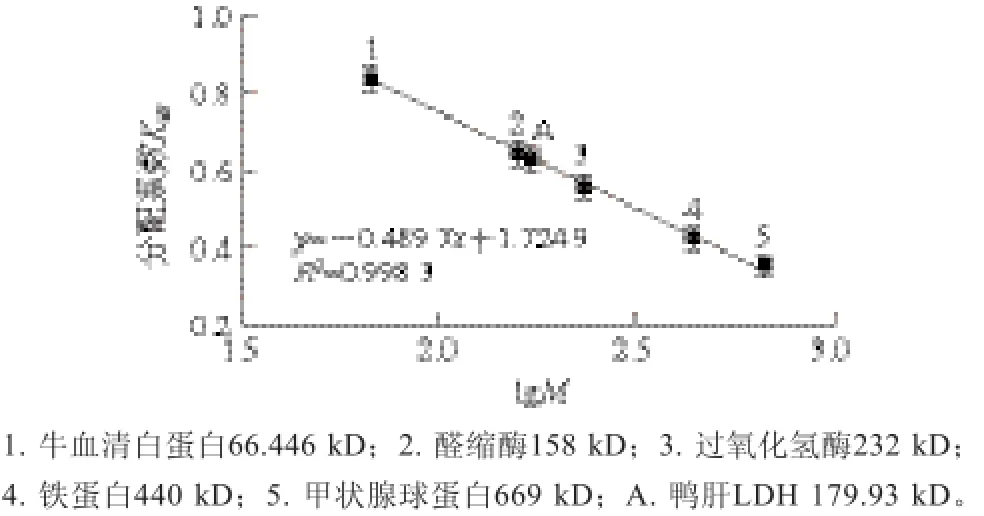
图4 Superdex-200凝胶过滤层析测得的鸭肝LDH分子质量Fig.4 Estimation of molecular weight of LDH by Superdex-200 gel filtration chromatography
2.3鸭肝LDH酶学性质
2.3.1鸭肝LDH的最适反应温度和热稳定性

图5 温度对鸭肝LDH活力的影响Fig.5 Effect of temperature on the activity of LDH from duck liver

图6 鸭肝LDH的热稳定性Fig.6 Thermal stability of LDH from duck liver
如图5所示,该酶最适反应温度为45 ℃。如图6所示,在25~45 ℃范围内,鸭肝LDH热稳定性较好,而高于此温度时酶活力迅速下降,在65 ℃时保温15 min,相对酶活力仅剩余16%左右,在75 ℃时保温15 min相对酶活力几乎完全丧失。
2.3.2鸭肝LDH的最适反应pH值和pH值稳定性
如图7所示,该酶的最适反应pH值为7.4。如图8所示,该酶在pH 4.0时酶活力损失较多,当pH值在5.0~10.0范围内时具有较好的稳定性,4 ℃放置1.3 h相对酶活力还保持在69%以上,由此说明该酶在pH<5.0时酶活力较不稳定,但具有较强的耐碱性,在碱性条件下酶的三维空间结构较稳定。

图7 pH值对鸭肝LDH活性的影响Fig.7 Effect of pH on the activity of LDH from duck liver

图8 鸭肝LDH的pH值稳定性Fig.8 pH Stability of LDH from duck liver
2.3.3鸭肝LDH的米氏常数(Km)

图9 双倒数法测定鸭肝LDH的米氏常数Fig.9 Lineweaver-Burk plot for Kmdetermination of LDH
如图9所示,以NADH为底物,求得鸭肝LDH的Km值为3.407 μmol/L(图9a),对丙酮酸钠的Km值为8.431 μmol/L(图9b),表明鸭肝LDH对底物NADH的亲和力远大于对丙酮酸钠的亲和力。
2.3.4不同有机溶剂对鸭肝LDH活性的影响
如图10所示,氯仿、甲醇、异丙醇、乙醇4 种有机溶剂对鸭肝LDH均有较强抑的制作用,且随着有机溶剂体积分数的增大,抑制作用增强,当有机溶剂体积分数在50%时,鸭肝LDH的相对酶活力损失了近60%,当异丙醇体积分数为60%时,鸭肝LDH活力完全丧失。
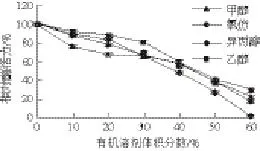
图10 甲醇、氯仿、乙醇、异丙醇对鸭肝LDH活力的影响Fig.10 Effects of methanol, isopropyl alcohol, ethanol and chloroform on the activity of LDH from duck liver
2.3.5不同化合物对鸭肝LDH活性的影响

图11 不同化合物对鸭肝LDH活力的影响Fig.11 Effects of various compounds on the activity of LDH from duck liver
如图11所示,SDS对鸭肝LDH的抑制作用非常强,当其浓度为5 mmol/L时,鸭肝LDH活力就已完全丧失,可能是因为SDS为阴离子变性剂,能够使酶分子中的疏水键和氢键断裂,使酶的三维空间结构发生改变,从而使酶活力降低甚至丧失。而尿素对该酶有激活作用,且随着浓度的不断增大,激活作用越来越小。ASA对鸭肝LDH活力的抑制作用最小,当ASA浓度为30 mmol/L时,该的相对酶活力仍保持在60%以上。草酸和EDTA对该酶都有较强的抑制作用。
2.3.6不同金属离子对鸭肝LDH活性的影响


图12 不同金属离子对鸭肝LDH活力的影响Fig.12 Effects of different metal ions on the activity of LDH from duck liver
如图12所示,Cu2+、Ag+对鸭肝LDH的抑制作用最强,当二者浓度为10 mmol/L时,鸭肝LDH活力几乎完全丧失;Co2+、K+对鸭肝LDH有双重作用,低浓度对该酶有激活作用,高浓度对该酶有抑制作用;Li+、Mg2+、Ca2+对鸭肝LDH的抑制作用较小,当三者浓度为50 mmol/L时,该酶的相对酶活力仍保持在69%以上;Pb2+、Cd2+、Ba2+、Zn2+对该酶均具有一定的抑制作用。
3 讨 论
本实验以鸭肝为材料,从鸭肝中分离纯化得到了电泳纯的LDH,与从其他材料纯化得到的LDH相比,鸭肝LDH有以下特点:1)鸭肝来源较广、价格较低廉、取材方便;2)经实验中DEAE-Sepharose离子交换层析收集到的酶液酶活力较高,不需冷冻干燥便可上凝胶过滤层析柱进行更进一步的纯化,减少了透析及冷冻干燥过程中酶活力的损失,也节约了实验所需的时间,同时得到了鸭肝LDH的均一组分。通过本实验得到的LDH酶比活力、纯化倍数,酶活回收率都较高。
鸭肝LDH的最适反应温度为45 ℃,低于羊心肌(50 ℃)[15]的最适反应温度,鸭肝LDH在45 ℃保温60 min相对酶活力仍保持在68%以上,而高于此温度酶活力迅速下降,在60 ℃保温60 min鸭肝LDH的活力为0,在75 ℃保温15 min酶活力就完全丧失。可能是因为高温促使酶蛋白质分子内基团间相互作用,从而破坏了酶分子的三维空间结构,使酶的催化功能减弱甚至丧失[16]。鸭肝LDH的pH值耐受范围较广,在pH 5.0~10.0范围内具有较好的稳定性,该酶的最适反应pH值为7.4,与猪肌肉(pH 7.5)[17]几乎一致,高于藏系绵羊肌肉(pH 5.8)[18]和低于羊心肌(pH 7.8)[15]来源的LDH,说明不同来源、不同组织中的LDH同工酶对环境pH值的适应性具有一定差异性。
本实验结果表明:鸭肝LDH亚基分子质量为44.72 kD,高于大熊猫(36 kD)[19]、牦牛(36 kD)[20]、牛蛙(35.3、37.6 kD)[11]、藏系绵羊(34 kD)[18]来源的LDH亚基分子质量;该酶对底物NADH的Km值为3.407 μmol/L,对丙酮酸钠的Km值为8.431 μmol/L,与藏系绵羊肌肉(0.022、0.444 μmol/L)[18]、牦牛肌肉(0.097、1.897 μmol/L)[20]、牛蛙骨骼肌(0.028、1.242 μmol/L)[11]的Km相比有较大差异,说明不同材料、不同组织来源的LDH同工酶对底物的亲和力不同,可能是因为生物体为了能更好地适应环境,满足生长代谢需求,产生以多种同工酶形式存在的LDH,这是生物体基因不断进化并选择性表达的结果[21]。
Ag+、Cu2+对鸭肝LDH的抑制作用最强;Co2+、K+对鸭肝LDH有双重作用,低浓度表现为激活作用,高浓度表现为抑制作用,可能是因为金属离子的浓度影响了该酶自身的带电情况,在低浓度时,Co2+、K+可能对LDH的带电量影响较弱,酶分子的三维空间结构没有发生明显变化,并能促进反应形成酶蛋白-金属离子-底物三元配合物的稳定过渡态,从而降低反应所需的活化能,使酶促反应速率加快[22],因而对酶具有激活作用;但当Co2+、K+浓度增大时,大量Co2+、K+的聚集改变了酶分子本身的带电情况,影响了酶蛋白质的空间构型,从而逐渐抑制该酶的活性;Li+、Mg2+、Ca2+对该鸭肝LDH的抑制作用较小,当浓度为50 mmol/L时,该酶的相对酶活力仍保持在69%以上;Pb2+、Cd2+、Ba2+、Zn2+对鸭肝LDH均具有一定的抑制作用。
通过将鸭肝LDH与不同材料来源、不同组织中分离纯化出的LDH同工酶的一些性质进行比较,结果表明LDH同工酶在酶学性质上存在着一定的差异性,可能是因为存在于不同器官的同工酶随器官代谢环境的变化而不断变化,各种同工酶适应于不同细胞或组织在代谢上的不同需要,对生物体的代谢起到不同的调节作用,不同组织器官中的LDH同工酶的类型可能与动物自身的生态习性、行为及器官的功能、组织的能量代谢有关,这也是生物体在自然选择过程中基因选择性表达的结果[23]。
[1] AL-JASSABI S. Purification and kinetic properties of skeletal muscle lactate dehydrogenase from the lizard Agama stellio stellio[J]. Biochemistry. , 2002, 67(7): 786-789.
[2] BERGMEYER H U, BERNT E, HESS B. Lactate dehydrogenase[J]. Methods of Enzymatic Analysis, 1974, 2: 574-579.
[3] CAHN R D, ZWILLING E, KAPLAN N O, et al. Nature and development of lactic dehydrogenases: the two major types of this enzyme form molecular hybrids which change in makeup during development[J]. Science, 1962, 136: 962-969.
[4] TSUJI S, QURESHI M A, HOU E W, et al. Evolutionary relationships of lactate dehydrogenases (LDHs) from mammals, birds, an amphibian, fish, barley, and bacteria: LDH cDNA sequences from Xenopus, pig, and rat[J]. Proceedings of the National Academy of Sciences, 1994, 91(20): 9392-9396.
[5] 李天俊, 吴庆东. 优质肉羊四种组织乳酸脱氢酶同工酶的分析研究[J].动物科学与动物医学, 2002, 19(7): 16-17.
[6] 李福昌, 秦孜娟, 王建民, 等. 鲁北白山羊血清乳酸脱氢酶同工酶的研究[J]. 山东农业大学学报: 自然科学版, 1998, 29(1): 98-101.
[7] 许生成. 青海本地山羊血清乳酸脱氢酶活性及其同功酶的研究[J].青海大学学报: 自然科学版, 2003, 21(3): 1-3.
[8] 刘如笋, 俞清. 原鸡不同组织乳酸脱氢酶同工酶研究[J]. 动物学杂志, 1997, 32(1): 27-28.
[9] 胡思玉, 陈永祥, 赵海涛, 等. 昆明裂腹鱼不同组织乳酸脱氢酶同工酶研究[J]. 贵州农业科学, 2010, 38(2): 140-142.
[10] 施振旦, 麦燕隆, 赵伟. 我国鸭养殖模式及环境控制现状和展望[J].中国家禽, 2012, 34(9): 1-6.
[11] 周静, 郑玉才, 金素钰. 牛蛙乳酸脱氢酶同工酶的分离纯化及其性质研究[J]. 四川动物, 2006, 25(2): 244-246.
[12] 龚韧. 猪心苹果酸脱氢酶的制备、酶学性质及应用研究[D]. 无锡:江南大学, 2008: 10-33.
[13] 李建武, 余瑞元. 生物化学实验原理和方法[M]. 北京: 北京大学出版社, 1994: 171-176.
[14] 王镜岩, 朱圣庚, 徐长法. 生物化学[M]. 北京: 高等教育出版社,2002: 378-380.
[15] 金黎明, 张乐, 蒋本国, 等. 羊心肌乳酸脱氢酶的纯化及性质研究[J].大连民族学院学报, 2006, 8(1): 20-23.
[16] 孙芳, 胡瑞斌, 任美凤, 等. 鸭心苹果酸脱氢酶的分离纯化及酶学性质研究[J]. 食品科学, 2013, 34(23): 239-244. doi: 10.7506/spkx1002-6630-201323049.
[17] TERLECKI G, CZAPI☒SKA E, ROGOZIK K, et al. Investigation of the interaction of pig muscle lactate dehydrogenase with acidic phospholipids at low pH[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2006, 1758(2): 133-144.
[18] 司晓辉, 赵兴波, 郑玉才, 等. 藏系绵羊乳酸脱氢酶A的分离纯化和酶学性质[J]. 农业生物技术学报, 2006, 14(2): 178-182.
[19] 彭浪, 张龙翔. 大熊猫乳酸脱氢酶同工酶H4的分离纯化和某些性质研究[J]. 生物化学杂志, 1995, 11(1): 85-89.
[20] 郑玉才, 司晓辉, 贺庆华, 等. 牦牛乳酸脱氢酶A的分离纯化, 酶学性质及其基因的克隆[J]. 中国农业科学, 2008, 41(5): 1470-1475.
[21] 孙芳, 任美凤, 胡瑞斌, 等. 韭菜酸性磷酸酶的分离纯化及酶学性质[J].食品科学, 2013, 34(17): 187-191. doi: 10.7506/spkx1002-6630-201317040.
[22] 高亚朋, 苏茉, 梁建荣, 等. 绿豆酸性磷酸酶的分离纯化和部分性质研究[J]. 中国粮油学报, 2011, 26(5): 92-96.
[23] 艾晓杰, 杨丽娥, 程美蓉, 等. 白香猪肌肉组织乳酸脱氢酶同工酶的比较分析[C]//动物学专辑: 上海市动物学会2001年年会论文集. 上海, 2001: 72-74.
Isolation, Purification and Partial Characterization of Lactate Dehydrogenase from Duck Liver
FANG Ling, SUN Caiyun, TANG Yunming*
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Key Laboratory of Freshwater Fish Reproduction and Development, Ministry of Education, School of Life Science, Southwest University, Chongqing 400715, China)
Electrophoresis-purity lactate dehydrogenase (LDH) from duck liver was obtained through the procedures of homogenization, buffer solution extraction, ethanol precipitation, ammonium sulfate fractionation, DEAE-Sepharose ion exchange chromatography and Superdex-200 gel filtration chromatography. An activity recovery of 25.79% was obtained. The specifi c activity of the purifi ed enzyme was 668.82 U/mg with a purifi cation fold of 185.78. The total molecular mass of the LDH was 170.93 kD consisting of a 44.72 kD subunit. The optimum temperature and pH for the LDH was 45 ℃and 7.4, respectively. It was stable in the ranges of pH 5-10 and 25-45 ℃. Its Kmwas 3.407 μmol/L towards NADH and 8.431 μmol/L towards sodium pyruvate. The enzyme activity was be strongly inhibited by SDS, oxalic acid, Cu2+and Ag+,but could be enhanced by low concentration of Co2+and K+.
duck liver; lactate dehydrogenase; isolation and purification; characterization
Q946.5
A
1002-6630(2015)15-0151-06
10.7506/spkx1002-6630-201515028
2014-08-11
重庆市科委重点攻关项目(CSTC2011AB1027)
方玲(1988—),女,硕士研究生,主要从事蛋白质与酶工程研究。E-mail:xuemeifl@163.com
唐云明(1960—),男,教授,博士,主要从事蛋白质与酶工程研究。E-mail:tbright@swu.edu.cn

