发酵和焙烤对可可豆多酚、黄酮和风味品质的影响
易桥宾,谷风林*,那治国,房一明徐 飞
(1.黑龙江东方学院食品与环境工程学部,黑龙江 哈尔滨 150086;2.中国热带农业科学院香料饮料研究所,海南 万宁 571533;3.农业部香辛饮料作物遗传资源利用重点实验室,国家重要热带作物工程技术研究中心,海南 万宁 571533)
发酵和焙烤对可可豆多酚、黄酮和风味品质的影响
易桥宾1,2,谷风林2,3,*,那治国1,房一明2,3,徐 飞2,3
(1.黑龙江东方学院食品与环境工程学部,黑龙江 哈尔滨 150086;2.中国热带农业科学院香料饮料研究所,海南 万宁 571533;3.农业部香辛饮料作物遗传资源利用重点实验室,国家重要热带作物工程技术研究中心,海南 万宁 571533)
本实验采用高效液相色谱仪(high performance liquid chromatography,HPLC)、色差仪、电子鼻分别检测未发酵、发酵和焙烤海南可可豆的总酚含量、总黄酮含量、色度和可可豆风味差异。结果表明:未经焙烤的未发酵豆总酚(464.03 mg/10 g)和总黄酮(126.86 mg/10 g)含量明显高于发酵豆总酚(211.86 mg/10 g)和总黄酮(61.98 mg/10 g)含量。105~145 ℃焙烤30 min,未发酵豆总酚和总黄酮含量分别为419.5~129.8 mg/10 g和77.8~16.8 mg/10 g;发酵豆总酚和总黄酮含量分别为182.53~86.25 mg/10 g和34.7~7.0 mg/10 g。其中,125 ℃焙烤20~40 min,未发酵豆总酚和黄酮含量分别为353.74~289.45 mg/10 g和42.86~32.20 mg/10 g;发酵豆总酚和黄酮含量分别为152.08~123.55 mg/10 g和25.12~21.14 mg/10 g。在105~145 ℃的温度焙烤下没食子酸含量变化显著。可可豆色度值的范围:L*值集中在40.0~47.0之间,a*值集中在5.0~6.8之间,b*值集中在4.0~8.5之间。未发酵和发酵可可豆之间,以及不同温度焙烤可可豆之间的电子感官风味分析结果差异较大。
海南可可豆;焙烤;多酚;黄酮;风味
可可具有较高的营养价值,广泛用于巧克力、饮料、糕点和冰激凌制造等行业,与咖啡、茶同被称为世界三大软饮料[1]。近几年来,对可可的研究主要集中在可可豆所富含的多酚特别是黄酮类物质,研究发现,天然可食可可黄烷醇活性物质可扭转和年龄相关的记忆衰退[2]。可可豆是一种富含类黄酮的食品来源,Langer等[3]研究了可可终端产品--碱化黑巧克力中类黄酮-原花青素的含量,为(48.4±4.3)~(334.0±5.9)mg/100 g,其具有极强的抗氧化活性,能有效地清除羟自由基(·OH)和超氧阴离子自由基(O2-·),保护DNA免受·OH引起的氧化损伤,还可以有效地抑制脂质过氧化[4]。可可豆中含有的多酚和黄酮类物质,总量达到336.04~427.22 mg/10 g[5],新鲜脱脂可可豆中表儿茶素含量达到218.9~432.7 mg/10 g[6],多酚类具有抗氧化、抗衰老、抗癌、抗辐射等多种生物活性[7-9]。在以往的研究中,人们往往关注的是不同植物多酚和类黄酮的含量,及其测定方式和功能,而忽视了在样品加工处理过程中保护多酚的条件研究。
可可豆的加工主要由3 个步骤构成,即发酵、干燥和焙烤。Nicholas等[10]在使用木箱发酵新鲜的可可豆后发现多酚类物质含量明显降低了10%~50%,同时在发酵过程中微生物连续不断的活性作用,形成了可可豆的风味前体物质[11],从而降低了可可豆的抗氧化能力[12]。有文献表明20~60 min、120~150 ℃为发酵可可豆常用的焙烤条件[11]。可可豆在焙烤过程中会发生美拉德反应,氨基化合物与羰基化合物缩合,即可可豆中酚酮等含有羰基类的物质与含氨基的氨基酸反应,产生特殊的香气物质,导致可可豆中多酚类物质含量进一步减少[13-14]。
为研究发酵和焙烤对可可豆酚类物质、类黄酮物质和风味的影响,本实验以海南可可豆作为研究对象,以发酵与否、焙烤温度和焙烤时间作为影响因素,测定可可豆中多酚和类黄酮物质总含量的变化、色度和电子鼻感官风味的差异,为可可的开发利用提供理论依据。
1 材料与方法
1.1材料与试剂
海南可可鲜果由中国热带农业科学院香料饮料研究所提供。
无水甲醇、无水乙醇、正己烷、冰醋酸(均为分析纯) 广东省汕头市西陇化工厂;Folin-酚试剂美国Sigma公司;没食子酸(gallic acid,GA)、儿茶素(catechin,CE)、表儿茶素(epicatechin,EC)上海源叶生物科技有限公司。
1.2仪器与设备
DG-0.2真空冻干机 兰州科近真空冻干技术有限公司;单炉咖啡烘焙机 德国Probat公司;全自动磨样机(RS200混合型碾磨仪) 德国Retsch公司;AL104电子天平 美国Mettler Toledo公司;恒温水浴摇床丹麦Foss公司;Z36HK型全能台式高速冷冻离心机 德国Hermle公司;GM-0.33H真空抽滤器 天津市津腾实验设备有限公司;水浴锅 上海精宏实验设备有限公司;KL-RO-20超纯水机 中国沃特尔公司;SPECORD 250PLUS型紫外-可见分光光度仪 德国耶拿公司;1260型安捷伦高效液相色谱仪 美国安捷伦公司;色差仪 美国Xrite公司;电子鼻 法国Alpha MOS公司。
1.3方法
1.3.1可可豆前期处理
可可鲜果去壳后得到可可豆,一部分使用木箱进行自然发酵6 d[15],洗净可可豆,进行晾晒干燥后于-20 ℃条件下冷藏,得到发酵豆(F);另一部分不进行发酵直接洗净,晾晒干燥-20 ℃冷藏,得到未发酵豆(UF)。通过PROBAT咖啡烘焙机焙烤,以20~60 min、120~150 ℃为焙烤条件[11],不同焙烤温度条件:分别设定为105、115、125、135、145 ℃的温度焙烤30 min,表示为UF/F-105、UF/F-115、UF/F-125、UF/F-135、UF/F-145;不同焙烤时间条件:温度设定为125 ℃分别焙烤20、25、30、35、40 min,分别表示为UF/F-20、UF/F-25、UF/F-30、UF/F-35、UF/F-40。焙烤豆和未焙烤豆去皮磨粉过60 目筛备用。
1.3.2多酚和总黄酮提取液的制备
称取5.000 g不同处理的可可粉,加入100 mL 80%的甲醇溶液放于250 mL圆底烧瓶内,置于水浴摇床中35 ℃提取24 h,4 ℃、8 000 r/min低温冷冻离心15 min,真空过滤,用80%的甲醇溶液定容250 mL溶液待测,待测液4 ℃条件下保存。
1.3.3提取物中多酚和总黄酮含量的测定
采用Folin-酚方法[16]测定不同提取液中多酚类物质的总含量。以没食子酸为标准品,相同质量原料提取液的多酚含量表示为每10 g原料(以干质量计,下同)中含有的没食子酸当量(mg GA/10 g);参考蜂胶中总黄酮含量的测定方法,以表儿茶素为标准品,相同质量原料的提取液的总黄酮含量表示为每10 g原料中含有的表儿茶素当量(mg EC/10 g)。
1.3.4可可豆提取物的高效液相色谱(high performance liquid chromatography,HPLC)分析
称取一定量不同处理的可可粉用正己烷脱脂3 次(37 ℃,3×4 h)[17],脱脂可可粉低温干燥后,用80%甲醇溶液35 ℃提取24 h,过滤配制成50 mL溶液[18]。色谱柱:Eclipse plus C18(4.6 mm×100 mm,3.5 ☒m)。用100%甲醇溶液A和pH 2.5~3.0的乙酸溶液B做流动相。分析方法:0~10 min,40%A;10~20 min,60%A;20~30 min,80%A;30~40 min,90%A。检测波长为280 nm,进样体积10 ☒L,流速0.5 mL/min。
1.3.5色度测定
按1.3.1节的方法准备样品,称取精细磨粉和过筛后的可可粉,测定其色度值。
1.3.6电子鼻测定感官风味
准确称量1.3.1节制备的可可粉1.3 g放入进样瓶,上机测定。分析条件:孵化温度50 ℃,振荡速率500 r/min,孵化时间120 s,以合成干燥空气为载气,流速为150 mL/min,注射体积1 500 ☒L,注射针温度60 ℃,注射速率1 000 ☒L/s,获取时间90 s,延滞时间300 s,每个样品重复6 次。
1.4数据分析
数据通过SPSS 19和Origin 9.0软件处理,不同样品之间进行显著性差异分析,以P<0.05为差异显著,同一样品平均数之间采用标准偏差检验,电子鼻结果使用主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1发酵对可可豆多酚和总黄酮含量的影响

图1 未焙烤可可豆多酚和总黄酮含量Fig.1 Total polyphenol and flavonoid contents in unroasted cocoa beans
由图1A可知,未发酵和发酵可可豆在焙烤前多酚总含量分别为(464.03±23.20) mg/10 g和(211.86±16.05) mg/10 g,说明发酵使得多酚大量减少,发酵后多酚含量仅为未发酵的45.66%。可可豆的发酵温度为50~60 ℃,此温度范围酶促褐变反应剧烈,酚类被氧化成醌类。本实验未发酵可可豆多酚含量高于Gu Fenglin等[5]测定的海南发酵豆的301.01 mg/10 g,高于谷风林等[15]所测定的不同发酵方式可可豆的363.70~296.10 mg/10 g的范围,同一个品种有较大差异的原因可能是年份、发酵方式和发酵程度的不同造成。由图1B可知,未发酵和发酵豆在焙烤前总黄酮含量分别为(126.86±0.78)mg/10 g和(61.98±1.17) mg/10 g,说明发酵使得总黄酮大量减少,发酵可可豆仅为未发酵可可豆总黄酮含量的48.86%。未发酵可可豆总黄酮含量接近Gu Fenglin等[5]测定不同年份发酵海南可可豆的黄酮含量(35.03~126.21 mg/10 g)的最大值,发酵豆包含在此范围内。发酵过程对单一的黄酮类物质的影响与对多酚的影响相同,黄酮类物质自身含有酚羟基和羰基在发酵过程中发生氧化、聚合,大量减少。
2.2焙烤对可可豆多酚含量的影响
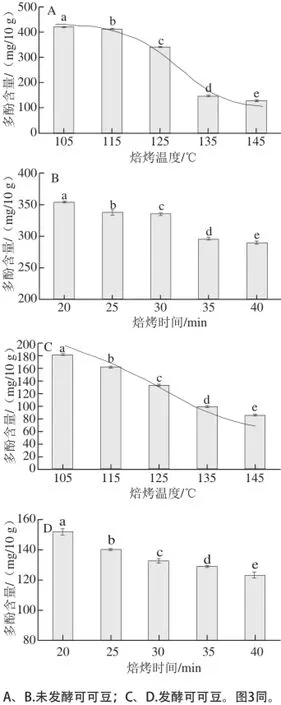
图2 焙烤可可豆的多酚含量Fig.2 Total polyphenol contents in roasted cocoa beans
由图2A可知,经不同焙烤温度焙烤30 min,未发酵可可豆多酚总含量明显减少,焙烤温度升高,可可豆多酚含量呈一定的函数下降趋势,以多酚含量为纵坐标,温度为横坐标,拟合的回归曲线方程见表1,回归方程显著(P<0.05)。在115~135 ℃温度区间内多酚含量变化最显著,变化范围为(412.09±8.22)~(146.73±7.65)mg/10 g。由图2B可知,125 ℃条件下,经不同时间焙烤,未发酵可可豆在20~30 min含量变化差值为(18.10±0.58) mg/10 g,从整体变化趋势分析发现焙烤时间对多酚含量的影响较小。
由图2C可知,经焙烤30 min,不同焙烤温度发酵可可豆多酚含量减少比图2A中未发酵的可可豆多酚含量下降趋势要平缓。在105~145 ℃范围内呈现一定的线性关系,以温度为横坐标,多酚含量为纵坐标,拟合回归曲线方程见表1,回归方程显著(P<0.05),没有显著变化的温度区间,整个105~145 ℃温度区间变化范围为(182.53±0.47)~(86.25±0.80) mg/10 g。由图2D可知,在125 ℃条件下,经20~30 min焙烤,发酵可可豆多酚含量的整体变化差值为(11.20±0.34) mg/10 g,变化量为温度引起变化量的11.6%。
由于发酵可可豆在焙烤之前的发酵过程中损失了大量多酚,造成初始含量低于未发酵可可豆,仅为未发酵可可豆含量的45.66%,使得图2C中多酚含量比图2A中的下降趋势要略平缓。焙烤温度高于100 ℃使得酶类钝化,主要以氨基化合物与羰基化合物之间缩合的美拉德反应为主,且温度为影响反应的关键因素,随温度的升高,可可豆中酚类明显减少。在20~40 min常用的焙烤时间内,时间因素对多酚含量的影响有限,引起的含量变化较小,故在测定3 种单体多酚含量变化时,未将时间作为单因素进行研究。
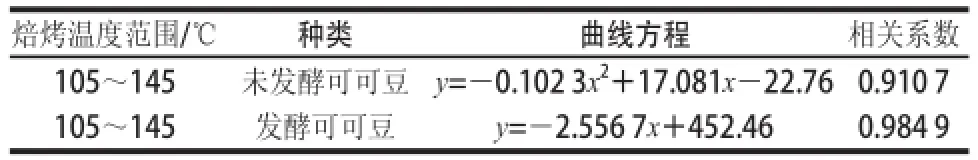
表1 不同温度焙烤可可豆多酚含量变化方程、相关系数Table 1 Variation equations of total polyphenol contents with correlation coefficients and temperature ranges for roasted cocoa beans
2.3焙烤对总黄酮含量的影响
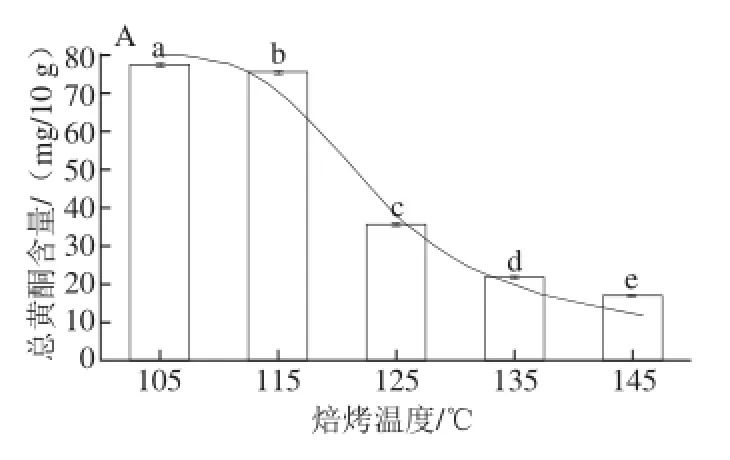
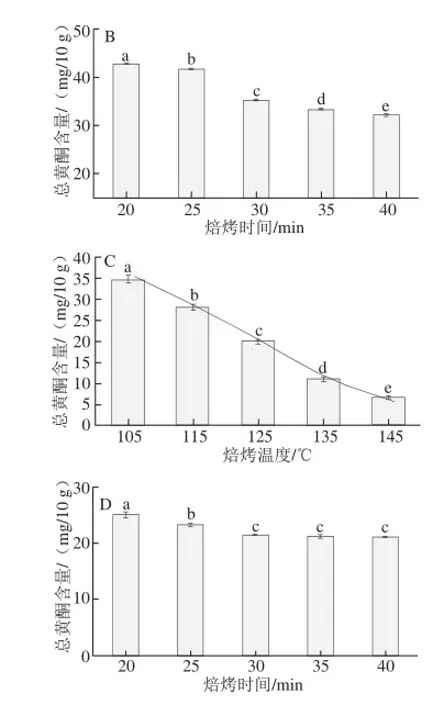
图3 焙烤可可豆的总黄酮含量Fig.3 Total flavonoid contents of roasted cocoa beans
由图3A可知,经不同温度焙烤30 min,未发酵可可豆总黄酮含量在105~115 ℃基本上持平,仅相差2.42 mg/10 g,在115~135 ℃由(75.3±0.11) mg/10 g减少至(21.8±0.07)mg/10 g,变化显著,占总干质量含量由(0.75±0.012)%降至(0.22±0.023)%,说明115~135 ℃是总黄酮在未发酵可可豆焙烤过程中含量变化的转折点,整体变化趋势呈一定的函数关系,以总黄酮含量为纵坐标,温度为横坐标,拟合回归曲线方程见表2,回归方程显著(P<0.05)。由图3B可知,未发酵可可豆在125 ℃条件下,经不同时间焙烤,25~30 min区间内总黄酮含量变化较明显,变化差值也仅为6.33 mg/10 g,20~40 min内总黄酮含量变化范围为(42.86±0.03)~(32.20±0.15) mg/10 g。
由图3C可知,经不同温度焙烤30 min,发酵可可豆总黄酮含量呈台阶式梯度下降,不同温度区间内总黄酮含量变化较小,在105~145 ℃呈一定的线性关系,以总黄酮含量为纵坐标,温度为横坐标,拟合回归曲线方程见表2,回归方程显著(P<0.05);135 ℃时总黄酮含量为(11.28±0.01) mg/10 g,为焙烤之前含量的18.20%,仅为可可豆总干质量的0.11%,说明发酵豆经较高温度焙烤后进一步损失了80%的黄酮类物质。由图3D可知,5 个时间点的总黄酮含量值基本上持平,变化范围为(25.12±0.18)~(21.14±0.03) mg/10 g。
焙烤过程对总黄酮含量整体的影响趋势为:不同焙烤温度下,未发酵可可豆有一个显著变化的温度区间(115~135 ℃),发酵可可豆在整个实验选定的温度范围内含量变化呈一定的线性关系,高于135 ℃焙烤,总黄酮含量减少至很低;经不同时间焙烤,未发酵可可豆总黄酮含量在20~30 min范围内有较明显变化,发酵可可总豆黄酮含量在整个设定的实验时间范围内含量变化不明显。
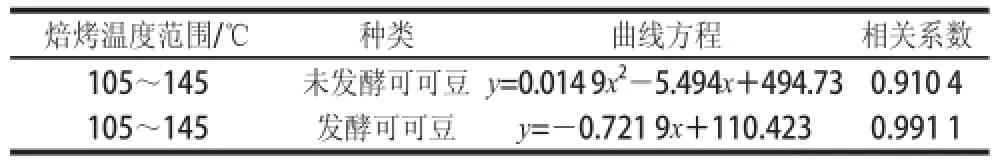
表2 不同温度焙烤可可豆总黄酮含量变化方程、相关系数Table 2 Variation equations of total flavonoid contents withcorrelation coefficients and temperature ranges for roasted cocoa beans
2.4可可豆提取物的HPLC图谱分析
为选择一个使可可豆中3 种主要多酚(没食子酸、儿茶素和表儿茶素)吸收都较强的合适吸收波长,以获得较高的灵敏度,根据相关文献选择比较了280、320、510 nm波长处3 种标准品混合溶液的吸光度差异[19]。如图4所示,结果表明3 种标准品混合溶液在280 nm波长处的吸光度远比其他2 种波长强。故最终选择检测波长为280 nm。
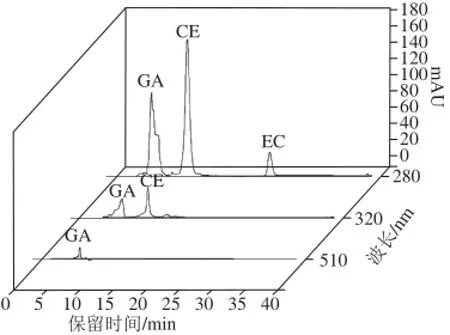
图4 标准品在280、320、510 nm波长处的HPLC结果Fig.4 HPLC of three standard substances at 280, 320 and 510 nm
由2.1、2.2节可知发酵与否和焙烤温度2 个因素对总酚含量影响较大,为观察3 种多酚单体含量的变化趋势,以未发酵豆、发酵豆和3 个温度焙烤豆(105、
125、145 ℃条件下焙烤30 min)作为研究对象进行液相色谱分析,选择没食子酸、儿茶素和表儿茶素标准品配制成混标。由图4可知,3 种标准品出峰顺序为没食子酸(GA)、儿茶素(CE)和表儿茶素(EC),与文献中酚类物质标准品的出峰顺序相一致[20]。由图5可知,未发酵可可豆(UF)GA和EC峰面积明显高于发酵可可豆(F),可能是造成2.1节中未发酵豆与发酵豆多酚、总黄酮含量差异的主要原因之一;CE峰处物质含量相差不大,对总黄酮含量变化贡献较小。由图6A可知,未发酵焙烤可可豆(UF)在105、125、145℃ 3 个焙烤温度下,GA峰面积变化较为明显,可能是影响2.2节中可可豆不同焙烤温度下多酚含量变化的主要原因之一;CE和EC峰处物质含量变化不明显,对总黄酮含量变化贡献较小。图6B中,GA、CE和EC峰面积变化趋势和图6A接近。

图5 未焙烤可可豆的提取物在280 nm波长处的HPLC结果Fig.5 HPLC of unroasted cocoa bean extracts a t 280 nm
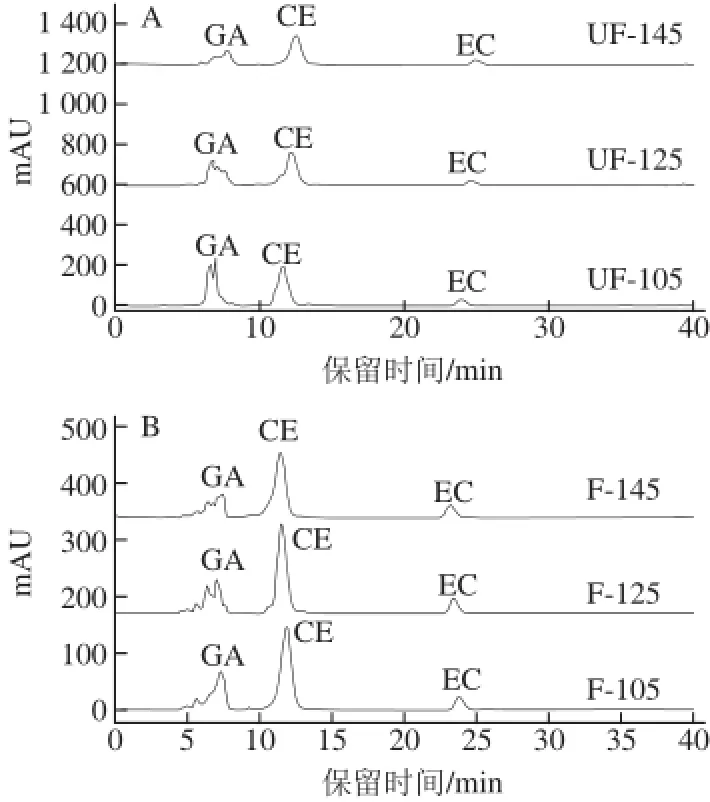
图6 焙烤可可豆的提取物在280 nm波长处的HPLC结果Fig.6 HPLC of roasted cocoa bean extracts at 280 nm
从HPLC图谱变化分析可知,发酵与否和焙烤温度对3 种单体多酚的影响排序分别为:没食子酸(明显)>表儿茶素(较明显)>儿茶素(不明显)。
2.5可可豆色度的变化
L*值是色彩的明度值,表示色彩的明暗程度;a*值和b*值是色彩的色度值,a*值表示从红(+a*)到绿(-a*)渐变、b*值表示从黄(+b*)到蓝(-b*)渐变[21-22]。由表3可知,发酵与未发酵豆、不同温度焙烤豆L*、a*、b*值之间均存在显著性差异:未焙烤豆L*值大小为UF>F,说明未发酵豆汤色明度要好于发酵豆;不同温度焙烤豆L*值大小分别为UF-105>UF-115>UF-125>UF-135>UF-145和F-105>F-115>F-125>F-135>F-145,即温度越高,L*值越小,汤色明度越差。未焙烤豆的a*值大小为UF<F,说明发酵可可豆汤色相较未发酵可可豆的汤色更红;焙烤可可豆中未发酵豆在125~135 ℃范围内a*值较高,发酵豆在115~125 ℃范围较高,说明此范围是焙烤豆偏红的区域。未发酵可可豆的b*值大于发酵豆,即未发酵可可豆汤色比发酵可可豆较黄;焙烤可可豆的b*值高于未焙烤可可豆,焙烤可可豆汤色比未焙烤可可豆较黄。由表3可知,不同焙烤时间可可豆的色度值差异不明显。综上所述,发酵与否、焙烤温度对可可豆的色度值有明显的影响,而焙烤时间对可可豆的色度值影响较小。由图7可知,可可豆的色度值正态分布情况为,L*值集中在40.0~47.0之间,a*值集中在5.0~6.8之间,b*值集中在4.0~8.5之间,说明可可豆的色度值向一定的范围趋近。

表3 可可豆色度值Table 3 Color parameters of cocoa beans

图7 可可豆色度值的正态分布曲线Fig.7 Normal distribution curve of cocoa bean chroma
2.6未发酵、发酵和焙烤可可豆的风味比较
有文献表明可可豆在发酵过程中形成了其特征香气的前体物质[11]。由图8可知,未发酵可可豆和发酵可可豆分别聚集在不同区域且无重叠部分,第一主成分(PC1)贡献率为99.188%,说明了第一主成分包含大量信息,能反映被测样品的整体信息,2 个样品在横坐标上的距离越大,表明它们的差异越大,未发酵与发酵可可豆能被电子鼻明显区分开[23-24],说明发酵改变了可可豆的风味。

图9 焙烤可可豆电子鼻主成分分析图Fig.9 Principal component analysis of roasted cocoa beans
电子鼻对经30 min不同温度焙烤下可可豆的PCA分析见图9A。未发酵焙烤可可豆和发酵焙烤可可豆可以较好地用电子鼻系统进行区分,其第一主成分(PC1)贡献率达到了97.274%。PC1和PC2的总贡献率为99.843%,所以2 个主成分能较好地反映原始高维矩阵数据的信息。另外,未发酵焙烤可可豆和发酵焙烤可可豆在不同的焙烤温度下,风味有较明显的改变,从整体区域聚集情况看,135、145 ℃高温焙烤区域数据较为集中,其区分效果没有低温区域好,UF-125和F-125接近,UF-135和F-135有重叠区域,这说明未发酵可可豆和发酵可可豆在125~135 ℃的焙烤条件下风味差异小于其他区域,区分结果差。
电子鼻对经125 ℃不同时间焙烤下可可豆的PCA分析见图9B。经不同时间焙烤后未发酵豆和发酵豆,基本上集中在一个区域内,风味差别小,无明显改变,区分结果差。
为更好地观察125、135 ℃温度焙烤下差异较小的4 种焙烤可可豆(UF-125、F-125、UF-135、F-135)的区别,对样品电子鼻的6 个传感器信号最大响应值数据进行分析,并形成直观的雷达图[25],如图10所示。T30/1、T70/2和LY2/AA传感器的响应值集中差异较小,P30/2、PA/2和LY2/gCT相差较大,从整个响应值的集中趋势分析125~135 ℃的焙烤温度范围内,未发酵和发酵可可豆相似部分在T30/1、T70/2和LY2/AA型传感器上,差异主要在于P30/2、LY2/gCT和PA/2型传感器上。
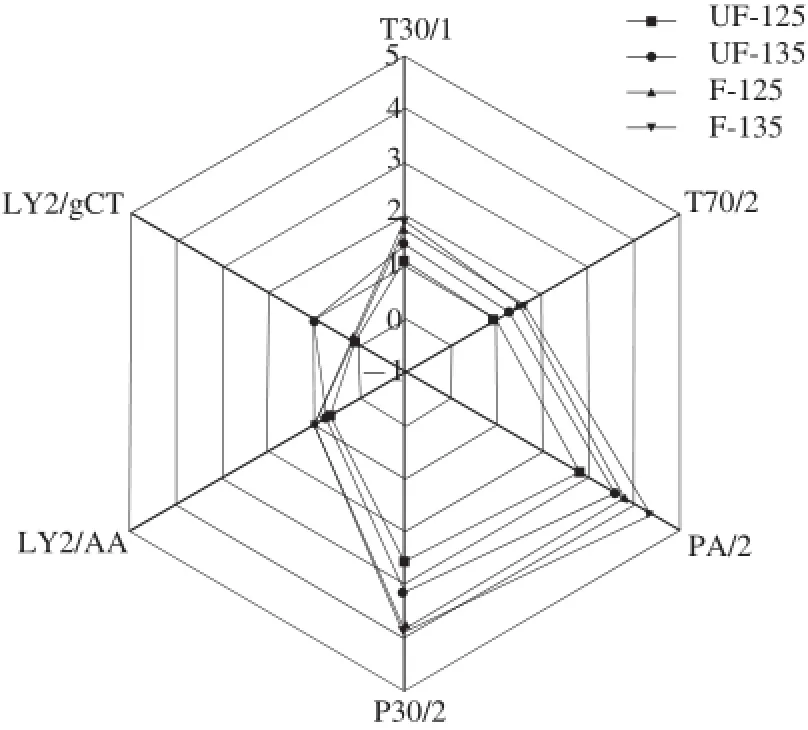
图10 4 种焙烤可可豆的雷达图Fig.10 Radar chart of four samples of roasted cocoa beans
3 结 论
发酵后可可豆中多酚和总黄酮含量大量减少,均减少至未发酵前的50%以下,3 种单体多酚中没食子酸和表儿茶素含量显著减少,儿茶素含量变化不明显;发酵后可可豆色度发生明显变化,未发酵豆比发酵豆汤色好,发酵豆比未发酵豆更红,未发酵豆比发酵豆更黄;未发酵豆和发酵豆之间电子感官风味主成分分析聚集区域差别大,风味差异明显。
可可豆经不同温度焙烤后多酚和总黄酮含量呈一定的线性变化规律,在105~145 ℃温度范围内未发酵豆多酚和总黄酮含量表现为二次方程函数变化规律,其中未发酵豆在115~135 ℃温度区间变化显著,发酵豆表现为一次方程函数变化趋势;经不同温度焙烤后的未发酵豆和发酵豆所含3 种多酚单体中没食子酸含量随温度的升高而减少,儿茶素和表儿茶素含量随温度的升高变化较小;经105~145 ℃焙烤后未发酵豆和发酵豆色度值存在一定差异,并出现L*、a*和b*值分别向40.0~47.0、5.0~6.8和4.0~8.5集中的趋势;经不同温度焙烤后的未发酵豆和发酵豆之间电子感官风味差异有一定的变化规律,105~115 ℃低温焙烤区域比较分散差异大,125 ℃中温焙烤区域差异较大,135~145 ℃高温焙烤比较集中差异较小,由低温至高温焙烤未发酵豆和发酵豆之间风味差异有减小的趋势。
经20~40 min焙烤后,未发酵豆多酚和总黄酮含量在25~35 min之间变化较大,发酵豆在20~30 min之间变化较大,二者都呈减少趋势;未发酵豆的L*、a*和b*值分别接近于46.00、6.50和9.00,发酵豆的L*、a*和b*值分别接近于40.20、6.00和5.15;125 ℃焙烤20~40 min后,未发酵豆和发酵豆的电子感官风味差异小,区分结果较差。
[1] 黄希韵, 魏丽珍, 吴微, 等. 速溶奶茶的研究进展及前景[J]. 饮料工业, 2009, 12(11): 1-4.
[2] BRICKMAN A M, KHAN U A, PROVENZANO F A, et al. Enhancing dentate gyrus function with dietary flavanols improves cognition in older adults[J]. Nature Neuroscience, 2014, 17(2):1798-1803.
[3] LANGER S, MARSHALL L J, DAY A J, et al. Flavanols and methylxanthines in commercially available dark chocolate: a study of the correlation with nonfat cocoa solids[J]. Journal of Agricultural and Food Chemistry, 2011, 59(15): 8435-8441 .
[4] de REZENDEA A A A, ULRICH G, DA ROSA GUTERRESA Z,et al. Protective effects of proanthocyanidins of grape(Vitis vinifera L.) seeds on DNA damage induced by doxorubicin in somatic cells of Drosophila melanogaster[J]. Food and Chemical Toxicology, 2009, 47(7): 1466-1472.
[5] GU Fenglin, TAN Lehe, WU Huasong, et al. Comparison of cocoa beans from china, indonesia and papua new guinea[J]. Foods, 2013,2(2): 183-197.
[6] KIM H, KEENEY P G. (-)-Epicatechin content in fermented and unfermented cocoa beans[J]. Journal of Food Science, 1984, 49(4):1090-1092.
[7] ABBE MALEYKI M J, AMIN I. Polyphenols in cocoa and cocoa products: is there a link between antioxidant properties and health?[J]. Molecules, 2008, 13(9): 2190-2219.
[8] OTHMAN A, ISMAIL A, GHANI N A, et al. Antioxidant capacity and phenolic content of cocoa beans[J]. Food Chemistry, 2007, 100(4):1523-1530.
[9] RIMBACH G, MELCHIN M, MOEHRING J, et al. Polyphenols from cocoa and vascular health: a critical review[J]. International Journal of Molecular Sciences, 2009, 10(10): 4290-4309.
[10] NICHOLAS C, TOM D W, SOLOMON K A, et al. Fermentation of cocoa beans: influence of microbial activities and flavone concentrations on the flavour of chocolate[J]. Journal of the Science of Food amd Agriculture, 2008, 88(13): 2288-2297.
[11] BIEHL B, ZIEGLEDER G. Encyclopedia of food sciences and nutrition[M]. 2nd ed. Pittsburgh: Academic Press, 2003: 1441-1458.
[12] MISNAWI, JINAP S, JAMILAH B, et al. Effects of incubation and polyphenol oxidase enrichment on colour, fermentation index,procyanidins and astringency of unfermented and partly fermented cocoa beans[J]. International Journal of Food Science and Technology,2003, 38(3): 285-295.
[13] NOOR-SOFFALINA S S, JINAP S, NAZAMID S, et al. Effect of polyphenol and pH on cocoa Maillard-related flavour precursors in a lipidic model system[J]. International Journal of Food Science and Technology, 2009, 44(1): 168-180.
[14] CHARLTON A J, BAXTER N J, KHAN M L, et al. Polyphenol/ peptide binding and precipitation[J]. Journal of Agricultural and Food Chemistry, 2002, 50(6): 1593-1601.
[15] 谷风林, 房一明, 徐飞, 等. 发酵方式与萃取条件对海南可可豆多酚含量的影响[J]. 中国食品学报, 2013, 13(8): 269-271.
[16] 张国友, 唐玲, 陈玮, 等. 分光光度法测定蒙古栎叶中多酚的含量[J].中国科学院研究生院学报, 2009, 3(5): 319-322.
[17] REDOVNIKOVIC I R, DELONGA K, MAZOR S. Polyphenolic content and composition and antioxidative activity of different cocoa liquors[J]. Czech Journal of Food Sciences, 2009, 27(5): 330-337.
[18] CAI Yizhong, LUO Qiong, SUN Mei, et al. Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer[J]. Life Sciences, 2004, 74(17): 2157-2184.
[19] 张水平, 谷风林, 吴桂苹, 等. 胡椒果与胡椒叶抗氧化能力的比较[J].食品工业科技, 2013, 34(20): 132-133.
[20] 陈智毅, 徐玉娟, 尹艳, 等. 甜玉米多酚类成分的测定[J]. 食品科学,2010, 31(10): 236-237.
[21] 吴瑞梅, 赵杰文, 陈全胜, 等. 绿茶汤色品质感官评价的色差仪表征方法研究[J]. 河南农业科学, 2014, 43(1): 149-153.
[22] 赖凌凌, 郭雅玲. L*、a*、b*表色系统与绿茶汤色的相关性分析[J].热带作物学报, 2011, 32(6): 1172-1175.
[23] 赵颖, 王飞生, 许灿, 等. 不同处理工艺板栗酥饼风味成分的电子鼻检测[J]. 食品工业科技, 2014, 35(3): 285-286.
[24] 陈晓明, 马明辉, 李景明, 等. 电子鼻在天然苹果香精检测中的应用[J].食品科学, 2007, 28(3): 261-265.
[25] 胡明明, 张国文, 何力. 响应面法优化超声波提取花生壳多酚[J]. 南昌大学学报: 理科版, 2011, 35(3): 241-245.
Effect of Fermentation and Roast on Polyphenols, Flavonoids and Flavors in Cocoa Beans
YI Qiaobin1,2, GU Fenglin2,3,*, NA Zhiguo1, FANG Yiming2,3, XU Fei2,3
(1. Department of Food and Environmental Engineering, East University of Heilongjiang, Harbin 150086, China;2. Spice and Beverage Research Institute, Chinese Academy of Tropical Agricultural Sciences, Wanning 571533, China;3. Key Laboratory of Genetic Resources Utilization of Spice and Beverage Crops, Ministry of Agriculture,National Center of Important Tropical Crops Engineering and Technology Research, Wanning 571533, China)
The differently processed cocoa beans such as unfermented, fermented and roasted cocoa beans were anzlyzed for total polyphenol contents, total flavonoid contents, chroma, and flavors by HPLC, color difference meter and electronic nose. The results showed that total polyphenol and flavonoid contents in unroasted unfermented cocoa beans were significantly higher than those of the unroasted fermented ones. By roasting at 105-145 ℃ for 30 min, total polyphenol content ranged from 419.5 to 129.8 mg/10 g in unfermented cocoa beans and ranged from 182.53 to 86.25 mg/10 g in fermented cocoa beans. Total flavonoid content was in the range of 77.8-16.8 mg/10 g for unfermented cocoa beans, and 34.7-7.0 mg/10 g for fermented cocoa beans. By roasting at 125 ℃ for 20-40 min, total polyphenol content ranged 353.74-289.45 mg/10 g in unfermented cocoa beans and ranged from 152.08 to 123.55 mg/10 g in fermented cocoa beans. Total flavonoids were found to be between 42.86 mg/10 g and 32.20 mg/10 g for unfermented cocoa beans, and 25.12-21.14 mg/10 g for fermented cocoa beans. The content of gallic acid was significant changed by roasting temperature in the range of 105-145 ℃ for 30 min. The range of chromaticity values in cocoa beans were in the range of 40.0-47.0 for L*, and 5.0-6.8 for a*, and 4.0-8.5 for b*. Unfermented cocoa beans were different from fermented cocoa beans by sensory quality and flavor. By roasting at 105-145 ℃ for 30 min, cocoa beans presented a large difference in electronic sensory evaluation.
cocoa beans from Hainan; roast; polyphenols; flavonoids; flavor
TS201.1
A
1002-6630(2015)15-0062-08
10.7506/spkx1002-6630-201515013
2014-11-13
中央级公益性科研院所基本科研业务费专项(1630052012017)
易桥宾(1990—),男,硕士研究生,研究方向为热带作物产品加工。E-mail:yiqiaobin@yeah.net
谷风林(1976—),男,副研究员,博士,研究方向为食品化学。E-mail:xiaogu4117@163.com

