艾蒿精油的抑菌活性和稳定性
段伟丽,刘艳秋,包怡红*,2
(1.东北林业大学林学院,黑龙江哈尔滨150040;2.黑龙江省林下经济资源研发与利用协同创新中心,黑龙江哈尔滨150040)
艾蒿精油的抑菌活性和稳定性
段伟丽1,刘艳秋1,包怡红*1,2
(1.东北林业大学林学院,黑龙江哈尔滨150040;2.黑龙江省林下经济资源研发与利用协同创新中心,黑龙江哈尔滨150040)
采用滤纸片法测定艾蒿精油的抑菌活性,平板涂布法测定其最低抑菌浓度(MIC);同时研究了艾蒿精油抑菌活性的酸碱稳定性、热稳定性、紫外稳定性,以及壳聚糖、CaCl2、NaCl对艾蒿精油抑菌效果的影响。结果表明:艾蒿精油对3种受试菌的抑制效果有较大差异,对革兰氏阳性菌的抑制作用较强,对革兰氏阴性菌的抑制作用较弱;精油对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌的MIC分别为2.5、5、10滋L/mL。艾蒿精油具有良好的紫外稳定性;温度和pH对艾蒿精油的抑菌效果影响较大,温度低于40℃时抑菌活性较好,高于40℃,则抑菌活性逐渐下降;酸性条件下可增强艾蒿精油的抑菌活性。壳聚糖、CaCl2、NaCl均可增加艾蒿精油的抑菌效果,且壳聚糖、CaCl2对艾蒿精油抑菌效果的影响大于NaCl。
艾蒿精油;抑菌活性;稳定性
为了防止食品腐败变质,常常在食品中添加保鲜剂[1]。植物精油作为天然源保鲜剂的重要来源,以直接接触或熏蒸的方式在食物周围形成抑菌氛围而达到防腐保鲜[2-4]。Mohammad J等[5]发现牛至精油质量分数为1%即可对金黄色葡萄球菌、大肠杆菌、腐败希瓦氏菌、小肠结肠炎耶尔森菌等有明显的抑制作用。
艾蒿,学名艾(Artemisia argyi Levl.et Vent),俗称大艾、生艾、月艾等,为菊科蒿属多年生草本植物或半灌木,植株有浓烈香气,具有抗菌消炎、抗病毒、平喘、镇咳、祛痰、抗过敏、止血和抗凝血、增强免疫功能等作用[6],还可作为天然整理剂对织物进行抗菌防臭的整理。因其独特的芳香气味和生物活性,广泛应用于食品保鲜、驱虫、医药、化妆品等多个领域[7],开发和应用前景十分广阔。作者就艾叶精油对枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌的抑制作用进行研究,旨在寻求一种绿色安全、无污染的食品保鲜剂,也为艾蒿精油的综合开发利用提供全新的途径。
1 材料与方法
1.1材料与试剂
艾蒿精油通过水蒸气蒸馏法提取,由作者所在实验室自制。
大肠杆菌(Escherichia coli),金黄色葡萄球菌(Staphylococcusaureus),枯草杆菌(Bacillus subtilis),所有供试菌种均来源于东北林业大学微生物实验室。
牛肉膏蛋白胨培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂18 g/L,蒸馏水1 000 mL;pH 7.2~7.4。
吐温-80,天津市光复精细化工研究所提供。
1.2仪器与设备
水蒸气蒸馏装置,作者所在实验室固有设备;高压蒸汽灭菌锅,上海博讯实业有限公司制造;电热恒温培养箱,天津市泰斯特仪器有限公司制造;恒温水浴锅,上海一恒科技有限公司制造;还有实验室自备超净工作台、移液枪等。
1.3方法
1.3.1精油的制备配制质量分数0.1%的吐温-80溶液,灭菌,用吐温-80溶液稀释精油至体积分数为25%,混匀。
1.3.2菌悬液的制备从经过活化2~3次的菌体斜面上挑取一环菌体接种于相应的液体培养基中,放入恒温振荡培养箱培养至对数生长期,使用平板计数法调整浓度为106~107cfu/mL,备用[8]。
1.3.3抑菌圈的测定采用滤纸片法测定艾蒿精油对3种供试菌的抑菌活性。用打孔器制直径为6 mm的圆滤纸片,灭菌,备用。在无菌环境下,向已灭菌的培养皿中倒入培养基15~20 mL,冷却。取各种待测菌悬液100滋L,分别涂布在相应的固体培养基上,涂抹均匀,制成含菌平板。取滤纸片贴在含菌平板上,每皿3片,每片滤纸上滴加10滋L艾蒿精油溶液,以吐温-80做对照,于恒温培养箱中37℃培养24h。平行3次,交叉法测量抑菌直径,取平均值。
1.3.4最低抑菌浓度(MIC)的测定试管灭菌,编号,每管加入相应的液体培养基,采用二倍稀释法配制一系列梯度的精油溶液,使最终精油体积分数范围在0.625~40滋L/mL,每个试管中再加入50滋L含菌浓度为106~107cfu/mL的菌悬液。以质量分数0.1%的吐温-80溶液为对照,37℃培养24 h,每管取100滋L涂布,培养24 h,观察细菌生长状况,以平板无细菌生长的精油体积分数作为最低抑菌浓度。
1.3.5抑菌活性热稳定性实验将体积分数25%的精油分别置于20、40、60、80、100℃热处理15 min,冷却到室温,滴加菌悬液100滋L于平板制成含菌平板,取3个直径6 mm的滤纸片贴于含菌平板表面,每个滤纸片滴加精油溶液10滋L,37℃恒温培养24 h,观察热处理对艾蒿精油抑菌活性的影响。
1.3.6抑菌活性酸碱稳定性实验用质量分数2%的NaOH溶液和体积分数50%的柠檬酸分别将质量分数0.1%吐温-80的pH调为3、4、5、6、7、8、9、10,再将精油稀释至体积分数25%,配制相同体积分数不同pH的精油溶液。滴加菌悬液100滋L于平板制成含菌平板,取3个直径6 mm滤纸片贴于含菌平板表面,每个滤纸片滴加精油溶液10滋L,37℃恒温培养24 h,比较pH对精油抑菌活性的影响。
1.3.7抑菌活性紫外稳定性实验体积分数25%的精油紫外灯各处理10、20、30、40、50、60 min。滴加菌悬液100滋L于平板中制成含菌平板,取3个直径为6 mm的滤纸片贴于含菌平板表面,每个滤纸片滴加精油溶液10滋L,37℃恒温培养24 h,测定紫外线照射对艾蒿精油抑菌活性的影响。
1.3.8壳聚糖对艾蒿精油抑菌效果的影响将壳聚糖溶于体积分数1%醋酸溶液,配制不同质量浓度的壳聚糖溶液,调节pH至5.4。将艾蒿精油用少量吐温-80溶液乳化,加入壳聚糖溶液中,得到艾蒿精油体积分数相同、壳聚糖质量浓度不同(0.25、0.5、1、2、3 g/dL)的溶液。将不同壳聚糖质量浓度的精油溶液分别滴加10滋L在相应平板的滤纸片上,以不含艾蒿精油的壳聚糖溶液为对照组,按照1.3.3的方法测壳聚糖对艾蒿精油抑菌效果的影响。
1.3.9CaCl2对艾蒿精油抑菌效果的影响取适量CaCl2溶于质量分数0.1%吐温-80水溶液中,得到不同质量浓度的CaCl2溶液。加入少量精油,配制艾蒿精油体积分数相同、CaCl2质量浓度不同(0.25、0.5、1、2、3 g/dL)的溶液,以不加艾蒿精油的CaCl2溶液为对照组,按照1.3.3的方法测定CaCl2对艾蒿精油抑菌效果的影响。
1.3.10NaCl对艾蒿精油抑菌效果的影响取适量NaCl溶于质量分数0.1%吐温-80水溶液中,得到不同质量浓度的NaCl溶液。加入少量精油,配制艾蒿精油体积分数相同、NaCl质量浓度不同(0.25、0.5、1、2、3 g/dL)的溶液,以不含艾蒿精油的NaCl溶液为对照组,按照1.3.3的方法测定NaCl对艾蒿精油抑菌效果的影响。
2 结果与分析
2.1艾蒿精油的抑菌活性
采用滤纸片法研究艾蒿精油的抑菌活性,结果见表1,艾蒿精油对3种供试菌均有抑制作用,抑菌活性排序为:对金黄色葡萄球菌>对枯草芽孢杆菌>对大肠杆菌。对金黄色葡萄球菌和枯草芽孢杆菌的抑制作用较强,对大肠杆菌的抑制作用较弱,表明其对革兰氏阳性菌的抑制作用强于对革兰氏阴性菌。研究表明,对于植物精油的抑菌效果,革兰氏阳性菌比革兰氏阴性菌更为敏感,这是因为革兰氏阴性菌细胞壁外侧含有一层脂多糖,能够阻止疏水性的化合物进入到菌体细胞体内,从而降低了抑菌效果。

表1 艾蒿精油对不同菌种的抑菌活性Table 1Antimicrobial activities of essential oil from Artemisia argyi against 3 tested microbes
2.2最低抑菌体积分数
由于不同菌种对艾蒿精油的敏感程度不同,最低抑菌体积分数也各不相同,结果见表2。当精油体积分数仅为2.5滋L/mL时,平板上就无金黄色葡萄球菌落出现,而枯草芽孢杆菌、大肠杆菌的最低抑制体积分数分别为5、10滋L/mL。可见,极少量的精油即可抑制细菌生长,实用成本可极大降低。

表2 艾蒿精油对供试菌的MICTable 2MICs of essential oil from Artemisia argyi against 3 tested microbes
2.3艾蒿精油抑菌效果的热稳定性
不同温度的热处理对艾蒿精油抑菌效果的影响结果见图1。

图1 热处理对艾蒿精油抑菌效果的影响Fig.1Antibacterialactivitiesofessentialoilfrom Artemisia argyi at different temperatures against 3 tested microbes
可知,低于40℃时,艾蒿精油对3种供试菌保持良好的抑制活性;高于40℃时,精油对供试菌的抑菌圈直径大幅度下降,100℃时抑菌作用非常弱。表明,艾蒿精油在40℃以上的环境中抑菌成分逐渐挥发,抑菌效果的热稳定性较差,达到100℃时,抑菌成分含量极少,因而抑菌圈明显缩小。但在实际应用过程中,用于食品的保鲜温度均小于40℃,所以并不影响艾蒿精油的应用。
2.4艾蒿精油抑菌效果的酸碱稳定性
不同pH处理对艾蒿精油抑菌效果的影响结果见图2。

图2 pH对艾蒿精油抑菌效果的影响Fig.2Antibacterialactivitiesofessentialoilfrom Artemisia argyi at different pH values against 3 tested microbes
质量分数0.1%吐温-80溶液的自然pH约为5。由图2可知,pH在6~7时,随着pH的增加抑菌圈直径反而减小;pH大于7时,其抑菌能力又有所提高;pH大于9时,抑菌能力稍有下降。这与李娅男等[9]人的实验结果一致,原因是在酸性环境下,不仅细菌本身的活性降低,还可以降低精油中酚类化合物上所带的酚羟基的电离度,使其疏水性增加,更易溶于细菌细胞膜的脂相和蛋白质的疏水区域,与细胞膜上的蛋白质结合能力更强[10];pH>7时抑菌能力提高的原因可能是碱性条件抑制了细菌的生长。所以,在酸性条件下艾蒿精油的抑菌活性增强。
2.5艾蒿精油抑菌效果的紫外稳定性
紫外线照射不同时间对艾蒿精油抑菌效果的影响结果见图3。
可见,随着紫外照射时间的增加,艾蒿精油对供试菌的抑菌活性基本不发生变化,这与刘玉民等[11]人的研究结果相同。表明,艾蒿精油具有良好的紫外稳定性,其成分结构与活性不受紫外线的影响。

图3 紫外线对艾蒿精油抑菌效果的影响Fig.3Antibacterialactivitiesofessentialoilfrom Artemisia argyi under ultraviolet irradiation for different time
2.6壳聚糖对艾蒿精油抑菌效果的影响
由图4可知,壳聚糖可增强艾蒿精油的抑菌效果,壳聚糖质量浓度低于1 g/dL时,随着壳聚糖质量浓度的增加,艾蒿精油对3种供试菌的抑菌圈直径显著增加,金黄色葡萄球菌的抑菌圈直径增加速度较枯草芽孢杆菌、大肠杆菌慢;壳聚糖质量浓度高于1 g/dL,3种供试菌的抑菌圈直径变化不明显。

图4 壳聚糖对艾蒿精油抑菌效果的影响Fig.4Effect of Chitosan on the antibacterial activities of essential oil from Artemisia argyi
从图5可以看出,壳聚糖本身具有抑菌活性,单独使用时即可对供试菌产生明显的抑制作用,与艾蒿精油联合使用可显著提高其抑菌效果。壳聚糖的聚阳离子与微生物带负电荷的细胞膜作用,使细胞发生形变、泄露,还可与DNA结合形成稳定的复合物,阻碍DNA的合成[12-14]。通常,壳聚糖是采用涂膜的方式对果蔬进行保鲜,可有效降低果蔬的腐烂和水分的散失。
2.7CaCl2对艾蒿精油抑菌效果的影响
由图6、图7可见,CaCl2单独使用时对供试菌均有抑制作用,但质量浓度增加,抑菌圈直径变化不显著;与艾蒿精油结合使用,对3种供试菌的抑菌圈直径明显增大,艾蒿精油对供试菌的抑菌效果随CaCl2质量浓度增加而增强。CaCl2是一种电解质,可破坏细菌细胞壁的主要成分肽聚糖,使细胞壁通透性增大,导致细菌变形、裂解而亡[5,15]。

图5 壳聚糖对供试菌的抑菌效果Fig.5Antibacterial activities of Chitosan against 3 tested microbes
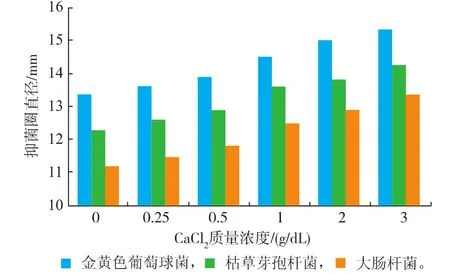
图6 CaCl2对艾蒿精油抑菌效果的影响Fig.6Effect of CaCl2on the antibacterial activities of essential oil from Artemisia argyi
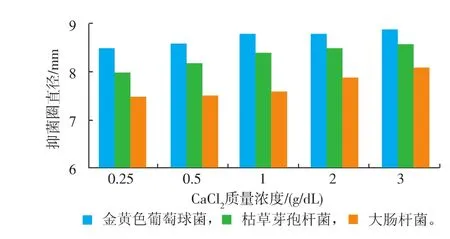
图7 CaCl2对供试菌的抑菌效果Fig.7Antibacterial activities of CaCl2against 3 tested microbes2.8NaCl对艾蒿精油抑菌效果的影响
不同质量浓度的NaCl溶液对艾蒿精油抑菌效果的影响结果见图8。

图8 NaCl对艾蒿精油抑菌效果的影响Fig.8Effect of NaCl on the antibacterial activities of essential oil from Artemisia argyi
NaCl单独使用时,对供试菌几乎没有抑菌效果,但与艾蒿精油结合使用时,可增加艾蒿精油的抑菌效果。与壳聚糖、CaCl2对艾蒿精油抑菌效果的影响相比,NaCl质量浓度增大,艾蒿精油对3种供试菌的抑菌圈直径变化相对不明显。可见,NaCl对艾蒿精油的抑菌效果的影响相对较小。一定质量浓度的NaCl可影响细菌细胞内外的离子梯度,改变细菌的代谢,最终导致菌体死亡[16]。研究表明,植物精油与NaCl结合使用应用于果蔬保鲜,过低的NaCl质量浓度不能增强植物精油的抑菌效果,但过高NaCl质量浓度可能会对果蔬产生毒害作用,从而降低果蔬本身对细菌、真菌的抵抗力,甚至对细菌或真菌可能会起到一定的保护作用[17]。
3 结语
艾蒿精油对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌均有一定的抑制作用,抑制活性大小排序为对金黄色葡萄球菌>对枯草芽孢杆菌>对大肠杆菌。艾蒿精油对革兰氏阳性菌的抑制活性强于对革兰氏阴性菌。精油体积分数仅为2.5滋L/mL时,即可完全抑制金黄色葡萄球菌的生长;精油体积分数为5滋L/mL可完全抑制枯草芽孢杆菌的生长;而大肠杆菌则相对不敏感,精油体积分数达到10滋L/mL时才可完全抑制。艾蒿精油具有良好的紫外稳定性。温度和pH对艾蒿精油的抑菌效果影响较大,温度低于40℃时抑菌活性较好,高于40℃抑菌活性逐渐下降;酸性条件下可增强其抑菌活性。壳聚糖、CaCl2、NaCl均可增加艾蒿精油的抑菌效果,但壳聚糖、CaCl2对艾蒿精油抑菌效果的影响大于NaCl。本研究结果对艾蒿精油的开发利用有一定的参考价值和理论意义。
[1]李亚茹,周林燕,李淑荣.植物精油对果蔬中微生物的抑菌效果及作用机理研究进展[J].食品科学,2013,35(11):325.
LI Yaru,ZHOU Linyan,LI Shurong.Antibacterial activity and the mechanism of plant essential oils and their main components in fruits and vegetables—A review[J].Food Science,2013,35(11):325.(in Chinese)
[2]周晓薇,王静,顾镍,等.植物精油对果蔬防腐保鲜作用研究进展[J].食品科学,2010(21):427-430.
ZHOU Xiaowei,WANG Jing,GU Nie,et al.Research progress in preservative effect of plant essential oil on fruits and vegetables[J]. Food Science,2010(21):427-430.(in Chinese)
[3]Burt S.Essential oils:Their antibacterial properties and potential applications in foods—a review[J].International Journal of Food Microbiology,2004,94(3):223-253.
[4]DIAO Wenrui,HU Qingping,ZHANG Hong,et al.Chemical composition,antibacterial activity and mechanism of action of essential oil from seeds of fennel(Foeniculum vulgare Mill.)[J].Food Control,2014,35:109-116.
[5]Mohammad J,Farideh T Y,Seyed A M,et al.Quince seed mucilage films incorporated with oregano essential oil:Physical,thermal,barrier,antioxidant and antibacterial properties[J].Food Hydrocolloids,2014,36:9-19.
[6]胡林峰,崔乘幸,吴玉博,等.艾蒿化学成分及其生物活性研究进展[J].河南科技学院学报,2010,38(4):75-78.
HU Linfeng,CUI Chengxing,WU Yubo,et al.Research advances on chemical constituents and bioactivities of Artemisia argyi[J].Journal of Henan Institute of Science and Technology,2010,38(4):75-78.(in Chinese)
[7]陈纯.艾蒿的抑菌作用及其在果蔬保鲜中的应用[D].福州:福建农林大学,2009.
[8]Wang W,Zhang X K,Wu N,et al.Antimicrobial activities of essential oil from Artemisiane argyi leaves[J]. Study on Frestry,2006,17(4):332-334.
[9]李娅男,吕飞,梁浩,等.4种植物精油体外抑菌活性及其稳定性的研究[J].北京化工大学学报:自然科学版,2012,39(3):81.
LI Yanan,LV Fei,LIANG Hao,et al.Study on antimicrobial activities and stability of 4 plant essential oils[J].Journal of Beijing University of Chemical Technology:Natural Science,2012,39(3):81.(in Chinese)
[10]Oussalah M,Caillet S,Saucier L,et al.Antimicrobial effects of selected plant essential oils on the growth of a Pseudomonas putida strain isolated from meat[J].Meat Science,2006,73:236-224.
[11]刘玉民,刘亚敏,李鹏霞.枫香叶精油抑菌活性及抗氧化活性研究[J].食品科学,2009,30(11):134-137.
LIU Yumin,LIU Yamin,LI Pengxia.Study on antimicrobial activities of essential oil from leaves of Liquidambar formosana Hance as well as its antioxidant activity[J].Food Science,2009,30(11):134-137.(in Chinese)
[12]Hazzit M,Baaliouamer A,Faleiro M L,et al.Composition of the essential oils of Thymus and Origanum species from algeria and their antioxidant activities[J]. Journal of Agricultrual and Food Chemistry,2006,54:6314-6321.
[13]卢靖,张丽珠,王秀萍,等.甘松精油抑菌活性及抗氧化活性研究[J].食品工业,2014,35(4):91-93.
LU Jing,ZHANG Lizhu,WANG Xiuping,et al.Study on antimicrobial and antioxidant activities of the essential oil of Nardostachys chinensia[J].Food Industry,2014,35(4):91-93.(in Chinese)
[14]Cox S D,Mann C M,Markham J L.Interactions between components of the essential oil of Melaleuca alternifolia[J].Journal of Applied Microbiology,2001,91(3):492-497.
[15]赵淑艳,呼世斌,吴焕利,等.山茱萸提取物抑菌活性成分稳定性的研究[J].食品科学,2008,29(1):98-101.
ZHAO Shuyan,HU Shibin,WU huanli,et al.Study on stability of bacteriostatic active compositions extracted from Fructus corni[J]. Food Science,2008,29(1):98-101.(in Chinese)
[16]Jallali I,Zaouali Y,Missaoui I,et al.Variability of antioxidant and antibacterial effects of essential oils and acetonic extracts of two edible halophytes:Crithmum maritimum L.and Inula crithmoïdes L.[J].Food Chemistry,2014,145:1031-1038.
[17]冯武.植物精油对果蔬采后病害的防治及其防治机理研究[D].杭州:浙江大学生物系统工程与食品科学学院,2006.
Study on Antimicrobial Activities and Stability of Essential Oil from Artemisia argyi
DUANWeili1,LIUYanqiu1,BAOYihong1,2
(1.College of Forestry,Northeast Forestry University,Harbin 150040,China;2.Collaborative Innovation Center for Development and Utilization of Forest Resources,Harbin 150040,China)
The filter Paper disk disffusion and spread-plate assay were used to determine the antimicrobial activity and minimum inhibitory concentration(MIC)of essential oil from Artemisia argyi.The effect of antimicrobial activity on stability of acid,base,heat and ultraviolet ray were studied.Results showed that the antimicrobial activitity of the essential oil from Artemisia argyi against three tested microbes were largely different.The essential oil showed strong antimicrobial effect against the Gram positive bacteria while weak effect against Gram negative bacteria.The MICs of the essential oil against Staphylococcus aureus,Bacillus subtilis,Escherichia coli were 2.5,5,10滋L/mL,respectively.The antimicrobial activities of the essential oil were stable under the ultraviolet ray,but were unstable under different temperatures and pH values.The acitivity was much better when the temperure below 40℃,and strong in acid and weak in base solution.Chitosan,CaCl2,NaCl can increase the antimicrobial activity,while Chitosan and CaCl2showed higher effect as compared to NaCl.
essential oil from Artemisia argyi,antimicrobial activity,stability
TS 201.3
A
1673—1689(2015)12—1332—06
2014-10-23
哈尔滨市科技厅留学归国基N018)。
包怡红(1970—),女,黑龙博士研究生导师,主要从事植物活性成分生物转化和功能性食品的开发研究。E-mail:baoyihong@163.com

