肌氨酸氧化酶的酶学性质及失活机理
仝艳军,辛瑜,杨海麟,冯守帅,张玲,王武*
(1.江南大学教育部工业微生物技术重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122)
肌氨酸氧化酶的酶学性质及失活机理
仝艳军1,2,辛瑜1,2,杨海麟1,2,冯守帅1,2,张玲1,2,王武*1,2
(1.江南大学教育部工业微生物技术重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122)
将来源于Bacillus sp.的肌氨酸氧化酶(SOX)基因在E.coli成功表达,并探索了肌氨酸氧化酶(sarcosine oxidase)酶学性质和失活机理。Bacillus sp.的肌氨酸氧化酶基因克隆入载体pET28a,并转化至E.coli BL21(DE3)表达。经IPTG诱导8 h,对菌体破壁液进行SDS-PAGE电泳分析,发现在43 kDa处有明显蛋白质条带。采用亲和介质分离纯化获得较高纯度SOX。SOX酶学性质分析结果表明,其相对分子质量为43.8 kDa,最适反应温度40℃,最适反应pH值为8.0;20 mmol/L的Mn2+对SOX具有明显激活作用;其动力学参数分析表明,肌氨酸作为底物时的Km值为141.6 mmol/L,Vmax为0.115 mmol/(L·min)。结合SDS-PAGE凝胶电泳、荧光光谱和圆二色性光谱分析,探明了液态SOX的失活机理。在37℃恒温条件下,随储存时间延长,SOX酶分子内部疏水基团逐渐暴露且二级结构被破坏,导致酶分子变性以及最终酶活力下降。为进一步提高SOX的酶活稳定性提供了理论依据。
肌氨酸氧化酶;酶学性质;失活机理
肌氨酸氧化酶(sarcosine oxidase;SOX;EC 1.5.3.1)属于黄素蛋白质,可偶联肌酐酶和肌酸酶将肌酐降解为甘氨酸、甲醛和过氧化氢[1]。作为一种重要的诊断酶制剂,SOX被广泛应用于人体血清中肌酐水平的检测,用来判断肾功能的健康程度[2]。
肌酐检测已成为医疗机构常规的检测项目,SOX临床需要量较大。目前,采用基因工程实现SOX的异源高效表达是满足其临床诊断应用的有效手段。E.coli作为常用的表达宿主菌,具有发酵成本低、产量高、易于操作、遗传背景清楚、繁殖周期短和易于调控等诸多优点,被普遍认为是重组蛋白质生产的首选体系[3-5]。尤其,由于不同生物来源的SOX酶学性质差异较大,会直接影响其应用效果,如相对分子质量及亚基组成和蛋白质组成等[6-9]。因此,深入探索SOX酶学性质变得非常重要。此外,诊断酶试剂的稳定性普遍较差也是限制该类酶制剂实际应用的重要因素[10-12]。而翔实的酶分子失活机理研究是有效提高酶稳定性的基本前提。
研究中将Bacillus sp.BSD-8来源的SOX在E. coli中进行异源重组表达,采用亲和层析获得纯度较高的目的蛋白质。在此基础上,作者对SOX的酶学性质进行研究,并采用SDS-PAGE凝胶电泳、荧光光谱和圆二色性光谱等方法探讨SOX的失活机理,为该SOX的稳定性研究奠定了理论基础。
1 材料与方法
1.1菌株与质粒
克隆宿主菌E.coli JM109,表达宿主菌E.coli BL21(DE3)和重组菌E.coli JM109/pUC57-sox,由作者所在实验室保藏;质粒pET28a,购自Novagen公司。
1.2主要材料
限制性内切酶EcoRⅠ,Hind III,T4 DNA连接酶,Taq DNA聚合酶,250 bp DNA分子量标准品,蛋白质分子量标准品,均购自TaKaRa公司(大连);胶回收试剂盒,质粒提取试剂盒,IPTG,卡那霉素,均购自上海生物工程有限公司;其他试剂均为国产或进口分析纯试剂。
1.3主要仪器
电热恒温水浴锅,上海医疗器械五厂制造;F-7000型荧光分光光度仪,日立公司制造;蛋白质电泳仪,美国BIO-RAD公司制造;MOS-450 AF圆二色性光谱仪,法国Bio-Logic公司制造;pHS-3TC型pH计,德国赛多利斯股份有限公司制造。
1.4肌氨酸氧化酶基因工程菌的构建
重组质粒的构建策略如图1所示。将含有pET28a载体的重组菌和含有pUC57-sox的重组菌分别接种于含Kan的LB液体培养基中,37℃,200 r/min培养过夜,将得到的菌液用于质粒的提取。经PCR扩增纯化后的目的基因和pET28a质粒分别经EcoRⅠ和Hind III双酶切,产物经凝胶电泳后分别纯化回收。在16℃,T4 DNA连接酶的作用下连接。连接产物转化E.coli JM109感受态细胞,在含100 μg/mL Kan的LB平板上选取阳性转化子,提取重组质粒,进行双酶切电泳鉴定;并挑取阳性克隆送上海生物工程有限公司测序。将经过测序鉴定正确的重组质粒pET28a-sox转化表达宿主菌E.coli BL21(DE3)感受态细胞,并将转化产物涂布于含有Kan的LB固体培养基中,并挑取重组转化子单菌落接种于LB液体培养基中,培养后提取质粒进行鉴定。
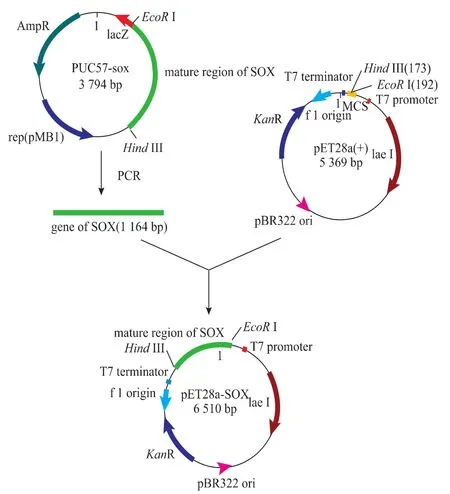
图1 重组表达载体pET28a-sox的构建流程Fig.1Construction of recombinant plasmids pET28a-sox
1.5重组质粒在E.coli中的诱导表达
挑取阳性E.coli重组转化子单菌落接种于50 mL含Kan的LB液体培养基,于37℃,200 r/min振荡过夜。按体积分数5%的接种量转接于50 mL含Kan的LB液体培养基中,于37℃200 r/min振荡至菌体浓度OD600约为0.6~0.8,加入IPTG达到终浓度为1 mmol/L进行诱导,继续培养8 h。8 000 r/min,4℃离心5 min收集菌体,用20 mmol/L pH 8.0的Tris-HCl缓冲液洗涤悬浮菌体,冰水浴超声破碎菌体,获得待测酶液。同时以不加IPTG诱导的重组菌和一个经IPTG诱导的非重组菌作为对照,进行SDS-PAGE凝胶电泳鉴定。
1.6肌氨酸氧化酶酶活测定
以肌氨酸为底物,参照文献方法测定[13],取50 μL不同浓度的SOX酶液,分别加入3 mL显色液于1 mmol/L的4-氨基安替比林、6 mmol/L的苯酚、7 000 U/L的辣根过氧化物酶、20 mmol/L的Tris-HCl缓冲液(pH 8.0)中,混匀后加入150 μL肌氨酸(0.2 mol/L),振荡混匀,于37℃水浴反应5 min,结束后沸水浴煮沸3 min终止反应,冷却,于500 nm下测定吸光度。酶活单位定义为:在37℃下,每分钟转化1 μmoL肌氨酸产生甲醛所需的酶量定义为1个酶活单位(U)。
1.7重组肌氨酸氧化酶的纯化及酶学性质
1.7.1肌氨酸氧化酶的纯化从固体平板挑取单菌落,接入种子培养基,37℃培养过夜。按照体积分数5%的接种量接入发酵培养基,37℃,200 r/min培养至OD6000.6~0.8后,采用1 mmol/L的IPTG诱导8 h。菌液破壁离心后,取酶上清液进行纯化,参照文献[14],纯化后的酶液置于4℃保存备用。
1.7.2酶的最适反应温度和最适pH值的测定在pH 8.0、20 mmol/L Tris-HCl缓冲液体系中,在20~80℃范围内测定不同温度下的酶活力,观察温度对酶活性的影响,以确定酶的最适反应温度;在不同pH的反应体系(pH 4.0~11.0)中测定SOX的酶活力,以酶活力最高的记为100%,计算其他pH条件下的相对酶活力,确定酶促反应的最适pH。不同pH的缓冲液体系为柠檬酸-柠檬酸钠缓冲液(pH 4.0~5.0),磷酸-磷酸钾缓冲液(pH 6.0~7.0),Tris-HCl缓冲液(pH 8.0~9.0),碳酸氢钠-NaOH缓冲液(pH 10.0~11.0)。
1.7.3酶的热稳定性和pH稳定性分析在pH 8.0、20 mmol/L Tris-HCl缓冲液体系中,0~80℃系列梯度范围内保温10 min,测定其对应的剩余酶活力,以观察酶的热稳定性。另外,将一定量的酶液分别置于一系列不同pH的缓冲液中,37℃放置2.5 h后,测定其对应的剩余酶活力,以观察酶的pH稳定性。不同pH的缓冲液体系同1.7.2。
1.7.4金属离子对酶活力影响的测定在不同反应体系中分别加入不同的金属离子Na+、K+、Ca2+、Mg2+、Mn2+、Fe3+、Co2+、Cu2+和Zn2+,设置3个终浓度梯度为2.0、20、100 mmol/L,分别混匀在37℃水浴中保温2.5 h,测定各组酶活力。以未加入金属离子的酶液的活性为100%,计算各组的相对酶活力,以观察金属离子对酶活性的影响。
1.7.5SOX酶动力学参数的测定用pH 8.0的Tris-HCl缓冲液配制浓度分别为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0 mmol/L的肌氨酸溶液,于37℃反应5 min的条件下测定SOX在不同肌氨酸浓度时的初始氧化活力。得到反应速度V和1/V。根据Lineweaver-Burk双倒数作图法,以1/[S]为横坐标,1/V为纵坐标作图,计算SOX对肌氨酸的Km和Vmax。
1.8肌氨酸氧化酶失活机理的分析方法
1.8.1SOX酶活力测定酶活力12 U/mL、pH 8.0的SOX酶液置于37℃恒温水浴中,定时取样测定其剩余酶活,设水浴前SOX酶液的酶活力为100%,计算37℃放置不同时间后的酶活保留率,重复3次取平均值。
1.8.2SDS-PAGE凝胶电泳分析酶活力12 U/ mL、pH 8.0的SOX酶液置于37℃恒温水浴中,定时取样进行SDS-PAGE凝胶电泳分析,水浴前SOX酶分子溶液样品作为对照,检测SOX酶分子在储存过程中是否存在聚集或降解现象。
1.8.3荧光光谱鉴定利用F-7000型荧光分光光度计对37℃储存不同时间的SOX酶溶液内源荧光及FAD荧光光谱进行分析。内源荧光实验条件为:激发波长280 nm,扫描范围280~400 nm,狭缝宽度5.0 nm,检测步长1 nm。FAD辅基荧光实验条件为:激发波长460 nm,扫描范围460~620 nm,狭缝宽度5.0 nm,检测步长1 nm。
1.8.4圆二色性光谱分析使用MOS-450AF圆二色性光谱仪对37℃储存不同时间的SOX酶液进行分析,扫描范围为200~250 nm,检测步长1 nm,响应时间2 s,狭缝宽度4.0 nm,比色皿宽度1 mm,以不含有SOX的相同缓冲液体系为背景,测定椭圆率(θ),计算摩尔椭圆率[θ]。
2 结果与分析
2.1重组质粒鉴定及目的产物诱导表达
2.1.1重组质粒的鉴定将全合成的sox基因成功构建在pUC57载体,以pUC57-sox为模板进行PCR扩增。扩增的目的条带和pET28a质粒经EcoR I和Hind III双酶切纯化后连接,构建重组质粒pET28a-sox。从转化子中提取重组质粒pET28asox,采用限制性内切酶EcoRⅠ和Hind III进行双酶切验证,同时重组质粒进行PCR扩增,结果如图2所示,泳道2为双酶切后的重组质粒,在1 000 bp和5 000 bp处出现两条特异性条带,分别对应sox和pET28a片段。该结果初步验证了重组质粒pET28a-sox已成功构建。
2.1.2目的产物的诱导表达及SDS-PAGE检测诱导表达后的菌体经超声破碎处理,获得粗酶液并进行SOX酶活的测定和SDS-PAGE分析。如图3所示。E.coli BL21(DE3)/pET28a-sox菌体经IPTG诱导后,其细胞破壁液中发现相对分子质量约43 kDa蛋白质特异条带,表达量约占总细胞蛋白质的30%,SOX在E.coli中已成功表达。后续实验采用乳糖优化诱导表达,其产酶水平和生产强度可达4.0 U/mL和91.2 U/(L·h)。

图2 重组质粒pET28a-sox的双酶切与PCR验证Fig.2Identification of expression plasmid pET28a-sox by restriction digestion and PCR

图3 表达产物的SDS-PAGE分析Fig.3Analysis of SOX expression by SDS-PAGE
2.2重组肌氨酸氧化酶的酶学性质2.2.1重组肌氨酸氧化酶的纯化收集湿菌体后,采用20 mmol/L的Tris-HCl缓冲液(pH 8.0)清洗后离心,去除上清液后重新将菌体悬浮于20 mmol/L的Tris-HCl缓冲液(pH 8.0)中超声波破碎。破壁条件为4 min/1 min(超声时间/间歇时间),破壁时间为20 min,至溶液变澄清,即获得粗酶液。采用Sepharose-4-氨基吡咯-2-羧酸亲和层析纯化SOX;用20 mmol/L的Tris-HCl缓冲液(pH 8.0)平衡亲和层析柱,再将粗酶液进样层析柱,采用0.03 mol/L NaCl/20 mmol/L Tris-HCl缓冲液(pH 8.0)洗脱目的蛋白质,纯化经SDS-PAGE分析,如图4(a)所示,在相对分子质量43 kDa处有明显单一蛋白质条带。经Sephrose-4-氨基吡咯-2-羧酸亲和纯化,粗酶液中杂蛋白质基本除去,纯化的SOX达到电泳纯,比酶活为30.8U/mg,酶活回收率91.2%。采用MALDI-TOF对SOX相对分子质量进行鉴定,结果见图4(b),该重组蛋白质相对分子质量43.8 kDa,与来源Bacillus sp.B-0618的SOX(43 839 Da)相近[15];纯化后的样品置于4℃保存备用。

图4 纯化的肌氨酸氧化酶的SDS-PAGE图谱及质谱鉴定图谱Fig.4SDS-PAGE and mass spectrum analysis of purified SOX
2.2.2SOX最适反应温度和pH值温度和pH值是影响酶反应速率的重要因素,酶分子只在一定温度和pH范围内具有酶活性,对Bacillus sp.SOX的最适反应温度和最适pH值进行分析。由图5(a)可知,该SOX在20~80℃范围内均具有一定的酶活性,其最适反应温度为40℃。由图5(b)可知,在pH 8.0~11.0范围内,该重组酶具有较高的酶活力,在pH 8.0和pH 11.0的反应体系中可以获得相同的酶活。据文献报道[7,16],SOX在催化底物时,肌氨酸以兼性离子形式结合于SOX活性中心;而在脱甲基氧化过程中,肌氨酸则是以阴离子形式存在。底物的结合受到pKa 7.4和10.2两个离子化参数的影响。对于肌氨酸其α-氨基的解离常数pKa为10.01,在pH 8.0的体系中,肌氨酸以适宜浓度的兼性离子存在,促进酶与底物的结合;在pH 11.0的体系中,肌氨酸其α-氨基已去质子化状态,以较适浓度的阴离子形式存在,促进催化作用的进行。因此SOX在pH 8.0和pH 11.0的体系中呈现较高的酶活力。

图5 温度及pH对SOX酶活力的影响Fig.5Effect of temperature and pH on SOX activity
2.2.3SOX的热稳定性及pH稳定性酶液置于0~80℃不同水浴温度保温10 min,如图6(a)所示,SOX在50℃以下具有较好的热稳定性,剩余酶活可以保持在80%以上。将SOX在不同的pH体系下37℃放置2.5 h,如图6(b)所示,SOX在pH 7.0~10.0体系中具有较好的pH稳定性,37℃下放置2.5 h,其剩余酶活仍保持在80%以上。在50℃以下或者pH 7.0~10.0体系中,SOX均可以保持其正确的空间构象。

图6 SOX的热稳定性和pH稳定性分析Fig.6Analysis on thermal stability and pH stability of SOX
2.2.4金属离子对肌氨酸氧化酶活性的影响SOX
对不同金属离子的耐受性具有较大的差异,SOX在不同浓度(2.0、20、100 mmol/L)金属离子体系中放置2.5 h(37℃)后,结果如图7所示。不同浓度的Na+、K+及Ca2+对SOX酶活力基本没有影响;Mn2+和Mg2+对SOX酶活力具有不同程度的激活作用,并呈现不同的变化趋势;Mg2+对SOX酶活力的激活作用随着Mg2+浓度的增加而减小;而Mn2+的激活作用随着Mn2+浓度的增加先增加后减小,在20 mmol/L的体系下其相对酶活力达到最大为145.7%。Fe3+在低浓度下对酶活性基本没有影响,Zn2+和Cu2+对SOX酶活力均有较强的抑制作用,在Zn2+和Cu2+体系中,SOX均出现了聚沉现象。Co2+在低浓度体系中对酶活性基本没有影响,并在20 mmol/L的体系具有激活作用,其相对酶活力可以达到126.9%,然而在100 mmol/L的体系中则表现出较强的抑制作用并出现聚沉现象。某些金属离子在合适的浓度范围内,可能通过与酶表面的原子或基团发生相互作用而使SOX的构象发生一定的变化,使酶分子中的电子传递进行得更加流畅,因而表现为激活作用[17]。而某些金属离子如Zn2+和Cu2+表现为强烈的抑制作用,则可能是由于Zn2+和Cu2+可导致酶分子疏水基团的暴露,导致聚集的发生和酶蛋白质的失活。其作用和其他Ca2+、Mg2+和Mn2+等二价金属离子不同,可能与Zn2+和Cu2+特殊的化学性质有关[18]。
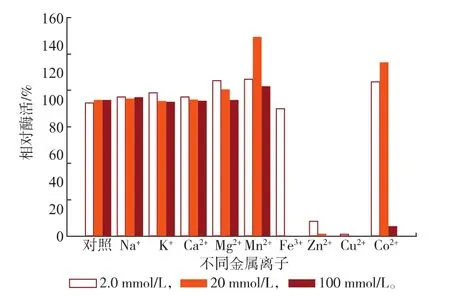
图7 不同金属离子对SOX酶活力的影响Fig.7Effect of various metal ions on the activity of SOX
2.2.5动力学参数的测定米式常数Km是酶的一个特征常数,可用于判断酶的专一性,Km值越小,说明酶与底物的亲和力越大,该底物越适宜作为该酶的天然底物。在pH 8.0条件下,SOX(10 U/mL)与1~10 mmol/L浓度梯度的肌氨酸于37℃反应5 min,测定SOX酶活力。根据Lineweaver-Burk双倒数作图法绘图,结果如图8所示,其米氏方程为

相关系数为0.994 7;计算得Bacillus sp SOX对肌氨酸的Km及Vmax值分别为141.6 mmol/L和0.115 mmol/(L·min)。来源不同的SOX对肌氨酸的Km值具有一定的差异性,如来源于Corynebacterium的SOX对肌氨酸的Km值为21 mmol/L[19]。
2.3肌氨酸氧化酶失活机理2.3.1SOX酶分子失活的表观现象造成酶分子不稳定的因素有很多,如氨基酸消旋、脱酰胺、氧化,温度和pH等。通过对SOX酶学性质研究发现,SOX在pH 8.0~10.0之间相对稳定,选择酶活力12 U/mL,pH 8.0,37℃的条件下观察酶失活现象。如图9(a)所示,随着储存时间的延长,酶活保留率逐渐降低;在前3 d内,酶活保留率下降速度缓慢,约下降了18%,而后的4 d内酶活保留率下降较为明显,到7 d时下降至7.9%。SOX在储存过程中,随着储存时间的延长出现沉淀;经同步SDS-PAGE凝胶电泳分析(见图9(b)),在SOX失活过程中,表现为目的条带逐渐变细,并出现蛋白质聚集现象。
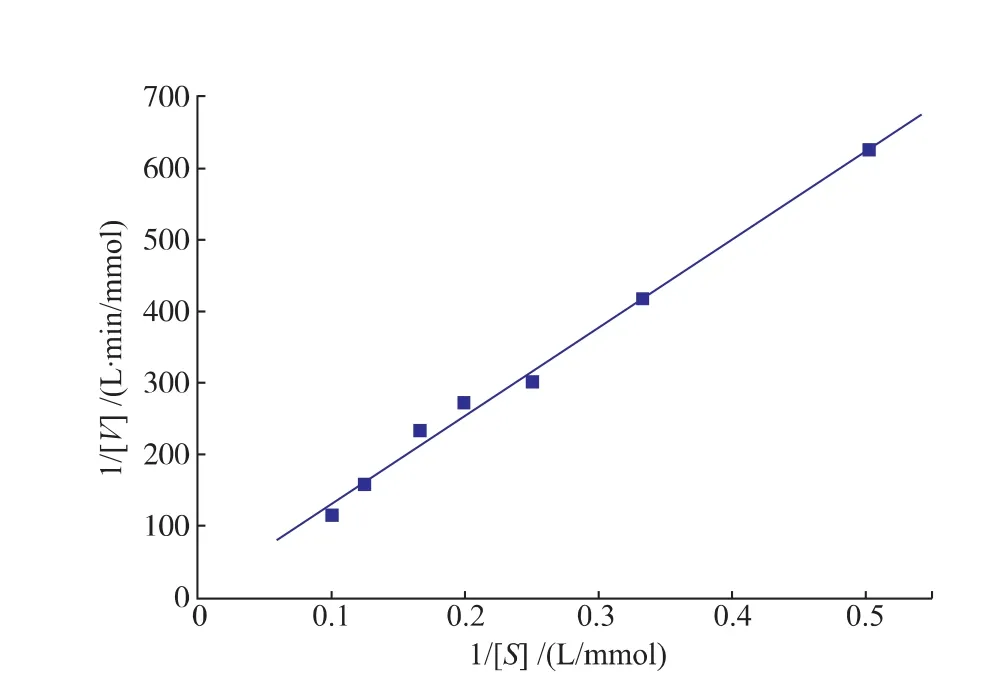
图8 SOX的Lineweaver-Burk双倒数图Fig.8Lineweaver-Burk graph of recombinant SOX

图9 SOX的储存稳定性曲线及SDS-PAGE凝胶电泳分析Fig.9The weakening of SOX enzymatic stability and protein banding at different storage period
2.3.2疏水基团暴露性分析通过内源荧光光谱法测定酶分子内部发色基团的变化,表征其结构的变化。酶分子中能发生荧光的氨基酸残基有Trp、Tyr和Phe残基,由于能量的转移和传递,酶分子的荧光主要表现为Trp和Tyr残基。SOX由387个氨基酸残基组成,其中含有3个Trp和21个Tyr残基;FAD作为SOX的辅基,含有异咯嗪环,有长共轭结构的π—π*跃迁,具有荧光性[20]。在酶分子结构解折叠时,内源性的疏水性残基(Trp和Tyr)逐步暴露出来,导致Trp和Tyr残基周围的微环境的极性逐渐增强,酶分子的最大发射波长发生移动(荧光光谱红移);另外,伴随疏水基团的暴露,荧光强度逐渐上升。如图10所示,随着储存时间的延长,SOX的最大发射波长由328 nm移向338 nm,荧光光谱发生红移,最大荧光强度也逐渐增加,并在储存3 d时趋于稳定。
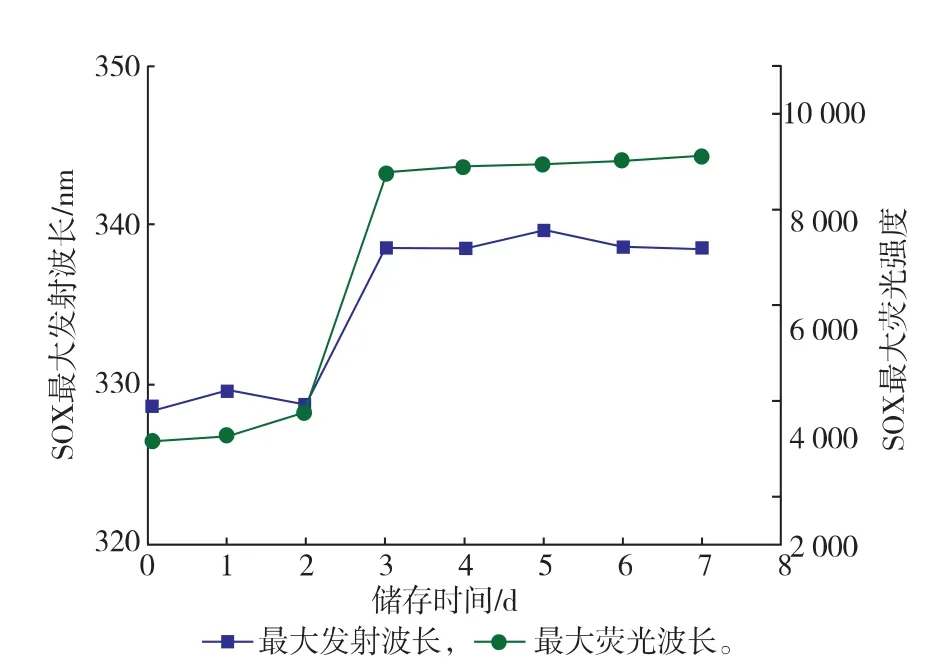
图10 储存不同时间的SOX的荧光光谱图分析Fig.10Analysis of flurorescence on SOX under different storage period
SOX酶分子在储存7 d之内,其内部结构基本暴露,二级结构基本丧失,FAD辅基基本暴露;如图11所示,FAD的最大发射波长未发生偏移,最大荧光强度在储存3 d后略有增加,表示FAD逐渐暴露于溶液中。通常SOX与FAD结合摩尔比为1∶1,大肠杆菌不能为SOX提供充足的FAD,而且FAD自身不能进入细胞,只能通过将核黄素运输至胞内,并经浓缩和磷酸化作用转化为FAD辅基[21-22],推断SOX大量表达的过程中,由于FAD合成速度有限,SOX未能完全结合FAD辅基。综上所述,推断SOX在储存过程中,SOX疏水基团逐渐暴露在溶液中,随之酶活性逐渐降低,荧光强度增强;另外,大肠杆菌表达过程中未能提供足量的FAD,表达的SOX未能充分结合FAD辅基。

图11 储存不同时间的FAD的荧光光谱图分析Fig.11Analysis of flurorescence on FAD under different storage period
2.3.3二级构象的变化酶分子中光活性发色基团的不对称性及折叠结构的差异性会引起左右两圆偏振光具有不同的光吸收,表现为圆二色性,常用于溶液中蛋白质二级结构变化的研究。在蛋白质二级结构中,α-螺旋在208 nm和222 nm处有两个负的特征吸收峰,β-折叠在216 nm处有一负光谱带,β-转角在206 nm附近有一正吸收峰[23]。将置于37℃保温不同时间的SOX酶液进行圆二色性光谱分析,结果如图12所示,SOX初始时的二级结构特征吸收峰较为完整,但37℃恒温水浴放置7 d后,SOX酶分子的二级结构特征吸收峰完整性降低,天然构象破坏,酶分子活性降低,其剩余的相对酶活不足10%。

图12 不同储存时间下SOX酶分子的圆二色性光谱分析Fig.12Analysis of circular dichroism of SOX in far-UV region under different storage periods
3 结语
肌氨酸氧化酶在临床诊断具有重要的应用价值。研究采用基因工程技术,实现了Bacillus sp.肌氨酸氧化酶的异源高效表达。SOX酶学性质分析表明,Bacillus sp.肌氨酸氧化酶为单亚基的蛋白质,肽链相对分子质量为43.8 kDa,最适反应温度为40℃,最适反应pH为8.0;SOX的动力学参数分析表明,在以肌氨酸为底物时,Km值为141.6 mmol/L,Vmax为0.115 mmol/(L·min)。结合SDS-PAGE凝胶电泳、荧光光谱和圆二色性光谱等方法,研究了液态SOX的失活机理。来源于Bacillus sp.的SOX酶液于37℃恒温放置过程中,SOX酶分子内部疏水基团逐渐暴露,同时二级结构逐渐破坏,SOX酶分子变性,导致酶活力下降。SOX失活机理的探明,为后续提高SOX的稳定性奠定了理论基础。
[1]Suzuki M.Purification and some properties of sarcosine oxidase from Corynebacterium sp.U-96[J]. Journal of Biochemistry,1981,89(2):599-607.
[2]Nagata K,Sasaki H,Hua M,et al.Crystal structure of monomeric sarcosine oxidase from Bacillus sp.NS-129 reveals multiple conformations at the active-site loop[J].Proceeding of the Japan Academy series B,2005,81(6):220-224.
[3]Sorensen H,Mortensen K.Advanced genetic strategies for recombinant protein expression in Escherichia coli[J].Journal of Biotechnology,2005.115(2):113-128.
[4]Choi J,Lee S.Secretory and extracellular production of recombinant proteins using Escherichia coli[J].Applied Microbiology and Biotechnology,2004,64(5):625-635.
[5]Andersen D,Krummen L.Recombinant protein expression for therapeutic applications[J]. Current Opinion in Biotechnology,2002,13(2):117-123.
[6]Guo K,Ma X,Sun G,et al.Expression and characterization of a thermostable sarcosine oxidase(SOX)from Bacillus sp.in Escherichia coli[J].Applied Microbiology and Biotechnology,2006,73(3):559-566.
[7]Wagner M,Trickey P,Chen Z,et al.Monomeric sarcosine oxidase:Flavin reactivity and activity site binding determinants[J].Biochemistry,2000,39(30):8813-8824.
[8]Lee S,Jia B,Pham B,et al.Architecture and characterization of sarcosine oxidase from Thermococcus kodakarensis KOD1[J]. Extremophiles,2012,16(1):87-93.
[9]Hassan-Abdallah A,Zhao G.Cloning,expression and crystallization of heterotetrameric sarcosine oxidase from Pseudomonas maltophilia[J].Protein Expression and Purification,2005,43(1):33-43.
[10]张玉然,辛瑜,杨海麟,等.黄嘌呤氧化酶酶学性质及共价交联固定化[J].食品与生物技术学报,2014,33(1):16-21.
ZHANG Yuran,XIN Yu,YANG Hailin,et al.Enzymatic properties of xanthine oxidase and its covalent immobilization on different supports[J]. Journal of Food Science and Biotechnolog,2014,33(1):16-21.(in Chinese)
[11]Tong Y,Xin Y,Yang H,et al.Efficient improvement on stability of sarcosine oxidase via poly-lysinemodification on enzyme surface[J].International Journal of Biological Macromolecules,2014,67:140-146.
[12]苏二正,夏涛,宛晓春,等.单宁酶和β-葡萄糖苷酶的共固定化[J].食品与生物技术学报,2006,25(1):40-44.
SU Erzheng,XIA Tao,WAN Xiaochun,et al.Study on the co-immobilization of tannase and β-glucosidase[J].Journal of Food Science and Biotechnolog,2006,25(1):40-44.(in Chinese)
[13]Inouye Y,Nishimura M,Matsuda Y,et al.Purification and characterization of sarcosine oxidase of Streptomyces origin[J]Chemical&Pharmaceutical Bulletin,1987,35(10):4194-4202.
[14]Tong Y,Xin Y,Yang H,et al.Novel affinity purification of monomeric sarcosine oxidase expressed in Escherichia coli[J]. Journal of Separation Science,2013,36(18):3086-3092.
[15]Wager M,Khanna P,Jorns M.Structure of the flavocoenzyme of two homologous amine oxidase:monomeric sarcosine oxidase and N-methyltryptophan oxidase[J].Biochemistry,1999,38(17):5588-5595.
[16]Zhao G,Jorns M.Ionization of zwitterionic amine substrates bounds to monomeric sarcosine oxidase[J].Biochemistry,2005,44(51):16866-16874.
[17]方华,陈俊,陈瞾,等.缓冲体系和金属离子对漆酶催化活性的影响[J].武汉理工大学学报,2009,31(5):27-30.
FANG Hua,CHEN Jun,CHEN Zhao,et al.Effect of buffer solutions and metal ions on the laccase activity[J].Journal of WuHan University of Technology,2009,31(5):27-30.(in Chinese)
[18]刘陶陶,王希成.铜离子对海参精氨酸激酶活力与结构的影响[J].海洋科学,2011,35(1):17-21.
LIU Taotao,WANG Xicheng.Effects of Cu2+on Arginine kinase:activity changes,conformational changes,and aggregation[J]. Marine Sciences,2011,35(1):17-21.(in Chinese)
[19]Hayashi S,Suzuki M Nakamura.Steady-state kinetics and spectral properties of Corynebacterium sarcosine oxidase[J].Biochimia et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,1983,742(3):630-636.
[20]Brown M,Royer C.Fluorescence spectroscopy as a tool to investigate protein interactions[J].Current Opinion in Biotechnology,1997,8(1):45-49.
[21]陈亦,辛瑜,杨海麟,等.保护剂对胆固醇氧化酶稳定性机理的研究[J].食品与生物技术学报,2013,32(6):661-666.
CHEN Yi,XIN Yu,YANG Hailin,et al.Study on the effect of protective additives on stability mechanism of cholesterol oxidase[J].Journal of Food Science and Biotechnolog,2013,32(6):661-666.(in Chinese)
[22]郝淑美,王宣军,张秀霞.用乳糖作为诱导剂进行重组蛋白的表达[J].中国生物制品学杂志,2005,18(5):409-411.
HAO Shumei,WANG Xuanjun,ZHANG Xiuxia.Expression of recombinant gene in E.coli using lactose as inducer[J]. Chinese Journal of Biologicals,2005,18(5):409-412.(in Chinese)
[23]沈琼,黄滨,邵嘉亮,等.运用圆二色谱研究酶与化合物相互作用的机理[J].中山大学学报,2006,45(4):62-64.
SHEN Qiong,HUANG Bin,SHAO Jialiang,et al.Mechanism discussion of interaction between enzyme and several compounds with circular dichroism method[J].Journal of Zhongshan University,2006,45(4):62-64.(in Chinese)
On the Enzymatic Properties and Deactivation Mechanism of Sarcosine Oxidase
TONGYanjun,XINYu,YANGHailin,FENGShoushuai,ZHANGLing,WANGWu*
(1.Key Laboratory of Industrial Biotechnology of Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
The sarcosine oxidase(SOX)gene from Bacillus sp.was expressed in E.coli,and the properties and deactivation mechanism were further analyzed.After transformation of the cloned DNA into host E.coli BL21(DE3),the SOX gene was induced by IPTG for 8 h,a protein band of 43 kDa appeared in SDS-PAGE electrophoresis.From the crude enzyme solution,SOX in high purity was obtained through affinitive separation and purification.The analytic results of enzymatic properties showed that its relative molecular mass was 43.8 kDa,and its optimum reactiontemperature and pH value were 40℃and 8.0,respectively.Moreover,20 mmol/L Mn2+exhibited an obvious activation effects on recombinant SOX.The kinetic parameters of Km and Vmax were determined as 141.6 mmol/L and 0.115 mmol/(L·min)when sarcosine used as a substrate.With the SDS-PAGE gel electrophoresis,fluorescence and circular dichroism spectroscopy,the deactivation mechanism of SOX was further studied.At constant temperature 37℃,the internal hydrophobic group of SOX molecule was gradually exposed and its secondary structure was destroyed along with the prolonged storage time,leading to the denaturation of SOX protein and the lowering down of its activity.The above results provide a theoretical basis for improving SOX stability in future.
sarcosine oxidase,enzymatic properties,deactivation mechanism
Q 783
A
1673—1689(2015)12—1239—09
2014-10-29
国家自然科学基金项目(21306064);江苏省创新计划项目(CXZZ12_0752);江南大学博士研究生科学研究基金项目(JUDCF12013)。
仝艳军(1986—),女,山东荷泽人,工学博士,食品科学与工程博士后,主要从事耐热肌氨酸氧化酶基因表达、纯化及酶稳定性研究。E-mail:yanjun1986927@163.com
王武(1952—),女,福建福州人,教授,博士研究生导师,主要从事酶分子改造,遗传工程和发酵工程研究。
E-mail:bioprocessor@aliyun.com;wangwu@jiangnan.edu.cn

