大孔树脂纯化洋甘菊中总黄酮的工艺条件研究
陈丽春,梁祥辉,龚金炎,*
(1.浙江科技学院浙江省农产品化学与生物加工技术重点实验室,浙江杭州310023;2.浙江工商大学食品感官科学实验室,浙江杭州310035)
大孔树脂纯化洋甘菊中总黄酮的工艺条件研究
陈丽春1,2,梁祥辉1,龚金炎1,*
(1.浙江科技学院浙江省农产品化学与生物加工技术重点实验室,浙江杭州310023;2.浙江工商大学食品感官科学实验室,浙江杭州310035)
对大孔树脂纯化洋甘菊中总黄酮工艺条件进行优化研究。建立紫外-可见分光光度法测定洋甘菊中总黄酮方法;以吸附率、解吸率为评价指标,考察树脂类型、上样浓度、上样体积、洗脱浓度、洗脱体积对纯化工艺的影响。通过绘制静态吸附平衡曲线、泄露曲线和动态解吸曲线,综合评判确定最优工艺。结果表明:AB-8树脂对洋甘菊中总黄酮纯化效果较好,当上样质量浓度为1.8 mg/mL,上样体积流量为1 BV/h;洗脱剂用70%乙醇,体积流量为1.0 BV/h对洋甘菊中总黄酮的吸附率为62.5%、解吸率68%、回收率61%。经AB-8大孔树脂纯化洋甘菊中总黄酮提高25.3%,此方法稳定可靠,可用于洋甘菊总黄酮的工业纯化要求。
洋甘菊;大孔树脂;总黄酮;分离纯化
洋甘菊(Matricaria chamomilla L)又名母菊,木兰纲菊科母菊属草本,一年生或两年生草本植物。原产欧洲,为一种重要的药用和香料植物。黄酮类化合物(Favonoids)是一类广泛存在于植物茎叶和植物果实的次级代谢产物,主要以苷元形式存在。洋甘菊所含黄酮类成分主要有芹菜苷、芦丁、木犀草素、槲皮素等,现代药理研究表明洋甘菊中的黄酮类成分具有抗菌、抗氧化、消炎效果,具有较强的清除自由基的能力,可预防体内形成过多活性氧自由基,达到抗癌、抗心血管病的目的[1]。洋甘菊含挥发油、黄酮类、愈创奠内酯、香豆素类等成分,具有独特的香气,在欧洲、美国及日本等国家被广泛用于食品、饮料、烟草、化妆品等领域,是一种很有开发潜力的经济植物,不少国家加以大面积机械化生产[2]。沙红等[3]曾对洋甘菊的组织培养进行过研究。杨彦松等[4]对新疆洋甘菊头状花序中的黄酮类化学成分进行了研究,从其95%乙醇提取物中分离得到2个黄酮类化合物,通过波谱方法分别鉴定为芹菜素-7-O-β-D-葡萄糖苷(I)和木犀草素-7-O-β-D-葡萄糖苷(Ⅱ)。作为一种引进植物,洋甘菊在我国尚未得到充分的开发及利用。本研究运用现代分离技术对洋甘菊中提取的黄酮类化合物进行分离提纯研究,确定大孔树脂分离纯化洋甘菊中黄酮类物质的可行性与最优工艺,以为工业化分离提纯洋甘菊中黄酮类物质提供理论参考。
1材料与方法
1.1原料与试剂
罗马洋甘菊:新疆种植,购于杭州,于40℃真空干燥,密封保存。
芦丁标准对照品:上海医药化学试剂公司;AB-8、D-101、DM-130、HP-20、XDA-1型大孔吸附树脂:广州绿百草生物科技有限公司;其余试剂均为国产分析纯;水为超纯水。
1.2仪器与设备
UV-5500紫外分光光度计:上海元析仪器有限公司;Direct-QR3 MILLIPOR E(France)超纯水;HL-2S恒流泵:上海泸西分析仪器厂;TS-1102双层大容量恒温培养振荡器:上海旦鼎国际贸易有限公司;旋转蒸发仪R E-2000:上海亚荣生化仪器厂;KQ-50E型超声波清洗器:昆山市超声仪器有限公司;HH-6数显恒温水浴锅:常州澳华仪器有限公司;电子天平:北京丹佛仪器有限公司;GZX-9076MBE电热鼓风干燥箱:上海博讯实业有限公司。
1.3方法
1.3.1对照品溶液的制备
精密称取芦丁对照品适量,用甲醇溶解,稀释并定容成0.1 mg/mL对照品溶液,备用。
1.3.2标准曲线的绘制
精密吸取芦丁对照品溶液0、0.5、1.0、2.0、3.0、4.0、5.0 mL分别置7个25 mL量瓶中,加入0.1 mol/L AlCl3溶液2.0 mL,用甲醇稀释至刻度,摇匀,放置20 min。以试验溶剂为空白,在420 nm处测定吸光度(A),A值(Y)对芦丁质量浓度(X)进行线性回归,得线性回归方程y=0.121 7x-0.008 9,R2=0.999 6。结果表明总黄酮在0.004mg/mL~0.02mg/mL线性关系良好,可用于实验。
1.3.3洋甘菊供试品的制备
准确称取洋甘菊干粉(过40目)适量,按料液比为1∶24,加入70%乙醇,在70℃回流浸提2.5 h,抽滤得洋甘菊提取液,浓缩,经真空冷冻得洋甘菊样品,按“1.3.2项标准曲线制备”测定其总黄酮含量,备用。
1.3.4大孔树脂静态预处理
将已经水合的树脂装入柱中,树脂床高度约为柱的2/3,待树脂沉降后先进行反洗,将加入95%乙醇,使有机溶剂液面高于树脂床面,浸泡2 h~6 h。再用去离子水淋洗树脂床,洗去有机溶剂,通过2%~4%的盐酸溶液,用量约为3倍~5倍树脂体积,并用去离子水淋洗至中性。再通过4倍~5倍树脂体积的4%的NaOH溶液,水洗至中性待用。
1.3.5测定方法
吸取经静态和动态吸附后的溶液1.00 mL溶液置于10 mL容量瓶中,加入1%AlCl32.00 mL,加甲醇定容至刻度,按“1.3.2项标准曲线制备”测定其吸光度,分别按照下列公式计算树脂吸附量(Q)、吸附率、解吸率。

式中:A为总黄酮吸附量,mg/mL;B为初始的黄酮量,mg;B1为未被吸附的黄酮量,mg;V为溶液总体积,mL;Q1为吸附率,%;Q2为解吸率,%;B2为乙醇解吸液中的黄铜总量,mg。
1.4洋甘菊总黄酮大孔树脂的分离纯化工艺参数的确定
1.4.1大孔树脂的筛选
精确称取抽滤至干的D-101、AB-8、DM-130、HP-20、XDA-1树脂各5 g置于具塞锥形瓶中,分别加入已知浓度的洋甘菊溶液40 mL,置于恒温摇床,温度25℃,120 r/min的速率振荡吸附12 h后,取瓶中溶液,按“1.3.5测定方法”测定溶液的吸光度并计算总黄酮含量,分别计算树脂吸附量及吸附率。
取上述吸附后的树脂,吸滤后,用适量的水冲洗,分别加入70%乙醇50 mL,置于恒温摇床中进行解吸,测定解吸液中总黄酮的量。
1.4.2静态吸附平衡曲线的测定
精确称取抽滤至干AB-8树脂5 g,置于具塞锥形瓶中,加入浓度为2.00mg/mL的洋甘菊供试溶液40mL,置于温度25℃,速率120 r/min的恒温摇床振荡,分别于0.5、1、2、3、4、6、8、10、12、24、28 h取样,测定树脂对总黄酮的吸附率,以吸附率对时间作图,绘制AB-8树脂对总黄酮的静态吸附平衡曲线。
1.4.3上样浓度的考察
用已处理好的AB-8树脂装柱,精密量取供试品,配制质量浓度为0.5、1.0、1.5、2.0、2.5 mg/mL的洋甘菊供试品溶液,上样体积流量为1 BV/h,分别收集过柱流出液,按“1.3.2测定方法”测定吸光度,计算吸附率。
1.4.4洗脱剂浓度的考察
取已处理过的AB-8树脂(径高比1∶25)分别装9支,配制1.80mg/mL洋甘菊上样溶液,以流速1 BV/h上样,待AB-8树脂柱吸附饱和后,分别用乙醇体积分数为0、20%、30%、40%、50%、60%、70%、80%、90%乙醇洗脱,洗脱流速为1 BV/h,收集流脱液,按“1.3.2测定方法”测定吸光度,计算洗脱液中总黄酮含量,并计算解吸率。
1.4.5洋甘菊中总黄酮在AB-8上的泄露曲线
用处理好AB-8树脂装柱(径高比1∶25),配制1.80 mg/mL洋甘菊上样溶液,按体积流量1 BV/h上样。收集分段流出液,按“1.3.2测定方法”测定其吸光度,并计算总黄酮含量,当树脂达到吸附饱和时,记录上样量,以流出液中总黄酮质量浓度对上样体积作图,绘制泄露曲线。
2结果与讨论
2.1大孔树脂的筛选
大孔树脂的筛选结果见图1。

图1 五种大孔树脂的吸附与解吸曲线Fig.1Influence of five resins on absorptionand desorption rates of total flavonoids
在D-101、AB-8、DM-130、HP-20、XDA-1 5种树脂中AB-8树脂的吸附量和解吸量都是最高,其次是D-101树脂,效果相对较差的是XDA-1,结果见图1。
2.2静态吸附平衡曲线的确定
AB-8树脂对洋甘菊溶液静态吸附过程,通过测定AB-8树脂对洋甘菊总黄酮的吸附情况,绘制AB-8树脂对总黄酮的静态吸附平衡曲线。结果见图2。

图2 AB-8树脂静态吸附平衡曲线的测定Fig.2AB-8 Macroporous resin Static Adsorption Curve
从曲线中可以看出,在开始吸附中,AB-8树脂对洋甘菊中总黄酮的吸附率较高,当吸附6 h后达到最高吸附率;吸附10 h后树脂对总黄酮吸附率基本不再变化,基本达到吸附平衡。
2.3上样浓度树脂吸附的影响
洋甘菊供试品上样浓度对AB-8树脂对总黄酮的吸附效果的影响,结果见图3。

图3 不同上样浓度对AB-8树脂吸附总黄酮的影响Fig.3Influence of AB-8 resin on adsorption rate at different sample concentrations of total flavonoids
由图可见洋甘菊上样浓度为1.5 mg/mL~1.8 mg/mL达到最佳吸附条件,当上样浓度过高或过低并不利于AB-8树脂对洋甘菊中总黄酮的吸附。
2.4洗脱剂浓度对树脂解吸率的影响
当采用不同浓度的乙醇溶液进行洗脱时,随着乙醇体积分数的增大,解吸率不断提高。结果见图4。

图4 洗脱剂浓度对解吸率的影响Fig.4Relationship between solvents and desorption rate of total flavanoids
从图中可以看出,当乙醇体积分数为70%时,解吸效果达到最佳,随后,乙醇的体积分数的增加对解吸率的影响并不明显。从经济角度出发,在工业上可以采用洗脱剂乙醇的体积分数为70%。
2.5洋甘菊总黄酮在AB-8上的泄露曲线
洋甘菊总黄酮在AB-8上的泄露曲线见图5。
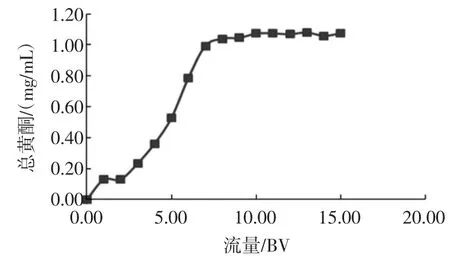
图5 AB-8大孔树脂的动态吸附曲线Fig.5Dynamic adsorption curve of AB-8 resin
AB-8树脂处理3倍以上树脂体积的上样溶液时即开始有部分总黄酮成分泄露,处理9倍树脂床体积后,流出液中总黄酮的质量浓度基本不再增加,表明AB-8型大孔吸附树脂对总黄酮的吸附量达到吸附平衡。
2.6验证试验
将已处理过的AB-8树脂装柱,以质量浓度为1.80 mg/mL洋甘菊供试品,上样流速为1 BV/h,上样吸附30 min后,测得上样体积。用水过柱洗脱至无色。以70%乙醇为洗脱液,流速为1 BV/h洗脱,测得洗脱剂用量。并收集乙醇洗脱液,测定其总黄酮的量。计算AB-8树脂对洋甘菊供试品的吸附率、解吸率、回收率。平行实验3次。结果显示:AB-8树脂对洋甘菊供试品的吸附率62.5%、解吸率68%、回收率61%;经AB-8大孔树脂纯化洋甘菊供试品中总黄酮提高25.3%。
3结论与讨论
应用大孔吸附树脂分离纯化洋甘菊中黄酮类化合物的有效成分,在食品工业及制药业等领域具有十分辽阔的前景。树脂的吸附能力由树脂孔径、比表面积、表面电性或形成氢键等综合性能决定,一般情况下,非极性吸附树脂适合从极性溶液吸附非极性物质,反之亦然。与其他纯化方法比较,在富集有效成分,减少杂质方面有其突出的优越性。洋甘菊提取液经AB-8大孔吸附树脂处理后,总黄酮收率在60%以上,洋甘菊供试品中总黄酮提高25.3%。的方法。本实验所建立洋甘菊总黄酮分离纯化工艺条件的优化条件,与其他纯化方法相比,具有较高的富集和纯化效率,利于洋甘菊总黄酮工业化生产应用。
[1]国家药典委员会.中国药典I部[M].北京:中国医药科技出版社,2010
[2]郑金臣,全山丛,张虹,等.值得重视的归化药用和香料植物——母菊(洋甘菊)[J].中草药,1996,7(9):568-571
[3]沙红,廖康.药用植物洋甘菊的组织培养研究[J].新疆农业大学学报,2004,27(4):16-18
[4]杨彦松,潘浪胜.洋甘菊中黄酮类成分的分离与结构确定[J].应用化工,2008,37(6):697-698
[5]姚新生.天然药物化学[M].北京:人民出版社,2001:178-179
[6]易海燕,何桂霞,欧阳文,等.大孔吸附树脂分离纯化藤茶总黄酮的研究[J].中草药,2011,42(1):74-77
[7]陈丛瑾.大孔吸附树脂分离纯化黄酮类化合物的研究进展[J].化学与生物工程,2010,27(11):1-4
[8]张静泽,颜艳.吸附树脂分离技术在中药研究中的应用[J].中国中药杂志,2004,29(7):628-630
[9]张蕾,韩坚,冯志强,等.大孔吸附树脂富集纯化广金钱草总黄酮的工艺研究[J].中草药,2011,42(12):2442-2446
[10]SUN Shao-fa,ZHOU Bo,HOU Han-na,et al.Studies on the interaction between ox aprozin-e and bovine serum albumin by spectroscopicmethods[J].InternationalJournalofBiologicalMacromolecules,2006,39(4):197-200
[11]Hudson E A,Dinh P A,Kokubun T,et al.Characterization of potentially chemopreventive phenols in extracts of brown rice that inhibit the growth of human breast and colon cancer cells[J].Cancer Epidemiol Biomarkers Prev,2000,9(11):1163-1170
[12]GUPTA S,A FAG F,MUKHTAR H.Involvement of nuclear factorkappa B,Bax and Bac l2 in induction of cell cycle arrest and apoptosis by apigenin in human prostate acrcinom acells[J].Oncogene,2002,21(23):372-378
[13]Jay D Amsterdam,MD,Yimei Li,et al.A review of the bioactivity and potential health benefits of chamomile tea[J].Journal of Clinical Psychopharmacology,2009,4(8):378-382
[14]Zhang JF,Yuan B,Leng P,et al Determination of 8 kinds of Polyphenols in pears,apples and bananas with the microwave extraction and high-performance liquid chromatography[J].J Anal Test,2008,27: 1371-1374
[15]Melstrom Lg,Salabat Mr,Ding Xz,et al.Apigenin inhibits the GLUT-1 glucose transporter and the phosphoinositide 3-kinase/Akt pathway in human pancreatic cancer cells[J].Pancreas,2008,37(4): 426-431
[16]GOLKAR L,SALABATMR,UJIKI MB,et al.Apigenin inhibits pancreatic cancer cell proliferation via down-regulation of hypoxia inducible factor-1A(HIF-1A)and the glucose transporter(GLUT-1)[J].J Surg Res,2007,137(2):191-192
[17]Nakajima Y,Yun Y S,Kunugi A.Six new flavonolignans from Sasa Veitchii(Carr.)Rehder[J].Tetrahedron,2003,59(40):8011-8015
[18]Chung I M,Hahn S J,Ahmad A.Confirmation of potential herbicidal agents in hulls of rice,Oryza sativa[J].J Chem Ecol,2005,31(6): 1339-1352
[19]Jiao J J,Zhang Y,Liu C M,et al.Separation and purification of tricin from an antioxidant product derived from bamboo leaves[J].J Agr Food Chem,2007,55(25):10086-10092
Enrichment and Purification Technology for Total Flavonoids from Chamomile by Macroporous Resin
CHEN Li-chun1,2,LIANG Xiang-hui1,GONG Jin-yan1,*
(1.Zhejiang Provincial Key Laboratory for Chemical&Bio Processing Technology of Farm Produces,Zhejiang University of Science and Technology,Hangzhou 310023,Zhejiang,China;2.College of Food and Biology Engineering,Sensory Science Laboratory,Zhejiang Gongshang University,Hangzhou 310035,Zhejiang,China)
The purification process of total flavonoids from chamomile on macroporous resins was studied in this research.An UV-vis spectrophotometry method to determine the content of total flavonoids in chamomile was established.The adsorption equilibrium capacities and desorption ratios were measured as the evaluation indexes,and the effects of the factors such as resin type,initial concentration,sample volume,elution concentration and elution volume were determined.Static adsorption isotherms,adsorption kinetic curves and adsorption breakthrough curves were measured and compared,and the optimal conditions of the purification process were obtained as follows:the AB-8 resin,initial concentration 1.8 mg/mL,adsorption flow rate 1 BV/h,desorption solvent 70%ethanol,desorption flow rate 1.0 BV/h.At those conditions,the adsorption capacity ratio of the total flavonoids from chamomile was 62.5%,the desorption ratio was 68%and the recovery ratio was 61%.The content of the total flavonoids from chamomile extract could be increased to 25.3%through the purification process on macroporous resin.This method was stable and reliable,could meet the purification requirements of the total flavonoids from chamomile for industrial production.
chamomilia;macroporous;flavonoids;purification
10.3969/j.issn.1005-6521.2015.17.029
2014-03-03
浙江省科技计划项目(2012C22026);重点实验室开放基金(2013KF0901)
陈丽春(1975—),女(汉),副教授,博士研究生,研究方向:天然产物研究与功能产品开发。

