睾丸扭转复位后生精功能损伤的分子机制研究
欧璎璎 吴远鹏 韦思明 杨淑娇
睾丸扭转复位后生精功能损伤的分子机制研究
欧璎璎吴远鹏韦思明★杨淑娇
目的 探讨睾丸扭转复位后过量产生的活性氧是否通过调控TATA结合蛋白相关因子2(TRF2)的表达导致生精功能损伤。方法 60只成年雄性SD大鼠分为3组,各20只。对照组左侧睾丸假手术。扭转复位组接受左侧睾丸扭转,1h后复位。清除活性氧组承受与扭转复位组相同的手术,但在复位时给予活性氧清除剂超氧化物歧化酶和过氧化氢酶静脉注射。复位后4h或3个月切除睾丸术,其标本测定丙二醛水平(活性氧标记),TRF2表达和生精功能。结果 单侧睾丸扭转复位明显增加同侧睾丸(即左侧扭转复位睾丸)丙二醛水平,降低TRF2表达和生精功能。相反,静脉注射活性氧清除剂超氧化物歧化酶和过氧化氢酶显著降低同侧睾丸的丙二醛水平,提高TRF2表达和生精功能。结论 睾丸扭转复位后,过量产生的活性氧通过下调TRF2表达导致生精功能损伤。
睾丸扭转复位 活性氧 TATA结合蛋白相关因子2 生精功能
睾丸扭转是指睾丸绕精索旋转,导致睾丸缺血。睾丸扭转复位是一个缺血再灌注过程。睾丸缺血再灌注导致生精功能损伤[1],而睾丸缺血再灌注损伤的分子机制仍然不明。TATA结合蛋白相关因子2(TRF2)调控生精细胞特异基因的转录,对精子发生必不可少[2]。本文探讨TRF2在睾丸缺血再灌注损伤中的作用。
1 材料与方法
1.1材料 250~300g成年雄性SD大鼠购自上海实验动物中心。超氧化物歧化酶、过氧化氢酶和β-肌动蛋白抗体(β-actin)购自Sigma公司。丙二醛试剂盒由南京建成生物工程研究所提供。TRF2抗体由Santa Cruz公司提供。
1.2方法 60只成年雄性SD大鼠被分为3组:对照组、扭转复位组和清除活性氧组,各20只。氯胺酮(50mg/ kg)腹腔麻醉后,在无菌条件下施行外科手术。通过左侧髂腹股沟切口显露左侧睾丸。对照组:将 11/0缝线穿过睾丸白膜,然后放睾丸入阴囊,关闭切口。扭转复位组:将左侧睾丸逆时针旋转720°,用11/0缝线固定睾丸至阴囊,保持睾丸扭转状态。1h后拆除缝线,将睾丸顺时针旋转720°复位。清除活性氧组:大鼠承受与扭转复位组相同的手术,但在复位时,从尾静脉注射活性氧清除剂超氧化物歧化酶和过氧化氢酶(5mg/kg)。复位后4h,每组一半的大鼠被处死,切除睾丸,其标本测定丙二醛水平。复位后3个月,处死剩余的大鼠,切除睾丸,测定睾丸TRF2表达和生精功能。
1.3丙二醛水平测定 用硫代巴比妥酸法测量睾丸的丙二醛水平,操作按试剂盒说明书进行。
1.4TRF2蛋白表达测定 用Western blot法测量睾丸的TRF2蛋白表达水平。TRF2与内参照β-actin的条带密度比值表示TRF2蛋白表达水平。
1.5睾丸生精功能评估 睾丸切下后称重,然后做成石蜡切片、苏木素-伊红染色,在显微镜下观察睾丸组织结构。通过测量睾丸重量、曲细精管直径、生精细胞层数及Johnsen评分来评定睾丸生精功能。
1.6统计学方法 采用GraphPad Prism 4.0软件。计量资料以(x±s)表示,组间比较用单因素方差分析和q检验,组内比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1睾丸丙二醛水平 与对照组比较,扭转复位组同侧睾丸(即左侧扭转复位睾丸)的丙二醛水平明显增加(P<0.05);与扭转复位组同侧睾丸比较,清除活性氧组同侧睾丸的丙二醛水平显著降低(P<0.05);3组对侧睾丸(即右侧睾丸)的丙二醛水平比较差异无统计学意义(P>0.05)。
2.2睾丸TRF2蛋白表达 与对照组比较,扭转复位组同侧睾丸的TRF2表达明显降低(P<0.05);与扭转复位组同侧睾丸比较,清除活性氧组同侧睾丸的TRF2表达显著升高(P<0.05);3组对侧睾丸的TRF2表达差异无统计学意义(P>0.05);见图1。
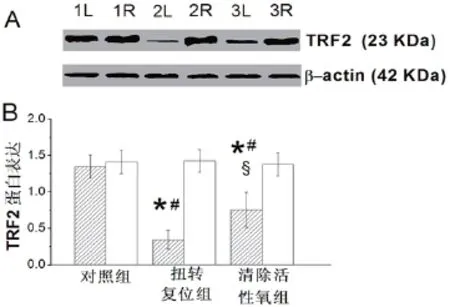
图1 三组睾丸的TRF2蛋白表达。(A)TRF2表达的代表性结果。β-actin作为内参照,1L和1R表示对照组左侧(即同侧)和右侧(即对侧)睾丸,2L和2R表示扭转复位组同侧和对侧睾丸,3L和3R表示清除活性氧组同侧和对侧睾丸。(B)TRF2表达的定量分析。有影线的长条表示同侧睾丸,空白长条表示对侧睾丸。与对照组相比★P<0.05;与同组对侧睾丸相比,#P<0.05;与扭转复位组同侧睾丸相比,§P<0.05。
2.3睾丸生精功能 与对照组比较,扭转复位组同侧睾丸的重量、曲细精管直径、生精细胞层数及Johnsen评分显著降低(P<0.05);与扭转复位组同侧睾丸比较,清除活性氧组同侧睾丸的上述4个指标明显升高(P<0.05);3组对侧睾丸的这些指标差异无统计学意义(P>0.05);见图2和3。
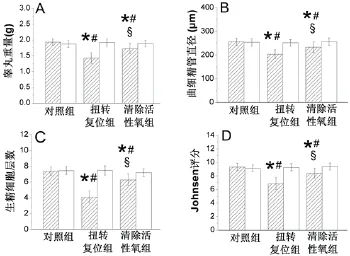
图2 三组睾丸的(A)重量,(B)曲细精管直径,(C)生精细胞层数和(D)Johnsen评分。影线长条表示同侧睾丸,空白长条表示对侧睾丸。与对照组比较,★P<0.05;与同组对侧睾丸比较,#P<0.05;与扭转复位组同侧睾丸比较,§P<0.05
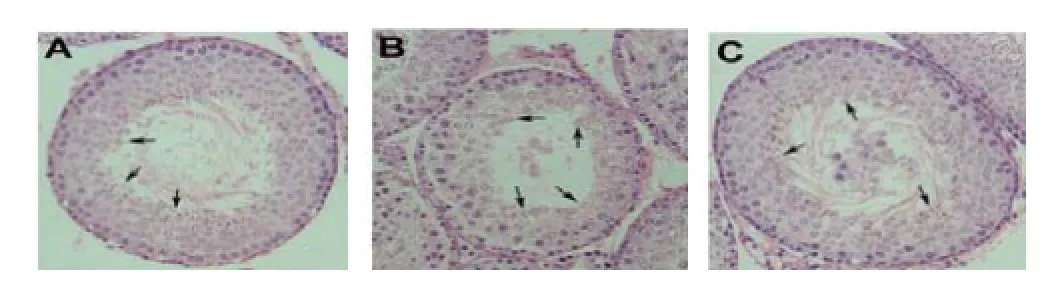
图3 三组睾丸的组织学所见。(A)对照组双侧睾丸,扭转复位组与清除活性氧组对侧睾丸均显示正常的曲细精管直径﹑生精细胞层数和生精细胞分化,可见较多成熟的精子(箭头所指处)。生精上皮在管腔中央留下一空腔。(B) 扭转复位组同侧睾丸显示曲细精管直径缩小,生精细胞层数减少。生精细胞仅发育到圆形精子细胞阶段(箭头所指处),未见成熟的精子。(C)清除活性氧组同侧睾丸呈现几乎正常的睾丸组织特征,有较多成熟精子(箭头所指处)。但管腔中央可见脱落的生精上皮,容易堵塞管腔。图片均苏木素-伊红染色,放大200倍
3 讨论
本资料中,大鼠经历1h的睾丸扭转,复位后仍然存活,但复位后3个月,生精功能严重破坏。TRF2是一个转录因子,调控生精细胞特异基因的转录,对生精细胞发育至关重要[2]。缺乏TRF2基因的成年雄性小鼠睾丸重量减轻50%,曲细精管直径缩小20%~30%,管中仅有精原细胞、精母细胞和圆形精子细胞,缺乏成熟的精子[2]。本资料结果显示:单侧睾丸扭转复位引起同侧睾丸TRF2表达明显降低,生精功能严重损伤,表现为睾丸重量减轻,曲细精管直径缩小,生精细胞发育停止在圆形精子细胞阶段,未见成熟的精子。因TRF2表达对精子发生必不可少,单侧睾丸扭转复位后同侧睾丸TRF2表达降低可能是生精功能损伤的原因之一。
睾丸扭转复位后的损伤是缺血再灌注损伤。睾丸缺血再灌注导致活性氧(如过氧化氢、羟自由基、超氧阴离子等)过量产生[1]。已有研究认为[1]:注入活性氧清除剂超氧化物歧化酶和过氧化氢酶可以减轻睾丸的缺血再灌注损伤,表明活性氧是引起睾丸损伤的原因。但活性氧通过何种分子机制损伤睾丸生精功能仍不明确。活性氧是高反应氧化剂,很难直接测定。丙二醛是活性氧的稳定末端产物,被认为是活性氧的可靠标志。本资料中,扭转复位组同侧睾丸的丙二醛水平明显升高,表明睾丸扭转复位后活性氧过量产生。活性氧可以通过调控基因表达影响细胞分化和凋亡[3]。
单侧睾丸扭转复位是否对对侧睾丸产生不利影响,目前存在争议。研究发现单侧睾丸扭转复位通过神经反射等机制导致对侧睾丸损伤[4],但另外一些研究未发现同样结果[5]。本资料,单侧睾丸扭转复位引起同侧睾丸的丙二醛水平、TRF2表达和生精功能发生明显变化,但对侧睾丸无显著改变。表明单侧睾丸扭转复位未引起对侧睾丸损伤。睾丸扭转复位后过量产生的活性氧通过下调TRF2表达导致生精功能损伤。其可能是睾丸扭转复位后生精功能损伤的机制之一。本资料结果也鼓励使用活性氧清除剂减轻睾丸损伤。
1 Lysiak JJ, Nguyen QA, Turner TT. Peptide and nonpeptide reactive oxygen scavengers provide partial rescue of the testis after torsion. J Androl, 2002,23(3):400~409.
2 Zhang D, Penttila TL, Morris PL, et al. Spermiogenesis deficiency in mice lacking the Trf2 gene. Science, 2001, 292(5519):1153~1155.
3 Tien Kuo M, Savaraj N. Roles of reactive oxygen species in hepatocarcinogenesis and drug resistance gene expression in liver cancers. Mol Carcinog,2006,45(9):701~709.
4 Karaguzel E, Kadihasanoglu M, Kutlu O. Mechanisms of testicular torsion and potential protective agents. Nat Rev Urol, 2014, 11(7):391~399.
5 Çayan S, Saylam B, Tiftik N, et al. Rho-kinase levels in testicular ischemiareperfusion injury and effects of its inhibitor, Y-27632, on oxidative stress,spermatogenesis, and apoptosis. Urology, 2014, 83(3): 675,e13~18
Objective This study investigated whether overproduction of ROS after testicular torsion-detorsion injures spermatogenesis by regulating TRF2 expression. Methods Sixty adult male Sprague-Dawley rats were divided into three groups of 20 rats each. Control group received a sham operation of left testis. Torsion-detorsion group underwent 1 hour of left testicular torsion. Scavenging ROS group received same operation as torsion-detorsion group,but superoxide dismutase and catalase,two ROS scavengers,were given intravenously at detorsion. Testes were harvested 4 hours or 3 months after detorsion to measure malondialdehyde level(a marker of ROS),TRF2 expression and spermatogenesis. Results Unilateral testicular torsion-detorsion signifi cantly increased malondialdehyde level,and reduced TRF2 expression and spermatogenesis in ipsilateral testes,suggesting that overgeneration of ROS after testicular torsion-detorsion might down-regulate TRF2 expression,leading to spermatogenic damage. In contrast,administration of superoxide dismutase and catalase significantly decreased malondialdehyde level,and increased TRF2 expression and spermatogenesis in ipsilateral testes. These results supported the above hypothesis. Conclusion Overproduction of ROS after testicular torsion-detorsion can damage spermatogenesis by down-regulation of TRF2 expression.
Testicular torsion-detorsion Reactive oxygen species TATA box-binding protein-related factor 2 Spermatogenesis
浙江医学高等专科学校博士科研启动基金项目(2008B05)
310053 浙江医学高等专科学校

