马铃薯块茎启动子驱动的淀粉合成酶基因RNAi载体构建及遗传转化
陈国梁,张金文,徐露,严海霞,张向前
(1.延安大学生命科学学院,陕西延安716000;2.甘肃农业大学农学院,甘肃兰州730070)
马铃薯块茎启动子驱动的淀粉合成酶基因RNAi载体构建及遗传转化
陈国梁1,张金文*2,徐露1,严海霞1,张向前1
(1.延安大学生命科学学院,陕西延安716000;2.甘肃农业大学农学院,甘肃兰州730070)
以马铃薯gbss、ssⅢ与ssⅡ基因的部分cDNA片段拼接成的融合基因gbs3s2为靶标,构建以马铃薯块茎组织特异性启动子GBSS驱动的RNAi表达载体pART-GF。采用农杆菌介导法对NHD3、NF和NC三个马铃薯品种进行了遗传转化,用PCR技术检测转基因植株,采用双波长法测定其微型薯中直链淀粉与支链淀粉的比值。经抗性筛选及PCR检测初步获得10株阳性植株,其中NC、NF和NHD3分别为2株、3株和5株,其微型薯中直链淀粉/支链淀粉比值明显下降。作者成功构建了马铃薯块茎启动子GBSS驱动的淀粉合成酶基因RNAi三价表达载体,初步获得了转基因马铃薯育种材料。
马铃薯;RNAi;块茎特异启动子;淀粉合成酶;遗传转化
马铃薯(Solanum tuberosum L.)淀粉是重要的食品和工业原料,在生产领域中应用十分广泛,但其在应用前一般要糊化,因此糊化温度成为其应用的关键[1-2]。而淀粉糊化温度又与支链淀粉与直链淀粉比例、淀粉链的长度及其结构密切相关[2-3]。随着人们对淀粉生物合成途径相关酶的深入研究及基因调控技术的日趋成熟,使得应用基因工程技术调控淀粉合成过程中相关酶的活性,从而提高淀粉中支链淀粉的含量、分枝度和控制支链长度,培育具有糊化温度低和优良凝沉特性的马铃薯新品系成为可能[4-12]。在马铃薯淀粉合成途径中SSⅡ、SSⅢ和GBSS三种关键酶对马铃薯总淀粉中的直链淀粉/支链淀粉比例、淀粉链长度与结构有决定性的影响[3,13-16]。作者以ssⅡ、ssⅢ和gbss基因为靶标,从中选取部分cDNA序列形成融合基因gbs3s2,并构建以马铃薯块茎组织特异性启动子GBSS驱动的ihRNAi的植物表达载体,对优良马铃薯品种植株进行遗传转化,期望获得能同时抑制ssⅡ、ssⅢ和gbss基因的转基因植株,为培育具有低直链淀粉含量、低糊化温度和抗冻融淀粉的马铃薯新品种提供育种材料。
1 材料与方法
1.1材料与试剂
马铃薯品种NC、NF和NHD3试管苗、大肠杆菌DH5α、农杆菌LBA4404、质粒pGEM-TG(含马铃薯块茎组织特异性启动子GBSS序列)、质粒pGEM-TR(含融合基因片段gbs3s2)、pART 27与pHANNIBAL:均为作者所在实验室保存;所用各种酶:均购自TaKaRa公司。
1.2RNAi植物表达载体的构建
用KpnⅠ/XhoⅠ消化测序结果正确的pGEMTR,回收小片段(gbs3s2)并与经同样酶切并回收的载体pHANNIBAL相连,得到含有正向片段的重组质粒pHF1;用ClaⅠ/Bam HⅠ消化pGEM-TR并回收小片段(gbs3s2),与经同样酶切并回收的pHF1质粒相连得到中间载体pHF;用Sac I、Xho I酶切消化pHF,回收大片段与用相同的两种酶消化pGEM-TG回收的小片段连接得到中间载体pHGF;然后用SacⅠ/SpeⅠ消化pHGF回收大片段与经同样酶切的pART 27相连,得到由块茎组织特异性启动子GBSS驱动的含有“正向gbs3s2-pdk内含子-反向gbs3s2”的ihRNAi三价植物表达载体pART-GF,见图1。
1.3马铃薯遗传转化及筛选鉴定
采用直接导入法将pART-GF导入农杆菌LBA4404,分别以NHD3、NF和NC三个优良马铃薯品种的试管苗茎段为受体材料,通过农杆菌介导法进行转化。用含卡那霉素培养基(MS+70mg/L Kan)进行抗性筛选。以转化再生的马铃薯植株叶片为材料,采用CTAB法提取基因组DNA并以此为模板,以R1/R6为引物进行PCR筛选鉴定。
1.4转基因微型薯的获得及其淀粉质量分数测定
将带芽茎段的转基因试管苗转入MS培养基(MS+8 g/dL蔗糖,用蒸馏水配制)后在光照下连续培养3周,再转入暗培养箱中培养50 d,收获微型薯,同时作对照。采用双波长法[17-18]对微型薯直链淀粉、支链淀粉及总淀粉质量分数进行测定。
2 结果与讨论
2.1RNAi植物表达载体的构建
根据所构建的载体序列及其特殊的限制性酶切位点,对所构建的载体进行PCR及酶切鉴定,pHF1载体经PCR及XhoⅠ/KpnⅠ双酶切均得到大小800 bp条带,见图2a。PCR鉴定与酶切均产生了与预期大小相同的条带,表明gbs3s2融合基因片段已经正向连接到载体上;用特异引物R5/R5、R3/R3对载体pHF进行扩增所得电泳条带大小分别约为1 400、1 900 bp,见图2b。对其进行酶切,所得电泳条带大小分别为800、2350bp左右,见图2c。PCR及酶切均产生了与预期大小相符的条带,表明gbs3s2融合基因正、反向片段均正确连接到载体上;用引物G1/G2对重组子pHGF进行扩增并用XhoI、Sac I对其进行双酶切,均得到大小约640bp的电泳条带,见图2d,产生了与预期大小相符的条带,表明块茎组织特异性启动子GBSS已经正确连接到载体pHGF上;最后用R1/R6引物对重组子pART-GF进行PCR检测所得电泳条带大小约为800bp,见图2e。用HindⅢ、XhoI/BamHI、SpeI/SacI分别对其进行酶切,经电泳检测依次得到约2000、2350、3 800bp大小的条带,见图2f。得到与预期大小相符的条带,表明成功构建了RNAi植物表达载体pART-GF,该载体的表达框架见图3。
2.2转化再生苗的PCR检测
以转化再生马铃薯植株叶片基因组DNA为模板,以R1/R6为引物进行PCR筛选鉴定。有10株均出现约810bp左右的特异条带(NHD35株、NF 3株、NC2株),而作为阴性对照的非转基因植株则无相应的条带,见图4。初步说明马铃薯块茎组织特异性启动子GBSS驱动的含有“正向gbs3s2-pdk内含子-反向gbs3s2”已整合到受体基因组中。
2.3转基因微型薯淀粉质量分数
经测定,对照组微型薯中直链淀粉和支链淀粉的质量分数分别是18.33%和51.67%,转基因微型薯中直链淀粉和支链淀粉的质量分数分别是5.00%和71.67%。对照组转基因微型薯中直链淀粉/支链淀粉的比值近似于1/3和1/14,可见转基因微型薯中直链淀粉/支链淀粉比例明显下降。
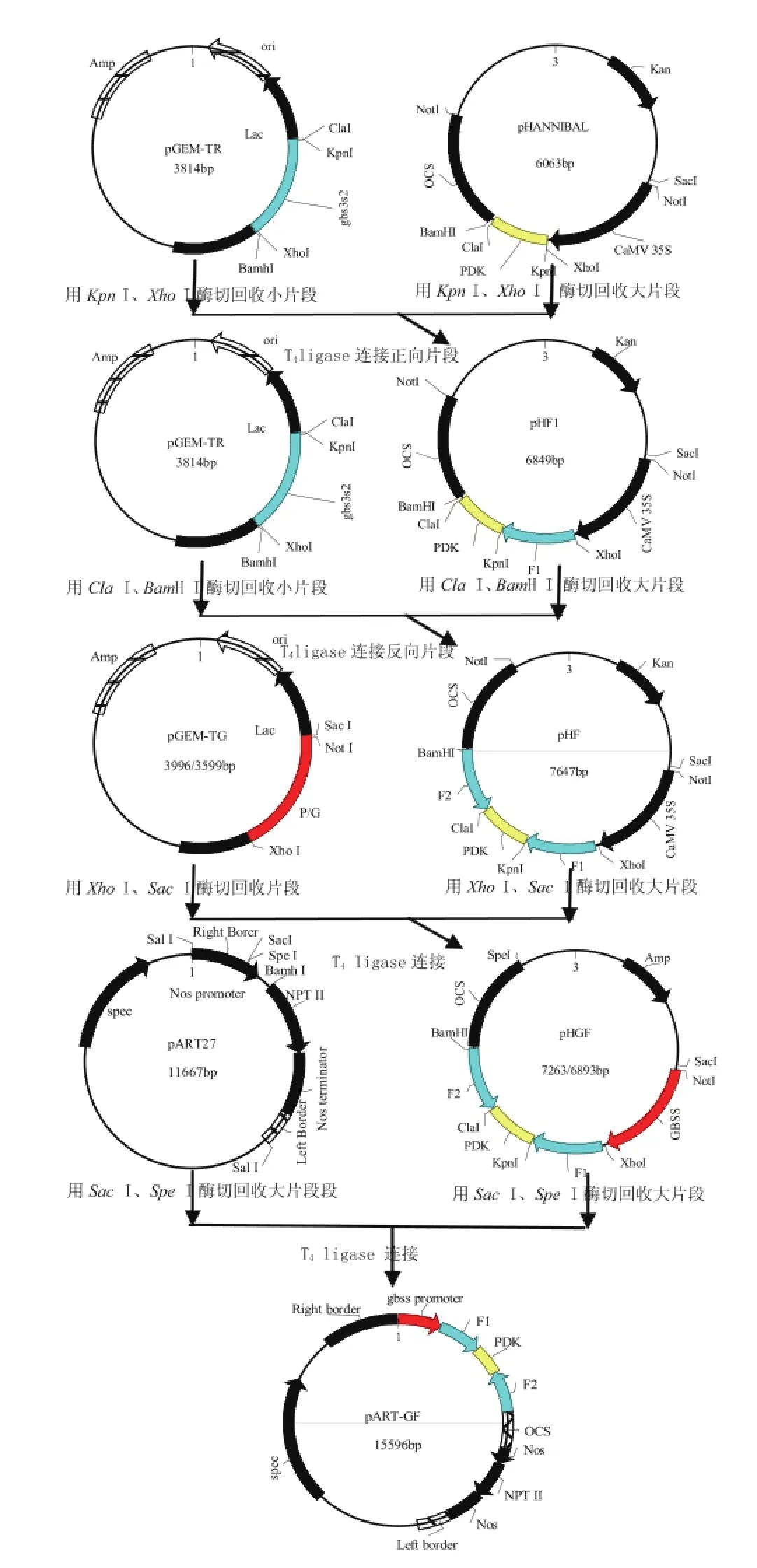
图1ihRNAi载体构建模式图Fig.1SchematicdiagramforconstructionoftheihRNAi
2.4讨论
目前转基因植物所用的启动子多为组成型启动子,该类型启动子调控下的外源基因在植物体内持续、高效表达,不仅造成植物体能量和营养的浪费,而且往往还会使某些性状发生改变,影响植株的正常发育[19]。马铃薯块茎不仅是马铃薯淀粉的贮藏与收获器官,而且是其合成器官,对马铃薯淀粉的改良,归根结底是对淀粉贮藏器官中的基因表达进行调控。与组成型启动子相比,组织特异性启动子可以避免由于非特异性、持续表达所造成的浪费,而在需要大量表达的特定组织部位却表达量低的缺点。因此,作者亚克隆了马铃薯块茎组织特异启动子GBSS并构建了相应的植物表达载体,确保融合基因在马铃薯块茎中能特异表达,以免产生上述问题。
马铃薯贮藏器官合成淀粉的原料主要来自叶片中淀粉降解或合成的蔗糖,其通过韧皮部运输到块茎并进入质体和淀粉体中,经一系列酶的催化生成ADPG,ADPG在淀粉分支酶(SBE)与可溶性淀粉
合成酶(SSS)作用下生成支链淀粉,也可在SSS及淀粉粒结合淀粉合成酶(GBSS)作用下生成直链淀粉。植物中SSS有SSⅡ和SSⅢ两种,Jobling等[10-11]曾采用反义技术在分别或同时抑制马铃薯SSⅡ和SSⅢ基因,在不改变其淀粉含量的同时显著地改变了支链淀粉的结构。如支链淀粉中大量产生了分枝链长为6~8的支链淀粉分子,而较短链(<6)和较长链(>12)的支链淀粉含量却大幅度地减少了,而一般形成淀粉粒双螺旋结构所需的最小分枝链长为10[20]。因此,运用RNAi技术同时调控SSⅡ、SSⅢ、GBSS的活性,使氢键作用强的直链淀粉分子的形成收到抑制,同时使淀粉分子间双螺旋结构的稳定性减弱,可以有效地减小破坏淀粉微晶体所需的能量,从而有可能得到低糊化温度的马铃薯品种或育种材料。

图2 载体构建电泳鉴定图Fig.2 Electrophoresis detectionmap of construction of vector

图3 ihRNAi表达框图Fig.3 Expression framew ork of ihRNAi
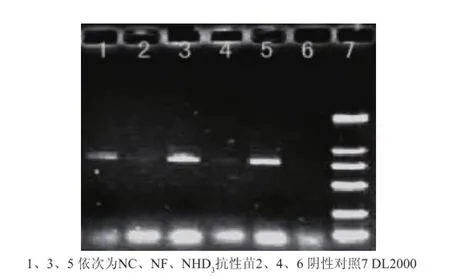
图4 再生植株的PCR检测Fig.4 PCR detection of regenerated p lants
与对照相比,转基因微型薯中直链淀粉/支链淀粉比例明显下降,初步推断可能是转基因微型薯内源gbss、ssⅢ和ssⅡ基因同时被干扰的结果,与实验设计预期相符,但转基因微型薯块茎中淀粉的天然结构,支链淀粉链长与天然淀粉相比是否有变化,其糊化温度和优良凝沉特性是否达到实验预期目标,还有待于进一步实验。
3 结语
成功构建了马铃薯块茎启动子GBSS驱动的含有驱动的含有“正向gbs3s2融合片段-pdk内含子-反向gbs3s2融合片段”ihRNAi的三价植物表达载体pART-GF,并采用农杆菌介导法对NHD3、NF和NC三个马铃薯品种进行了遗传转化,经抗性筛选及PCR检测初步获得了10株转基因马铃薯植株,经对其微型薯直链淀粉与支链淀粉质量分数初步测定,表明转基因微型薯中直链淀粉/支链淀粉的比值明显下降,与实验预期相符,为培育具有低直链淀粉含量、低糊化温度和抗冻融淀粉的马铃薯新品系奠定了基础。
[1]胡爱军,郑捷,秦志平,等.变性淀粉特性及其在食品工业中应用[J].粮食与油脂,2010,6:1-4. HU Aijun,ZHENG Jie,QIN Zhiping,etal.Propertiesofmodified starchesand their applications in food industry[J].Journal of Cerecals&Oils,2010,6:1-4.(in Chinese)
[2]于天峰,夏平.马铃薯淀粉特性及其利用研究[J].中国农学通报,2005,21(1):55-58. YU Tianfeng,XIA Ping.Characteristic and useof potato starch[J].Chinese Agricultural Science Bulletin,2005,21(1):55-58.(in Chinese)
[3]Smith A M,Denyer K,Martin C.What controls the amount and structure of starch in storage organs?[J].Plant Physiol,1995,107:673-677.
[4]Gidley M J,Bulpin P V.Crystallisation of malto-oligosaccharides as models of the crystalline forms of starch:minimum chain-length require-ment for the formation ofdoublehelices[J].Carbohydrate Research,1987,161:291-300.
[5]Heilersig H JB,Loonen A,BergervoetM,etal.(2006)Post-transcriptionalgene silencing of GBSSIin potato:effectof size and sequence of the inverted repeats[J].Plant M ol Biol,2006,60:647-662.
[6]Motoyasu O,Tatsuro H,KenjiK,etal.Inhibition of thegeneexpression for granule-bound starch synthase Iby RNA interference in sweetpotato plants[J].Plant Cell Reor ts,2007,26(10):1801-1807.
[7]Shimada T,OtaniM,Hamada T,Kim SH.Increase of amylose contentof sweet potato starch by RNA interference of the starch branching enzyme IIgene(IbSBEII)[J].Plant Biotechnology Jou rnal,2006,23:85-90.
[8]Shimada T,Otanim,Hamad T,et al.Increase of amylose content of sweetpotato by RNA interference of the starch branching enzymeⅡgene(IbSBE)[J].Plant Biotechnol,2006,23:85-90.
[9]陈国梁,张向前,穆三浪,等.利用RNA i技术改良淀粉品质的研究进展[J].生物技术通报,2009(10):88-101. CHEN Guoliang,ZHANG Xiangqian,MU Sanlang,etal.Research Advance of RNA Interference Technology in Starch Quality Im provement[J].Biotechnology Bulletin,2009(10):88-101.(in Chinese)
[10]Fulton D,Edwards A,Pilling E,et al.Role of granule-bound starch synthase in determ ination of amylopectin structure and starch granulemorphology in potato[J].J Biol Chem,2002,277:10834-10841.
[11]Jobling SA,Westcott R J,Tayal A,et al.Production of a freeze-thaw-stable potato starch by antisense inhibition of three starch synthase genes[J].Nat Biotechnol,2002,20(3):295-299.
[12]李加瑞,赵伟,李全梓,等.Waxy基因的RNA沉默使转基因小麦种子中直链淀粉含量下降[J].遗传学报,2005,32(8):846-854. LIJiarui,ZHAO Wei,LIQuanzi,et al.RNA Silencing of waxy gene results in low levels of am ylose in the seeds of transgenic w heat(Triticum aestivum L)[J].Journal of Genetics and Genom ics,2005,32(8):846-854.(in Chinese)
[13]Sm ith A M,Denyer K,Martin C.What controls the amount and structure of starch in storage organs?[J].Plant Physiol,1995,107:673-677.
[14]Sim th A M,Denyer K,M artin C.The synthesisof the starch granule[J].Plant M ol Biol,1997,48:67-87.
[15]Schw allG P,Safford R,WestcottR J,etal.Production of very-high-amylose potato starch by inhibition of SBEA and B[J].Natu Bio,2002,56:551-554.
[16]M arshall J,Sidebottom C,Debet M,et al.Identification of themajor starch synthase in the soluble fraction of potato tubers[J]. Plant Cell,1996,8(7):1121-35.
[17]常虹,周家华.葛根淀粉提取及直链-支链淀粉的双波长测定[J].食品工业科技,2009,30(11):239-276. CHANG Hong,ZHOU Jiahua.Extraction of Pueraria lobata starch and determ ination of amylose and amylopectin by dual-w avelength spectro-photometry[J].Science and Technology of Food Industry,2009,30(11):239-276.(in Chinese)
[18]戴双,程敦公,李豪圣.小麦直、支链淀粉和总淀粉含量的比色快速测定研究[J].麦类作物学报,2008,28(3):442-447. DAI Shuang,CHENG Dungong,LI Haosheng,et al.Simultaneous and rapid spectrophotometric determ ination of amylose,amylopectin,and totalstarch inwheatgrain[J].Journal of Triticeae Crops,2008,28(3):442-447.(in Chinese)
[19]李凤龙.枳根特异性contig2基因及启动子的克隆与分析[D].重庆:西南大学,2012.
Construction and Transformation of Starch Synthases Gene RNAi Expression Vector Regulating by Potato Tuber Specificity Promoter
CHENGuoliang1,ZHANG Jinwen*2,XU Lu1,YAN Haixia1,ZHANG Xiangqian1
(1.College of Life Science,Yan'an University,Yan'an 716000,China;2.College of Agronomy,Gansu Agricultural University,Lanzhou730070,China)
Using the fused gene-gbs3s2composed of the gbss(1-261),ssⅢ(2164-2407)and ssⅡ(161-441)gene cDNA fragments as target,we constructed ihRNAi expression vector pART-GF regulated by GBSS of potato tuber specificity promoter.The inverted repeat construct was transformed to elite potato cultivars NHD3,NF and NC by Agrobacterium LBA4404-mediated transformation,PCR technology was used to detect transgenic plants,and the ratio of amylose eand amylopectin in transgenicmini-potato were determ ined by dual-wavelength spectrophotometry.Ten regenerated plantswith kanamycin resistance were obtained through resistance screening and PCR detection.Among them,two was NC plants,three was NF plants,and five was NHD3 plants,respectively.The ratio of amylose and amylopectin in transgenic m ini-potato were detected to decrease significantly.IhRNAi expression vector pART-GF regulated by GBSS of potato tuber specificity promoter was successfully constructed and breeding material of transgenic potato was obtained.
Solanum tuberosum L.,RNA interference,tuber specificity promoter,amylosynthetase,genetic transformation
Q 933
A
1673—1689(2015)11—1141—05
2014-05-06
国家自然科学基金项目(30471101);陕西省高水平大学建设项目(2012SXTS06);陕西省教育厅省级重点实验室重点科研计划项目(2010JS065);延安大学专项科研基金项目(YDZ2012-12);国家级大学生创新训练计划项目(201310719006)。
陈国梁(1974—),男,陕西定边人,理学硕士,副教授,硕士研究生导师,主要从事植物生物技术方面的研究。
E-mail:glc9359@163.com
张金文(1958—),男,甘肃武威人,农学博士,教授,博士研究生导师,主要从事作物遗传育种、栽培生理生化方面的研究。
E-mail:jwzhang305@163.com

