LC-Q-TOF-MS法测定婴幼儿奶粉中5种核苷含量
王志元丁博曾广丰韦晓群陈文锐*
(1.广东出入境检验检疫局 广东广州 510623;2.广东省动植物与食品进出口技术措施研究重点实验室)
LC-Q-TOF-MS法测定婴幼儿奶粉中5种核苷含量
王志元1,2丁博1,2曾广丰1,2韦晓群1,2陈文锐1,2*
(1.广东出入境检验检疫局 广东广州 510623;2.广东省动植物与食品进出口技术措施研究重点实验室)
建立LC-Q-TOF-MS高分辨质谱技术快速筛查分析婴幼儿奶粉中鸟嘌呤核苷、腺嘌呤核苷、尿嘧啶核苷、胞嘧啶核苷和次黄嘌呤核苷等5种核苷含量的方法。利用丙酮、氯仿、乙酸锌与亚铁氰化钾、乙腈/0.1%三氟乙酸、乙腈/0.5%甲酸等不同蛋白质沉淀方法处理奶粉中蛋白质,离心、过滤除去大分子物质;中高压液相色谱分析,一级TOF-MS和二级IDA-MS高分辨质谱模式进行检测,外标法定量分析。结果表明,氯仿蛋白沉淀法最佳,核苷在5 min内达到基线分离,5-200 μg/L浓度范围内线性关系好,相关系数r达到0.999,5种核苷分析方法检出限为0.3-3 μg/L。本方法操作简单、准确,可快速定性和定量分析婴幼儿奶粉中核苷的含量。
LC-Q-TOF-MS;核苷;高分辨质谱;奶粉
1 前言
国际生命科学学会研究表明核苷酸具有提高人体免疫力、促使细胞再生与修复等生理功能,对人体生长发育有一定促进作用[1]。核苷酸包括嘌呤和嘧啶两类核苷酸化合物,它们在细胞中物质生化合成、能量供给、DNA和RNA合成和必需辅酶产生等一般生理代谢中起着关键作用,并且具有不同能量消耗、能量保存与物质补偿途径,嘌呤核苷酸主要从核苷碱基获得补充,嘧啶核苷酸主要是从核苷获得补偿[2,3]。由此可见,核苷酸及核苷被认为是一类重要的功能食品有效因子成分,在膳食补剂食品奶粉中添加核苷酸及核苷已成为国际共识。近十年来,我国国内市场婴幼儿奶粉食品安全问题频繁发生,比如三聚氰胺事件,因此检测分析婴幼儿奶粉中核苷的研究工作,对食品奶粉质量安全有着重要作用与意义。
奶粉中核苷测定主要涉及蛋白质沉淀前处理问题,文献报道蛋白质沉淀方法有甲醇及甲醇与水方法[4,5]、三氯乙酸方法[6]、甲醇与氯仿方法[7]、乙腈及乙腈与甲酸方法[8]和丙酮方法[9],不同蛋白质沉淀方法对核苷测量结果影响不同。为此本研究选择氯仿、丙酮、乙酸锌与亚铁氰化钾、乙腈与0.1%三氟乙酸或0.5%甲酸等沉淀蛋白质方法,考察它们对核苷含量测定的影响。
目前,核苷酸及核苷的仪器测定法包括液相色谱法[10,11]、毛细管电泳法[12]、液相色谱-质谱方法[7,13,14]等。其中液相色谱-质谱法是常用的核苷酸及核苷分析方法,该分析方法具有基质干扰少、操作简单、重现性好等特点。因此,本研究选择LC-Q-TOF-MS分析方法,高分辨质谱技术定性定量分析奶粉中核苷的含量。本方法快速、灵敏准确,适应于复杂基质奶粉样品的分析。
2 材料与方法
2.1材料
2.1.1仪器
Triple TOF®5600+高分辨质谱仪:美国ABsciex公司;HPLC 20AD高效液相色谱仪:日本岛津公司;Atlantis®T3色谱柱(100 mm×3 mm,3 μm):美国Waters公司;氮吹浓缩仪(Turbo Vap@LV:瑞典Biotage公司;T25高速均质机、VORTEX 4旋涡混匀器:德国IKA公司;4k-15离心机:美国Sigma公司;Milli-Q超纯水装置:美国Millipore公司。
2.1.2试剂
5种核苷标准品(腺嘌呤核苷、鸟嘌呤核苷、胞嘧啶核苷、尿嘧啶核苷和次黄嘌呤核苷):购于德国Dr Ehrestorfer公司;乙腈、甲醇:色谱纯,美国赛默飞世尔科技公司;三氟乙酸、甲酸、乙酸锌、亚铁氰化钾和丙酮:分析纯,广州化学试剂厂。所有用水均为纯水机产生的超纯水(电阻值18.2MΩ·cm)。
2.2方法
2.2.1仪器工作条件
2.2.1.1色谱条件
色谱柱:Atlantis®T3色谱柱(100 mm×3 mm,3 μm);进样体积:5 μL;流速0.5 mL/min;柱温:40℃;梯度洗脱条件:流动相A-0.1%甲酸-5mM甲酸铵水溶液,流动相B-乙腈;初始2%B相5 min升至10%,保留2 min,0.1 min降至2%,保留2.9 min。
2.2.1.2质谱条件
离子源:ESI和APCI复合源;正离子扫描方式;APCI源连接ABsciex公司自动校正系统(CDS),每10个样品自动校正1次;APCI正离子校正液流速:0.3 mL/min;Curtain gas:40 psi;离子源gas 1:50 psi;离子源gas 2:50 psi;离子源温度:500℃;离子源电压:5500 V。一级TOF-MS扫描准确质量范围:100-1000 Da;数据采集时间:100 ms;DP:100 V;CE:10 V。二级IDA-MS扫描准确质量范围:50-1000 Da;DP:100V;CE:35±15V;高灵敏模式;数据采集时间:50 ms;信号阈值:100 cps;IDA实验每循环采集6次数据,动态背景减法扣除。
2.2.2标准溶液配制
用超纯水分别配制腺嘌呤核苷、鸟嘌呤核苷、胞嘧啶核苷、尿嘧啶核苷和次黄嘌呤核苷等5种核苷标准储备液(质量浓度为1 mg/mL),根据需要配制系列质量浓度的混合标准工作溶液。
2.2.3样品前处理
准确称量5.000 g婴幼儿奶粉,用30 mL温水溶解,超声振荡10 min,定容至50 mL刻度管;分别取2 mL溶液各分别加入2 mL氯仿、丙酮、乙酸锌与亚铁氰化钾、乙腈/0.1%三氟乙酸和乙腈/0.5%甲酸等不同沉淀剂,涡旋、离心,转移上清液至25 mL刻度管,加入纯净水定容,取1 mL溶液过0.22 μm滤膜,直接进样分析。
2.2.4数据分析方法
高分辨质谱数据在ABSciex公司的Analyst TF 1.6软件采集,质谱数据在PeakView2.0,MasterView 2.0和MultiQuant 3.0等软件上定性定量处理分析。
3 结果与讨论
3.1LC-Q-TOF-MS液质数据参数
在ABSciex triple TOF 5600+高分辨质谱仪上获得每种核苷的一级TOF-MS和二级IDA-MS质谱数据,准确分子量、同位素分子量和准确碎片分子量等质谱数据用来定性分析;根据一级TOF-MS准确分子量对应离子流色谱信号强度定量分析。5种核苷提取离子流色谱图见图1,高分辨质谱数据见表1。
PeakView 2.0软件配制质量误差、同位素比值差异、二级碎片数据库评分和分子式搜索评分四种功能。当准确分子量误差小于5 ppm,同位素比值差异小于10%,二级碎片数据库评分大于70%和分子式搜索评分大于70%时,可确定待测物质是目标核苷物质。
3.2样品前处理方法的优化
3.2.1沉淀方法的选择
根据文献报道和本实验室常用的氯仿和乙酸锌与亚铁氰化钾两种蛋白质沉淀方法,本研究设计选择氯仿、丙酮、乙酸锌与亚铁氰化钾、乙腈/0.1%三氟乙酸和乙腈/0.5%甲酸等5种蛋白质沉淀方法处理婴幼儿奶粉中蛋白质,结果见表2。
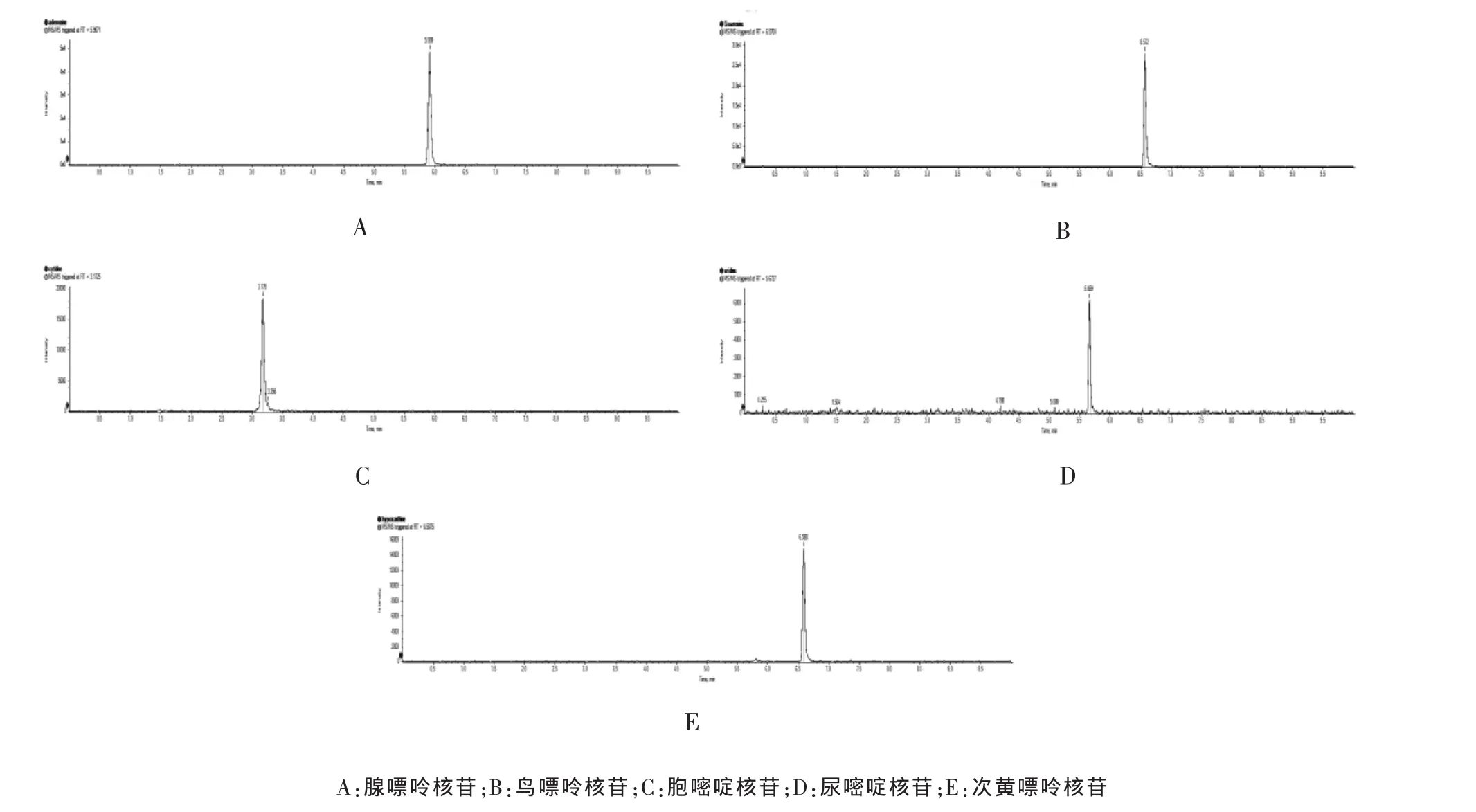
图1 5种核苷的离子流色谱图

表1 5种核苷高分辨质谱数据
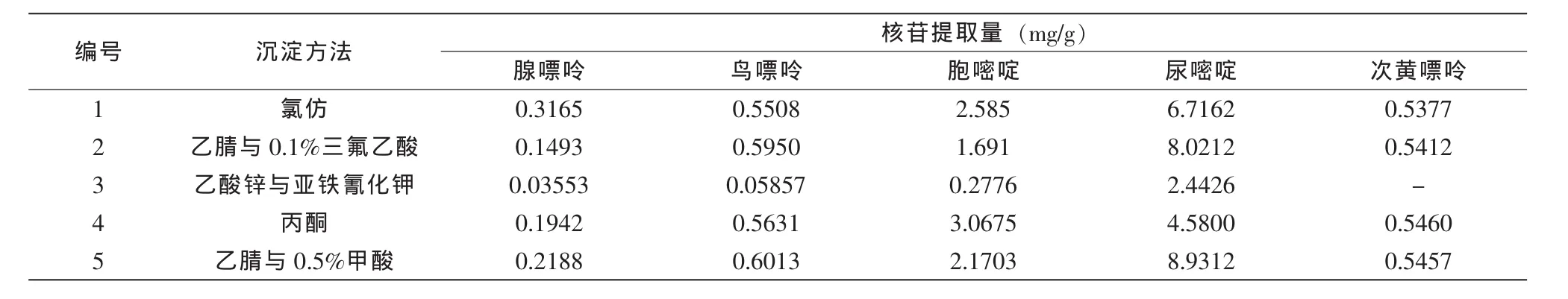
表2 不同蛋白质沉淀方法的核苷提取量
试验结果显示,用氯仿、乙腈与0.1%三氟乙酸、丙酮沉淀奶粉中蛋白质,5种核苷提取含量较好,乙酸锌与亚铁氰化钾沉淀蛋白质时,核苷的提取含量最低。结合沉淀溶剂对液相色谱与质谱仪器的影响,以及沉淀溶剂与水的溶解性,本研究选择氯仿蛋白质沉底方法作为奶粉中蛋白质前处理方法。
3.2.2沉淀剂氯仿用量
2 mL奶粉温水溶液分别加入1、2和4 mL氯仿沉淀除去其中蛋白质,测量婴幼儿奶粉中核苷含量,结果见表3。
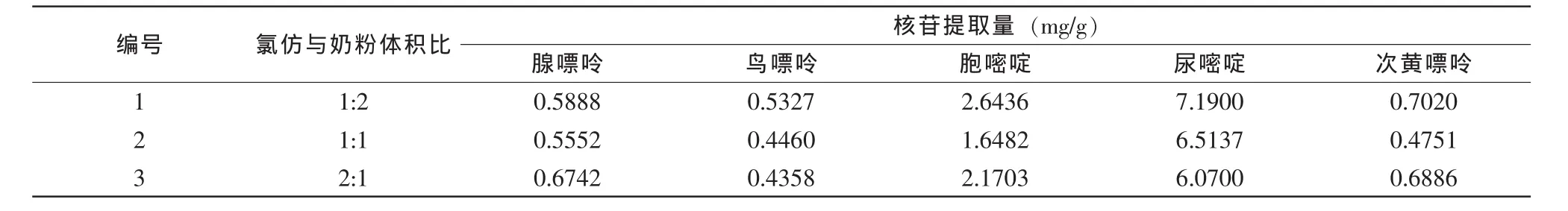
表3 不同蛋白质沉淀方法的核苷提取量
试验结果显示,不同蛋白质沉淀剂氯仿用量对奶粉中核苷测量呈现较显著的差异,氯仿为1∶2时,核苷提取含量较高。因此,试验选择氯仿与奶粉体积比为1∶2作为蛋白质沉淀剂氯仿的用量。
3.3方法的检出限、定量限、线性范围和加标回收率
5种核苷混合标准液按照色谱和质谱条件进行测定,得到每种物质LC-Q-TOF-MS仪器方法的线性范围、线性方程、相关系数、检出限和定量限,结果见表4。

表4 核苷的检出限、定量限与线性范围
另外,为了考察氯仿沉淀蛋白质的前处理方法与LC-Q-TOF-MS仪器方法,试验选择7.5mg/kg和 15 mg/kg浓度的核苷混合溶液进行加标回收率实验验证,结果见表5。
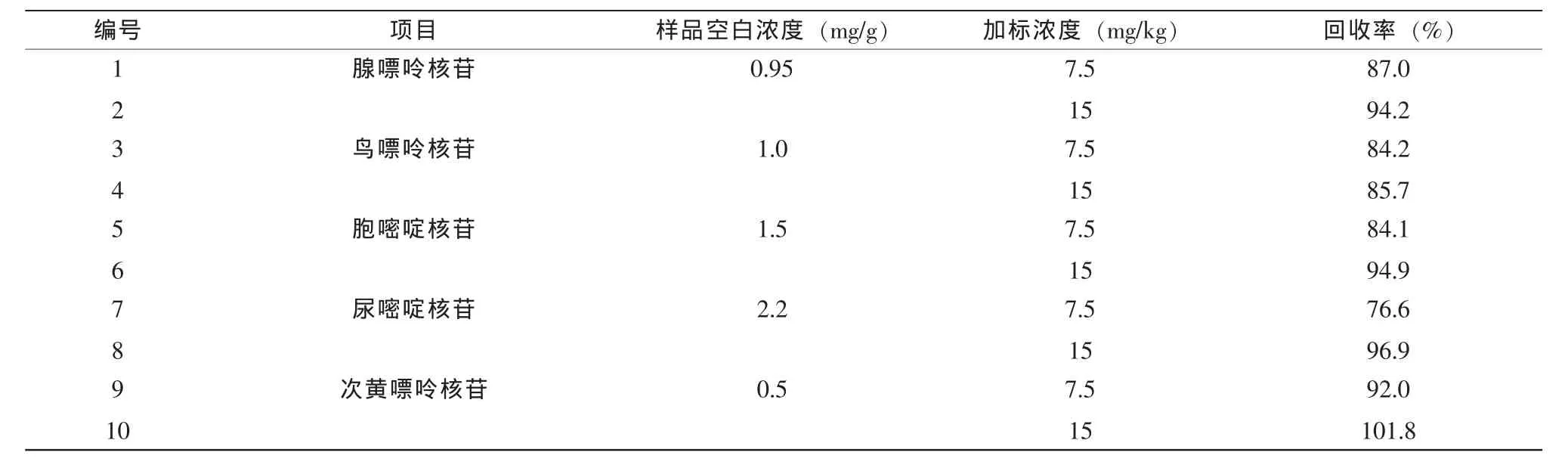
表5 回收率实验结果
结果显示,利用本方法测定5种核苷的含量,加标回收率在84.0%-102%之间,表明氯仿沉淀奶粉中蛋白质前处理方法与LC-Q-TOF-MS分析方法可以用来测定婴幼儿奶粉中核苷的含量。
3.4实际样品测定
选择广东检验检疫技术中心食品实验室日常检测的10种奶粉样品,利用本分析方法测定其中核苷的含量,结果见表6。
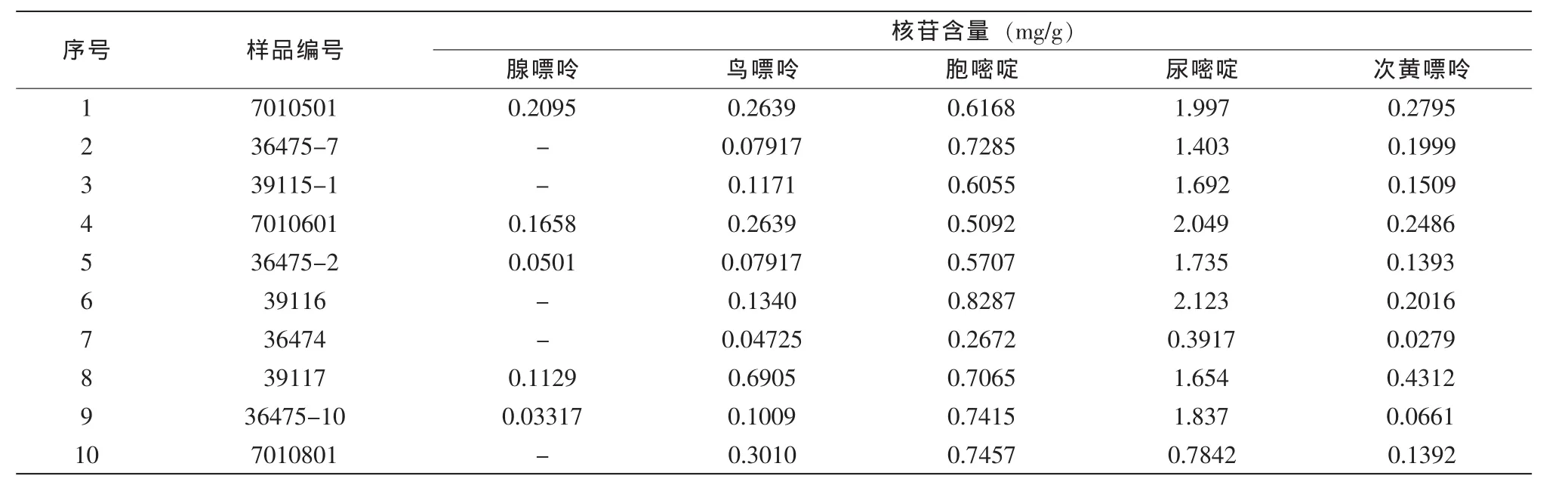
表6 实际样品测定结果
结果显示,不同奶粉样品中核苷含量差异比较显著,其中胞嘧啶核苷和尿嘧啶核苷的含量较高。
4 结论
本研究建立氯仿沉淀蛋白质前处理技术与LCQ-TOF-MS分析方法测定膳食补剂婴幼儿奶粉中核苷的含量,5种核苷的分析方法加标回收率在84%-102%之间;方法简单、准确,可用于婴幼儿奶参考文献
粉乳粉中核苷的含量测定。
[1]国际生命科学学会.功能性食品的科学[M].陈君石,闻芝梅,译.第1版.北京:人民卫生出版社,2002.
[2]A Jurecka.Inborn errors of purine and pyrimidine metabolism[J].Journal of Inherited Metabolic Disease,2009,32:247-263.
[3]S Al-Shehri,M Henman,B G Charles,et al.Collection and determination of nucleotide metabolites in neonatal and adult saliva by high performance liquid chromatography with tandem mass spectrometry[J].Journal of Chromatography B,2013,931:140-147.
[4]D Carli,M Honorat,S Cohen,et al.Simultaneous quantification of 5-FU,5-FUrd,5-FdUrd,5-FdUMP,dUMP and TMP in cultured cell models by LC-MS/MS[J].Journal of Chromatography B,2009,877:2937-2944.
[5]T Uehara,A Yokoi,K Aoshima,et al.Quantitative Phosphorus Metabolomics Using Nanoflow Liquid Chromatography-Tandem Mass Spectrometry and Culture-Derived Comprehensive Global Internal Standards[J].Analytical Chemistry,2009,81:3836-3842.
[6]H Khan.Bioluminometric assay of ATP in mouse brain:Determinant factors for enhanced test sensitivity[J].Journal of Biosciences,2003,28:379-382.
[7]J Klawitter,V Schmitz,J Klawitter,et al.Development and validation of an assay for the quantification of 11 nucleotides using LC/LC-electrospray ionization-MS[J].Analytical Biochemistry,2007,365:230-239.
[8]R L Cordell,S J Hill,C A Ortori,et al.Quantitative profiling of nucleotides and related phosphate-containing metabolites in culturedmammaliancellsbyliquidchromatographytandem electrospray mass spectrometry[J].Journal of Chromatography B,2008,871:115-124.
[9]刘靖芳,施秉银.不同蛋白沉淀方法对尿蛋白双向电泳结果的影响[J].山东医药,2010,50:101-102.
[10]K M Olesen,S H Hansen,U Sidenius,et al.Determination of leukocyte DNA 6-thioguanine nucleotide levels by high-performanceliquidchromatographywithfluorescencedetection[J]. Journal of Chromatography B,2008,864:149-155.
[11]K Nakajima,S Kitazume,T Angata,et al.Simultaneous determination of nucleotide sugars with ion-pair reversed-phase HPLC[J].Glycobiology,2010,20:865-871.
[12]H T Feng,N Wong,S Wee,et al.Simultaneous determination of 19 intracellular nucleotides and nucleotide sugars in Chinese Hamster ovary cells by capillary electrophoresis[J].Journal of Chromatography B,2008,870:131-134.
[13]S Cohen,L P Jordheim,M Megherbi,et al.Liquid chromatographicmethodsforthedeterminationofendogenousnucleotides and nucleotide analogs used in cancer therapy:A review[J].Journal of Chromatography B,2010,878:1912-1928.
[14]张婷婷,曾明飞,金燕,等.反相高效液相色谱-串联质谱法测定母乳及奶粉中核苷和核苷酸的含量[J].分析化学,2014,42:585-591.
Determination of Five Kinds of Nucleosides in Infant Formula by LC-Q-TOF-MS
Wang Zhiyuan1,2,Ding Bo1,2,Zeng Guangfeng1,2,Wei Xiaoqun1,2,Chen Wenrui1,2*
(1.Guangdong Entry-Exit Inspection and Quarantine Bureau,Guangzhou,Guangdong,510623;2.Guangdong Key Laboratory of Import and Export Technical Measures of Animal,Plant and Food)
It was established for the determination of adenosine,guanosine,cytidine,uridine and inosine in the infant formula by LC-Q-TOF-MS.The sample were dissolved in water and pretreated by adding acetone,chloroform,zinc acetate and potassium ferrocyanide,acetonitrile with 0.1%trifluoroacetic acid andacetonitrilewith0.5%aceticacidtoprecipitatetheproteins,respectively.Thesampleswere centrifuged with ultrafiltration centrifugal tube before injection into the chromatographic system,which were monitored in the TOF-MS and IDA-MS mode.The result showed that adding chloroform to precipitate the proteins was the better pretreatment method.The concentration of nucleosides in the range of 5-200 μg/L was linearly correlated to the peak area,with correlation coefficients greater than 0.999, and limit of detection 0.3-3 μg/L.It was a simple,quick and accurate analytical method for the detection of nucleosides in the infant formula.
LC-Q-TOF-MS;Nucleosides;High Resolution Mass Spectrometry;Infant Formula
O657.63
E-mail:wzyciq@163.com;*通讯作者E-mail:chenciq119@163.com
广州市科技计划项目(KHYZ2013B17);广东出入境检验检疫局科技计划项目(GD2013K48)
2015-05-27

