荧光分光光度法研究可卡因与牛血清白蛋白之间的相互作用*
陈引进 吴德孝 魏富凯 张宇峰
(江苏警官学院,江苏南京 210031)
荧光分光光度法研究可卡因与牛血清白蛋白之间的相互作用*
陈引进吴德孝魏富凯张宇峰
(江苏警官学院,江苏南京210031)
目的:研究不同温度下可卡因与牛血清白蛋白(BSA)之间的相互作用及其作用机制。方法:通过荧光光谱法研究可卡因对BSA的荧光猝灭光谱和同步荧光光谱,确定荧光猝灭方式,并根据热力学方程讨论两者间的作用力类型。结果:可卡因对BSA的荧光呈规律性猝灭,分别用Stern-Volmer方程、Lineweaver-Burk方程和热力学方程等分析处理实验数据,求得在不同温度下反应的结合常数K分别为1.38×103L/mol (30℃)和6.19×103L/mol(37℃)、结合位点数n为1、热力学参数ΔH、ΔS、ΔG分别为167.44 KJ/mol、612.71J/mol·K、-18.21 KJ/mol(30℃)和-22.50 KJ/mol(37℃)。结论:可卡因对BSA的荧光猝灭机制为静态猝灭。两者的相互作用力主要是疏水作用力。
荧光光谱法可卡因牛血清蛋白相互作用
可卡因(cocaine)化学名为苯甲酰甲基芽子碱,又称古柯生物碱。导致其滥用的主要原因是其强烈的中枢神经系统兴奋作用(欣快感)[1]。可卡因的滥用可导致机体多个系统、脏器的损伤[2],严重者可诱发心律紊乱、全身抽搐、呼吸衰竭而致死。对于长期小剂量滥用所致的慢性中毒,主要是心理依赖性反应,生理依赖很轻[3]。
血清白蛋白是人和动物血清中含量最丰富的一种蛋白质,与各种带正电荷的物质及电中性物质均有一定程度的相互作用。各类药物进入人体首先与血清白蛋白结合,通过血浆的存贮和运输,到达受体部位产生药理作用[4]。研究各种药物与血清白蛋白的结合,来获取药物分子对蛋白质分子构象的影响以及药物的药理等有用信息,已经引起了生命科学、化学、药学及临床医学科研工作者的普遍关注。目前研究生物大分子与药物小分子相互作用的方法主要有荧光光谱法[5]、紫外光谱法[6]、圆二色谱法[7]、拉曼光谱法[8]、电化学法[9]和核磁共振法[10]等。
荧光光谱法是研究生物大分子与药物小分子化合物之间相互作用很有效的方法,发射峰的位置、荧光偏振、能量转移、荧光寿命等指标均可以对蛋白质中荧光发色团的结构及其所处的微环境提供有用的数据信息[11]。
本文采用荧光光谱法,在模拟生理条件下,定性研究可卡因与牛血清白蛋白(BSA)的相互作用机理,分析其作用力类型,确定其结合常数和结合位点数,再通过同步荧光法确定可卡因对BSA构象的影响方式,进而分析可卡因对人体的作用和运转代谢情况,获得蛋白质分子的构象及其变化和可卡因的药理效应等信息。
1 实验部分
1.1仪器与试剂
1.1.1仪器
Cary Eclipse Fluorescence Spectrophotometer型荧光分光光度计(Aglient Technologies);FA1104N电子分析天平(上海恒平科学仪器有限公司);HH-2数显恒温水浴锅(上海叶拓仪表有限公司)。
1.1.2试剂
牛血清白蛋白(BR,国药集团化学试剂有限公司);盐酸可卡因(BR,公安部物证鉴定中心);三羟甲基氨基甲烷(Tris)(BR,国药集团化学试剂有限公司);盐酸(HCl)(AR,上海久亿化学试剂有限公司);氯化钠(NaCl)(AR,西陇化工股份有限公司)。
1.1.3溶液配置
牛血清白蛋白(BSA)标准储备溶液:准确称取纯度大于99%的牛血清白蛋白0.335g于50ml容量瓶中,以pH=7.4的0.1mol/L三羟甲基氨基甲烷(Tris)-盐酸缓冲液(其中含0.1mol/LNaCl维持离子强度)定容为50ml,浓度为1.0×10-4mol/L,低温(≤4℃)保存于冰箱。
可卡因标准储备溶液:用电子天平准确称取4mg标准品于100ml的容量瓶中,以pH=7.4的Tris-HCl缓冲液(其中含0.1mol/ LNaCl维持离子强度)溶解并定容,浓度为40.0μg/mL,低温(≤4℃)保存于冰箱。
实验时所需浓度由Tris-HCl缓冲溶液(pH=7.4,内含0.1mol/ LNaCl维持离子强度)稀释而得。所用试剂均为分析纯,实验用水为怡宝纯净水。
1.2实验方法
于编号为0-7的4mL离心管中分别加入2mL1.0×10-4mol/L的BSA溶液,使用移液枪分别加入的40mg/L盐酸可卡因工作液0、10、20、30、40、50、60、70μL,充分摇匀,并分别在T=30℃和T=37℃的条件下恒温水浴1h。采用1cm石英比色皿,选择激发波长为292.03nm,狭缝宽度均为5nm,光电管负高压为400V,扫描速率1200nm/min,扫描并绘制300-500nm的荧光光谱,以及固定荧光激发与发射的波长差△λ=15nm和△λ=60nm的同步荧光光谱。
2 结果与讨论
2.1荧光猝灭光谱
按照实验方法分别测定了30℃、37℃温度下不同浓度的可卡因对牛血清白蛋白的荧光猝灭光谱,30℃时的猝灭光谱见图1。由图1可知,随着可卡因浓度的逐渐增加,牛血清白蛋白的荧光特征峰逐渐降低。这是由于BSA中存在的色氨酸和酪氨酸,使其具有内源荧光[12],当固定BSA的量而不断增加可卡因的浓度时,可卡因与BSA之间的相互作用导致BSA内源荧光强度有规律性的猝灭。
2.2荧光猝灭机理及猝灭常数的测定
引起BSA荧光猝灭的原因可能有动态猝灭和静态猝灭两种。动态猝灭过程遵循Stern-Volmer方程[13]:

式中,F0和F表示不存在和存在猝灭剂时荧光物质的荧光强度,[Q]为猝灭剂的浓度,Ksv为动态猝灭常数(又称为Stern-Volmer猝灭常数),Kq是由扩散过程控制的双分子动态猝灭速率常数。τ0为没有猝灭剂存在下荧光分子平均寿命,生物大分子荧光寿命约为10-8s[14]。
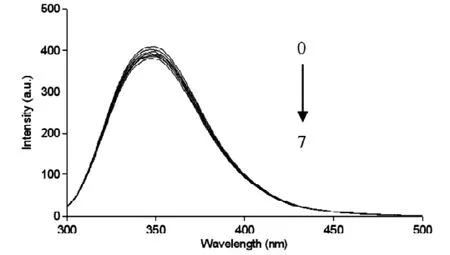
图1 曲线0-7分别对应可卡因的浓度为0、0.586、1.165、1.740、2.308、2.871、3.428、3.981 μ mol/L;BSA的浓度为1.0×10-4mol/L
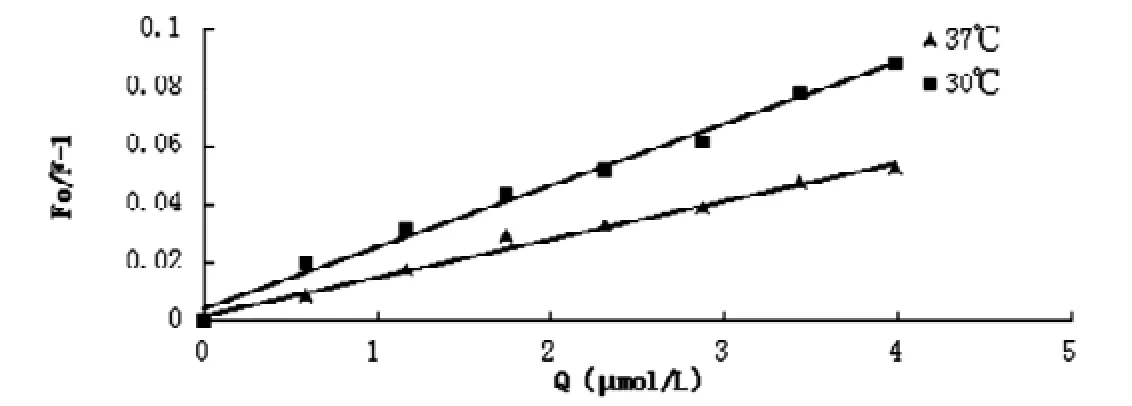
图2 可卡因与牛血清白蛋白相互作用在30℃和37℃时的Stern-Volmer方程
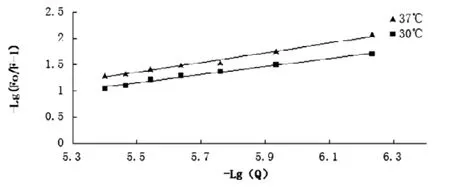
图3 可卡因与牛血清白蛋白相互作用在30℃和37℃时的lg[(Fo-F)/F]-1-lg[Q]-1图
静态猝灭过程遵循下式:

式中,Ks是静态猝灭常数(即配合物的缔合常数)。随温度升高动态猝灭常数增大,而静态猝灭常数减小,可由此判断荧光猝灭类型。
以F0/F对相应的[Q]作图,得到可卡因对BSA之间猝灭的Stern-Volmer曲线,继而得到不同温度下可卡因对BSA荧光猝灭的Stern-Volmer方程。由Stern-Volmer方程得到在30℃和37℃时Ksv分别为:Ksv30=2.1162×104;Ksv37=1.3099×104。
由于生物大分子的荧光寿命约为10-8s,由方程:

可以得到不同温度下的可卡因和BSA之间猝灭过程的速率常数Kq数量级均为1012。Kq大于各类猝灭剂对生物大分子的最大动态猝灭速率常数2.0×1010L/mol·S[15],所以加入可卡因导致BSA荧光猝灭不是由动态碰撞引起的,可以初步判断猝灭过程是以静态猝灭为主,而随温度升高,Stern-Volmer方程的斜率(即动态猝灭常数)逐渐减小,进一步表明猝灭过程是以静态猝灭为主。
2.3结合常数及结合点数的测定
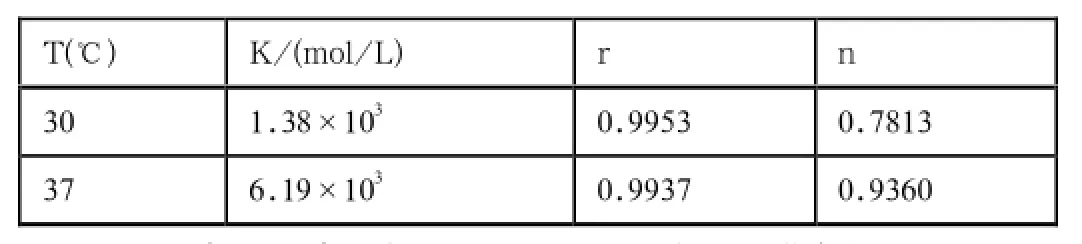
表1 可卡因与BSA相互作用的结合常数及结合点数
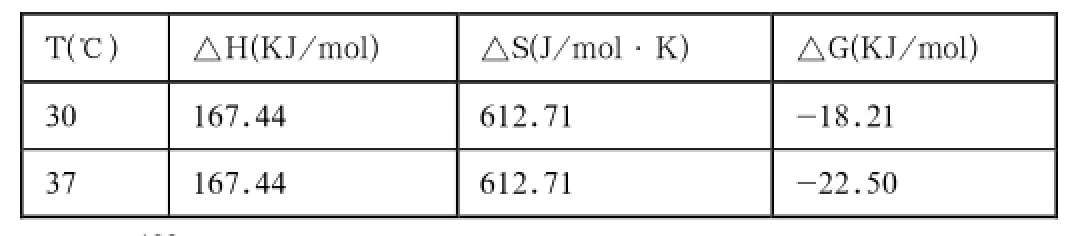
表2 可卡因与BSA相互作用的热力学参数
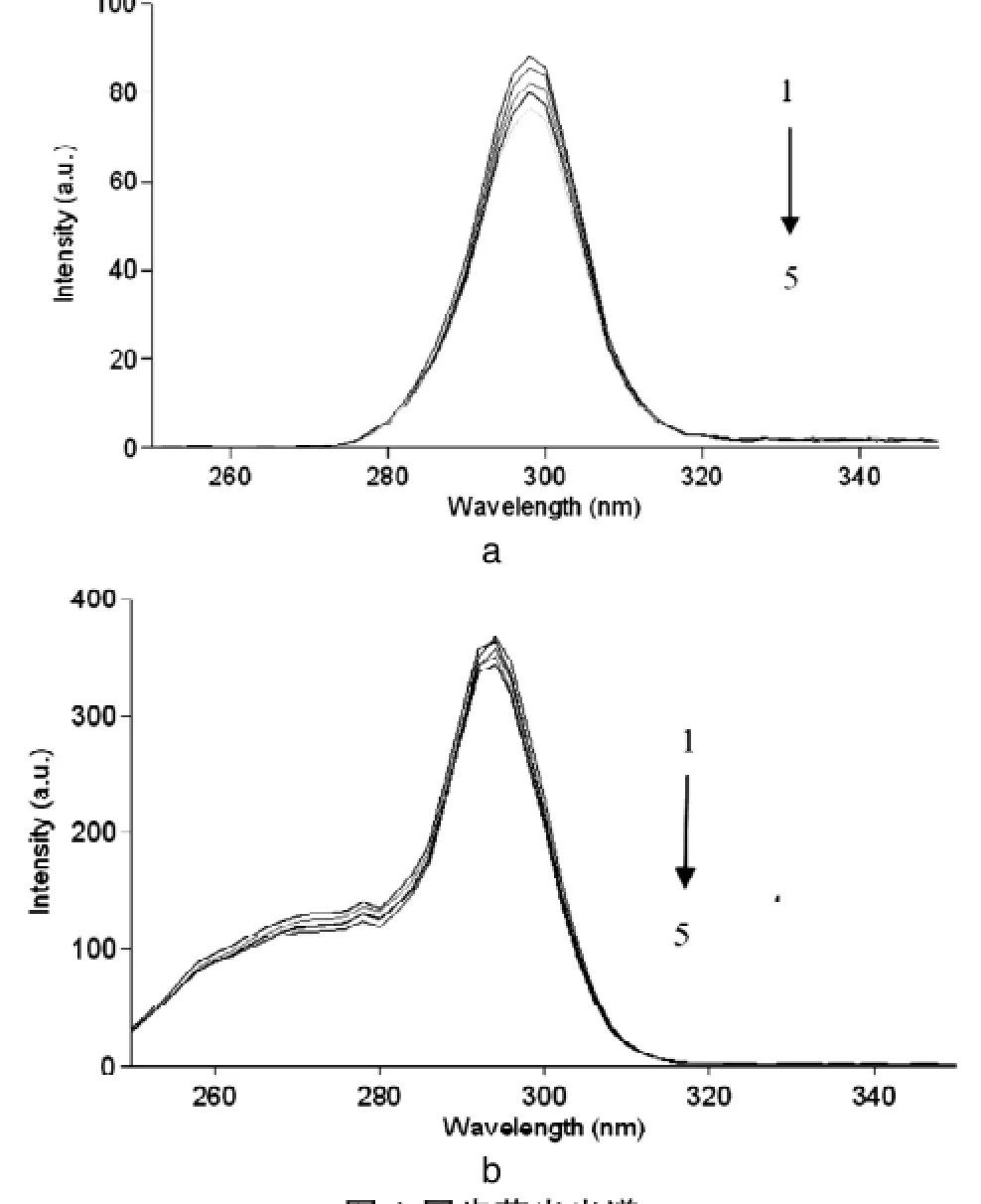
图4 同步荧光光谱
当小分子与大分子结合时,其表观结合常数K与结合位点数n可由下式求得[16]:

式中:K为结合常数;n为结合点数。
对30℃和37℃时的lg[(Fo-F)/F]-1-lg[Q]-1作双对数图,如图3。
根据截距和斜率求得不同温度下的结合常数K和结合点数n(见表1)。由表可知在实验条件下结合位点数n接近1,说明盐酸可卡因与BSA可形成1个结合点数。而在30℃和37℃时的K值处于同一数量级,则更加印证了可卡因对BSA的猝灭方式为静态猝灭。
2.4BSA与可卡因结合反应的热力学参数和作用力的确定
分子间的作用力包括氢键、范德华力、静电引力、疏水作用力等4种。当温度变化不大时,反应的焓变ΔH可认为是常数。根据反应前后的热力学参数焓变△H和熵变△S的相对大小,可以确定分子间的相互作用力类型:当△H<0,△S<0为氢键和范德华力;而当△H<0,△S>0为静电引力;△H>0,△S>0时为疏水作用力[5]。由热力学公式:
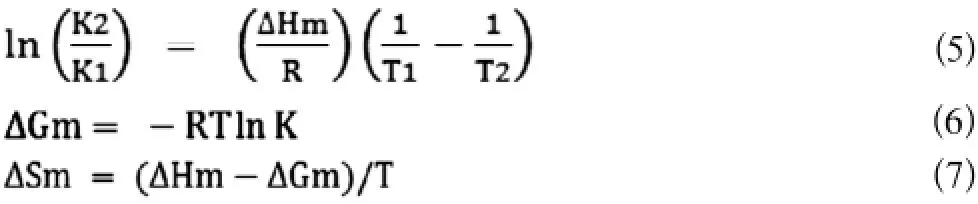
结合K,分别计算出不同温度时可卡因与BSA作用的自由能变ΔGm、焓变ΔHm和熵变ΔSm(结果见表2),可得30℃,37℃时的可卡因和BSA的热力学参数ΔH均为167.44KJ/mol,自由能变(ΔG)分别为-18.21,-22.50KJ/mol,ΔS均为612.71J/mol·K。
根据Ross等总结出的判断生物大分子与小分子结合力性质和生物大分子自身结合力性质的热力学规律[17],推断出可卡因与BSA之间的作用力以疏水作用力为主。
2.5同步荧光光谱
对于蛋白质的同光荧光光谱,△λ=15nm时仅表现为酪氨酸残基的荧光,△λ=60nm时则显示色氨酸残基的荧光。因芳香族氨基酸残基的最大发射波长与所处环境极性有关,若其最大发射波长改变,说明残基所处的微环境发生了改变,由发射波长的改变可判断BSA中芳香氨基酸残基所处微环境的变化[12]。
由△λ为15nm和60nm的同步荧光光谱(如图4)可知,酪氨酸残基和色氨酸残基的特征荧光光谱峰均随可卡因浓度的增加而产生猝灭,但对酪氨酸和色氨酸特征峰的位置影响不大,表明可卡因对牛血清蛋白构象的改变不大[18]。相比之下,色氨酸残基荧光猝灭程度比酪氨酸残基更显著,表明结合位点更接近于色氨酸残基。
在可卡因与牛血清白蛋白相互作用的过程中,随可卡因浓度升高,牛血清白蛋白的荧光强度呈有规律下降。在可卡因对牛血清白蛋白的荧光猝灭过程中,随温度升高,猝灭常数降低,猝灭方式为静态猝灭。两者以物质的量比1:1结合,作用力类型为疏水作用力;同步荧光扫描结果显示,可卡因对牛血清白蛋白的构象影响不大,两者的结合点可能位于色氨酸上。
3 结语
本文采用荧光光谱法研究可卡因与牛血清白蛋白之间的相互作用。结果表明:可卡因对BSA的荧光猝灭为静态猝灭,两者相互作用的结合常数K分别为1.38×103L/mol(30℃)和6.19×103L/mol(37℃)、结合位点数n为1、热力学参数ΔH、ΔS、ΔG分别为167.44KJ/ mol、612.71J/mol·K、-18.21KJ/mol(30℃)和-22.50KJ/mol(37℃)。根据分子间相互作用力和热力学参数间的关系,可推断两者的相互作用力主要是疏水作用力。从同步荧光光谱法可知:由于两者之间的反应,BSA的荧光强度显著降低,并推测可卡因和BSA的结合点位于色氨酸残基上。
[1]孙文平,卢延旭.可卡因毒理学研究进展[J].中国药理学通报,Chinese Pharmacological Bulletin, 2004,20(11):1212-1214.
[3]Kramer LD,Locke GE,Ogunyemi A,et al.Cocaine related seizures in adults[J].Am J Drug Alcohol Abuse,1990,16:307-317.
[4]胡艳军,刘义,侯安新.稀土杂多酸盐EuHSiMo10W2O40·25H2O与BSA相互作用的研究[J].化学学报,2004,62(16):1519-1523.
[5]梁彦秋,臧树良,赵雪.头孢他啶与牛血清白蛋白(BSA)的相互作用[J].光谱实验室.2009,26(6):1638-1642.
[6]崔艳,陈建秋,严拯宇.盐酸土霉素与牛血清白蛋白的相互作用研究[J].光谱实验室,2010,27(3):1064-1069.
[7]闫淑莲,樊媛洁,叶玲,等.咪唑斯汀与牛血清白蛋白的作用研究[J].首都医科大学学报,2008,29(3):305-307.
[8]陶清,韩莉,徐金光,等.诺氟沙星与牛血清白蛋白相互作用的拉曼光谱研[J].河南科学,2007,25(3):391-394.
[9]曹福悦,任凤莲,宋鸽,等.秋水仙碱与牛血清白蛋白相互作用的电化学研究[J].分析化学室,2012,31(6):92-95.
[10]吴丽敏,张美玲,娄依依,等.小檗碱与牛血清白蛋白相互作用的核磁共振研究[J].分析化学,2011,39(8):1223-1227.
[11]徐丽繁,王瑞玲,黄振钟,等.4-(4-三氟甲基)苯基-2,6-二(4-氨基苯基)吡啶与BSA相互作用的研究[J].分析试验室,2013,32(7):20-25.
[12]尚永辉,李华,孙家娟.荧光光谱法研究木犀草素、芹菜素或葛根素与牛血清白蛋白的相互作用机理[J].理化检验-化学分册,2009,47(2):186-190.
[13]YANG Manman,XI Xiaoli,YANG Pin.Comparison of Reasonableless of the Fluorescence Quenchrng and Enhancement Equations at Different Temperatures[J].Acta Chim Sin,2006,64(14):1437-1445(in Chinese).
[14]Lakow icz J R,W eberG. Quenchig of Proterin Fluorescence by Oxygen Detection of Structural Fluctuations in Proteins on the N anosecond Time Scale[J]. Biochemistry,1973,12(21):4171-4179.
[15]孙丽莉,陈宁生,夏雪文.噻嗪酮与牛血清白蛋白相互作用的光谱法研究[J].分析科学学报,2011,27(2):223-226.
[16]刘永春,胡之德.药物与蛋白质相互作用的荧光光谱法研究概述[J].宝鸡文理学院学报(自然科学版),2005,25(1):42-49.
[17]ROSS P D,SUBRAMANIAN S.Thermodynamics of protein association reactions:forces contributing to stabiliy[J].Biochemistry,1981,20(11):3096-3102.
[18]DU Xiu-lian,LI Rong-chang,WANG Kui.Study of interaction between apotransferrin and Terbium(III)using synchronours fluorescence spectroscopy.Chin Sci Bull,2001,46(5):394.
Objective To study the interaction of bovine serum albumin(BSA) with cocaine at different temperature and mechanisms underlying. Methods The quenching of fluorescence was determined by measuring fluorescence quenching spectra and synchronous fluorescence spectra of BSA interacted with cocaine.The type of binding foece was estimated according to the themodynamic equation.Results The fluorescence of BSA interacted with cocaine was quenched regularly .The values of binding constants(Ks)to be 1.38×103L/mol (30℃),and6.19×103L/mol (37℃),amounts of binding sites(1),and themodynamic parameters(ΔH: 167.44 KJ/mol,ΔS: 612.71J/mol·K ,ΔG: -18.21 KJ/mol(30℃)and-22.50(37℃))were obtained by analyzing and processing the fluorescence quenching data according to Stern-Volmer equation, Lineweaver-Burk equation and themodynamic equation,respectively.Conclusion It was shown that the fluorescence quenching process of BSA with Cocaine was attributed to static quenching. The force of the reaction was mainly due to hydrophobic action.
Fluoro-spectroscopy; Cocaine;Bovine serum albumin;Interaction
�马红霞.可卡因毒性研究.
1003-8507(2007)11-2091-03
R996
c.
本文系江苏省高等学校大学生实践创新训练计划一般项目立项课题论文(项目编号:201410329023y),并受江苏高校优势学科建设工程项目(PAPD)资助。指导老师:王虹,江苏警官学院高级实验师;王军,江苏警官学院教授。
陈引进(1992—),男,汉族,江苏盐城人,江苏警官学院刑事科学技术系法化学专业在校生;魏富凯(1994—),男,汉族,江苏镇江人,江苏警官学院刑事科学技术系法化学专业在校生;张宇峰(1994—),男,汉族,江苏无锡人,江苏警官学院刑事科学技术系法化学专业在校生;吴德孝(1992—),男,汉族,江苏徐州人,江苏警官学院刑事科学技术系法化学专业在校生。

