基于纳米金生成的过氧化氢快速检测方法
彭池方,段小慧,谢正军,李炎
(江南大学食品学院,江苏无锡214122)
基于纳米金生成的过氧化氢快速检测方法
彭池方,段小慧,谢正军,李炎
(江南大学食品学院,江苏无锡214122)
建立了一种基于生成胶体金的光学信号快速检测过氧化氢(H2O2)的方法。在4-羟乙基哌嗪乙磺酸(HEPES)、柠檬酸钠和聚乙烯吡咯烷酮(PVP)的协同作用下,H2O2可还原氯金酸,并且在不同H2O2浓度下生成不同颜色的纳米金。通过肉眼观察生成纳米金的颜色,可以定性检测H2O2,其检测灵敏度可达到0.8 μmol/L。采用分光光度法分析,其检测灵敏度可达到0.06 μmol/ L,检测线性范围为0.2~1 000 μmol/L。对牛百叶中添加10,25和100 μg/g的H2O2,经过简单的样品处理,其检测回收率可达到75.2%~82.5%,相对偏差小于13%。通过肉眼观察,对牛百叶中过氧化氢检测限可达到25 μg/g。因此,该方法具有灵敏度高、成本低、快速简便等优点,可用于各类食品或生物基质中H2O2的检测。
过氧化氢;食品;纳米金
过氧化氢溶液俗称双氧水(H2O2),为无色无味的液体,因其具有高效杀菌、氧化漂白的作用。H2O2进入人体后毒副作用极大,它会直接刺激粘膜组织,还会通过化学反应导致人体细胞癌变,加速人体的衰老或诱发心血管疾病等[1-3]。在食品生产加工过程中存在超量或非法添加H2O2,以实现食品防腐和增加食品的色悦感,因此,建立准确、灵敏、快速的H2O2检测技术对于食品安全具有重要意义。迄今为止,已建立的H2O2检测方法主要包括碘量法、分光光度法、高效液相色谱法、化学发光法、荧光光度法等[4-7]。以上这些方法还存在一些缺点,如灵敏度不高,实验仪器要求较高,操作较复杂等。
纳米材料所具有的氧化还原效应、发光效应、催化效应等,比其他方法更快速、更灵敏,在食品检测分析应用中已显现出其独特的优越性[8-11]。最近,Molly M.Stevens等[12]人利用H2O2还原氯金酸,在2-(N-吗啡啉)乙磺酸(MES)缓冲溶液的作用下,形成不同颜色的纳米金,通过肉眼即可检测H2O2,检测灵敏度为25 μmol/L,具有方便灵敏,成本低等优点,但该体系应用于复杂食品基质的检测,灵敏度需进一步提高。研究发现:在4-羟乙基哌嗪乙磺酸(HEPES)、柠檬酸钠和聚乙烯吡咯烷酮(PVP)的协同作用下,H2O2可以还原氯金酸,所产生纳米金产物的光吸收强度和颜色与H2O2浓度直接相关。基于以上发现,作者构建了一种新的H2O2快速检测方法,并将其应用于食品中残留H2O2的检测。
1 材料与方法
1.1材料与试剂
氯金酸(HAuCl4)、柠檬酸钠:购自Sigma-Aldrich公司;聚乙烯吡咯烷酮(PVP,平均相对分子质量40 000)、4-羟乙基哌嗪乙磺酸(HEPES)、三羟甲基氨基甲烷(Tris)、PEG(相对分子质量20 000):购自阿拉丁试剂公司;过氧化氢及其他试剂:购自中国医药集团上海化学试剂总公司;其余试剂均为分析纯。
1.2仪器与设备
Biotek Eon微孔板分光光度计:美国Biotek公司产品;透射电镜(JEM-2100):日本电子株式会社产品;Eppendorf可调式移液器:美国艾本德产品;恒温振荡器:无锡沃信仪器有限公司产品;电子天平、数显pH计:梅特勒-托利多仪器(上海)有限公司产品;电热恒温水浴锅:上海精宏实验设备有限公司产品;XW-80A微型旋涡混合仪:金坛市盛蓝仪器制造有限公司产品。
1.3方法
1.3.1缓冲溶液体系的筛选移取6 μL 10.0 mmol/L氯金酸溶液,6 μL 10.0 mmol/L柠檬酸钠溶液,以及88 μL 1.0 mmol/L的磷酸缓冲液,Tris或HEPES缓冲溶液(pH 6.5)分别加入到微孔板中;另一组缓冲液也为HEPES缓冲溶液(pH 6.5),但不含有柠檬酸钠;每组再加入100 μL不同浓度的H2O2溶液(400.0,200.0,50.0,0 μmol/L),振荡反应10 min后,拍照。
1.3.2大分子聚合物的筛选及浓度优化取6 μL 10.0 mmol/L的氯金酸和柠檬酸钠,5 μL PVP或PEG,以及83 μL 1.0 mmol/L HEPES溶液到96微孔板中,再加入100 μL的H2O2溶液(浓度分别为400.0,200.0,80.0,20.0,5.0,0 μmol/L),将不添加大分子聚合物的反应孔作为空白组,振荡反应10 min后,观察显色结果,通过酶标仪检测540 nm处光吸收强度。选择代表性反应液,滴加于铜网碳支持膜上,由透射电镜在200 kv电压下获得。
1.3.3反应的稳定性依照1.3.2中操作,添加5 μL质量分数2%PVP,加入H2O2的浓度分别为800.0,200.0,50.0,12.5,3.12,0 μmol/L,振荡反应10 min后测A540nm,隔5 min测一次,第30 min后隔10 min测一次,至70 min,观察反应时间对H2O2显色反应的影响。
1.3.4H2O2检测的标准曲线依照1.3.2中步骤操作,加入浓度分别为800.0,200.0,50.0,12.5,3.12,0.8,0.2,0 μmol/L的H2O2,振荡反应10 min后,拍照,并通过酶标仪扫描紫外吸收光谱。
1.3.5H2O2检测方法的验证称取5.0 g牛百叶,剪碎,放入三角烧杯中,添加100 μL H2O2,使其浓度分别为100,25.0,10.0 μg/g。加入50.0 mL水,振荡5 min后,用滤纸过滤,将滤液再稀释4倍待用。取100 μL上述牛百叶样品液液,加入氯金酸-HEPES-柠檬酸钠-PVP体系,振荡反应10 min后,检测540 nm处光吸收强度。
2 结果与分析
2.1缓冲溶液对反应显色的影响
在含有柠檬酸钠的常见缓冲溶液(PBS或Tris)中,过氧化氢不能还原,如图1中的A、B微孔板条所示。而在HEPES缓冲溶中(图1中D微孔板条),反应溶液均呈现红色,表明HEPES缓冲溶液对氯金酸具有较强的还原作用,但不同浓度的H2O2对反应液的颜色无明显影响。在HEPES缓冲溶液添加了柠檬酸钠后(图1中微孔板条E),可以发现,随着H2O2浓度从高到低,颜色由蓝紫色到深蓝色再到浅蓝色,存在颜色变化,这说明柠檬酸钠可以调节HEPES缓冲溶液对氯金酸具有较强的还原作用。值得注意的是,在柠檬酸钠存在下,可以观察到H2O2对氯金酸具有一定的还原作用(图1中微孔板条C)。以上结果表明,在HEPES和柠檬酸钠协同作用下,依靠H2O2对氯金酸的还原作用实现H2O2的检测具有可行性。
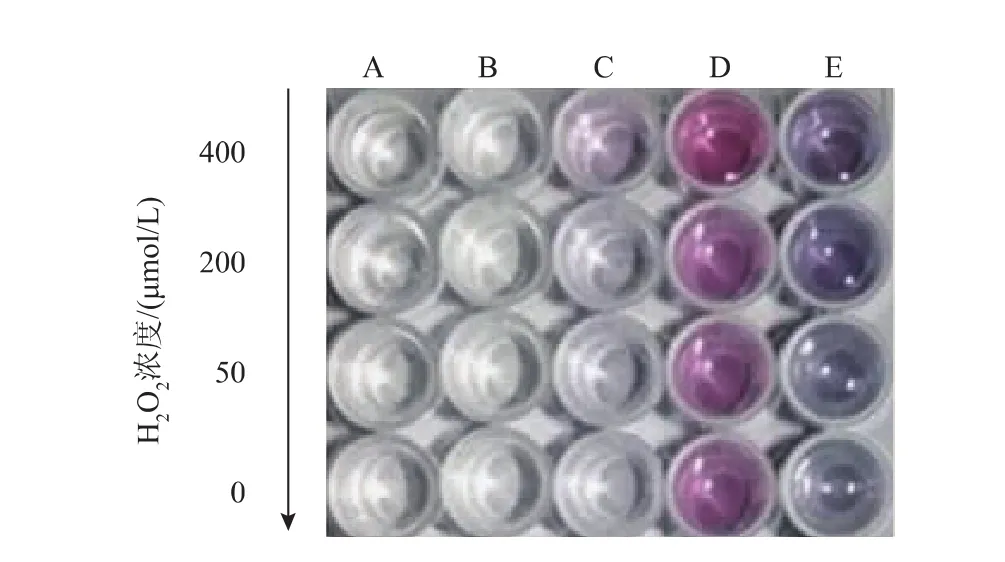
图1 不同缓冲溶液体系的反应显色照片Fig.1Photographys of coloring reaction of different buffer solution
2.2大分子聚合物对反应显色的影响
一些大分子聚合物,如聚乙烯醇、聚乙烯吡咯烷酮等,在纳米粒子生成过程中具有调节纳米粒子形态、稳定反应体系等作用[13]。在上述氯金酸-HEPES-柠檬酸钠-H2O2体系中尝试添加聚乙烯醇或聚乙烯吡咯烷酮,以期进一步改善该反应对H2O2的特异性。如图2所示,与没有添加大分子的反应体系相比,加入5 μL的体积分数1%或2%的PEG后,后,其吸光值明显提高,背景信号(无H2O2时)也较高,并且H2O2浓度与吸光值的线性关系不佳。有趣的是,添加了体积分数2%PVP后,反应体系的背景值明显降低(肉眼可分辨),并且H2O2浓度对数与吸光值信号呈良好的线性关系。因此,后续试验中选择PVP作为添加物。通过比较体积分数0.5%~4.0%的PVP,如图3所示:发现添加PVP的体积分数为2%时,所得到的光吸收信号最强。
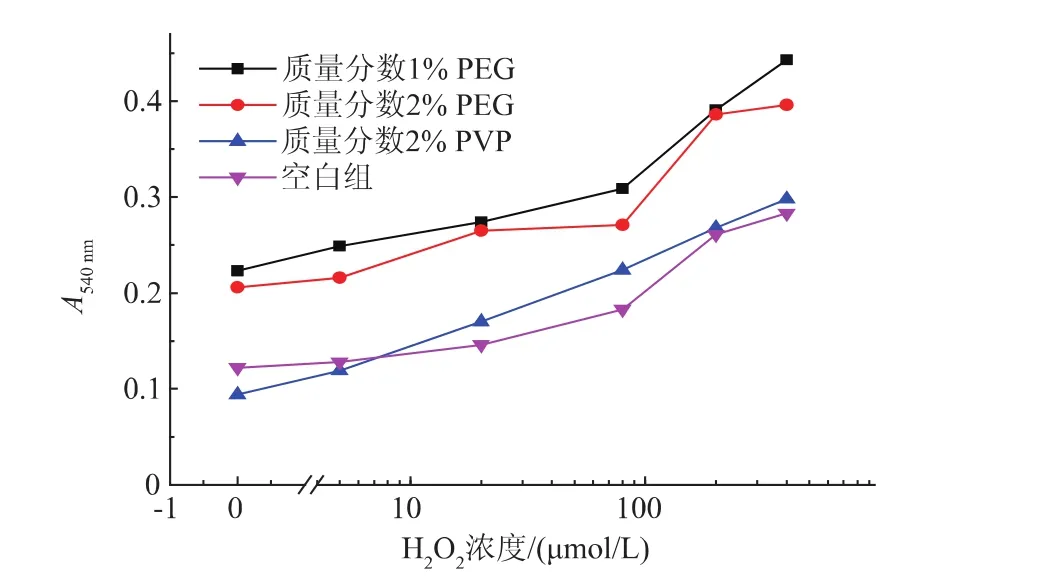
图2 PVP、PEG对反应体系吸光值的影响Fig.2PVP and PEG on the influence of UV absorbance of the reaction system
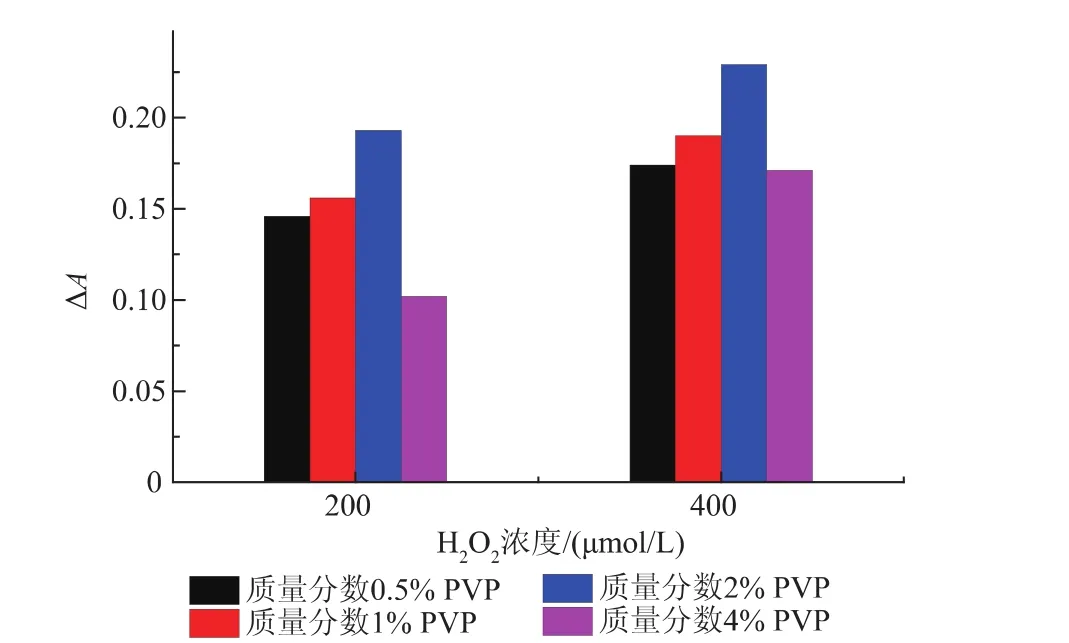
图3 不同质量分数的PVP对反应体系吸光值的影响Fig.3Different concentrations of PVP on the influence of UV absorbance of the reaction system
由以上结果,推测该反应原理如下:在柠檬酸钠和PVP的作用下,HEPES还原氯金酸生成金纳米种子,加入H2O2之后,H2O2还原氯金酸进一步促进金纳米种子生长,在低浓度H2O2时,形成纳米金聚集物,溶液颜色呈蓝色;在高浓度H2O2时,纳米金聚集程度小,溶液颜色呈红色(图4)。
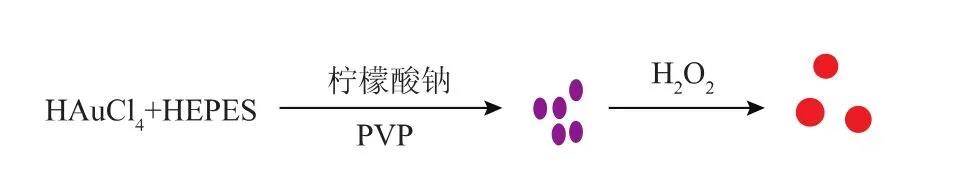
图4 过氧化氢还原氯金酸反应原理图Fig.4Principle diagram of hydrogen peroxide reducing chloroauric acid
2.3反应体系的稳定性
氯金酸-H2O2反应系统的稳定性高,有利于降低H2O2检测的误差。由下图5可看出,在初始15 min内反应较快,并且不同H2O2浓度之间的A540nm差值较明显。在反应进行10 min后,零孔的光吸收值低于0.1,为无色,此时背景信号最低,检测灵敏度最高。在反应30 min内,仍可以区分3.1 μmol/L的H2O2。随着时间的逐渐延长,12.5 μmol/L和3.1 μmol/L的H2O2信号重叠。以上结果说明,在反应10~30 min期间,对H2O2的灵敏度没有明显改变,这利于H2O2的检测应用。
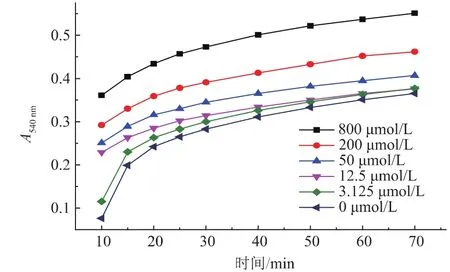
图5 反应时间对反应体系吸光值的影响Fig.5Reaction time on the influence of UV absorbance of the reaction system
2.4检测H2O2的标准曲线
如图6(a)所示,随着H2O2浓度的增加,氯金酸-HEPES-柠檬酸钠-H2O2反应溶液的颜色发生有规律的变化,由浅蓝、深蓝到紫红色的颜色变化。采用肉眼观察该反应,可以清楚地分辨0.8 μmol/L的H2O2。此方法与MES缓冲液中纳米金生成检测的方法相比H2O2,灵敏度提高了25倍[12]。图6(b)TEM照片中的纳米金分散性较好,纳米粒子之间没有大量聚集,对应的溶液颜色为紫红色;而图6(c)的纳米金大量聚集,这与通常纳米金的聚集呈蓝色,分散时呈红色的特性相一致。分析不同H2O2浓度下生成纳米金溶液的吸收光谱(图6(d))发现,无H2O2时,反应溶液无吸收峰;H2O2为0.2 μmol/L时,在570 nm处产生明显吸收峰;随着H2O2浓度的增加,纳米金溶液的吸收峰逐渐蓝移,在H2O2浓度为增加到800 μmol/L时,其共振吸收峰为540 nm。以上纳米金溶液光谱的变化与其颜色的变化相一致。
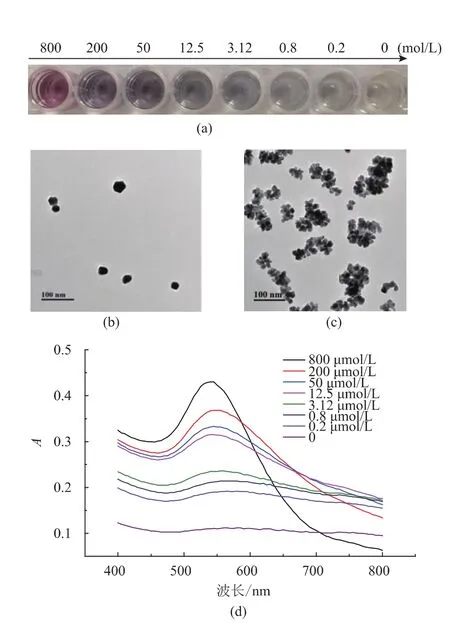
图6 不同浓度的过氧化氢促使形成不同颜色的金纳米粒子Fig.6Generation of nanoparticle solutions with different colours depends on the concentration of hydrogen peroxide
如图7所示,可见在0.2~800 μmol/L范围内检测H2O2,以上反应体系呈对数线性关系。对H2O2的检测灵敏度可以达到0.06 μmol/L(信噪比>3)。上述H2O2检测方法的灵敏度高于辣根过氧化物酶和磷酸铜杂化催化[14]、氧化铈纳米粒子[15]和催化性纳米银[16]等纳米传感方法;与催化性普鲁士蓝纳米传感的H2O2检测方法的灵敏度相当[14-17]。上述建立的H2O2检测方法与这些H2O2纳米传感方法相比,不需要预先精细调控制备高性能的纳米粒子,因此,H2O2检测方法具有高测灵敏度和简单等优点。
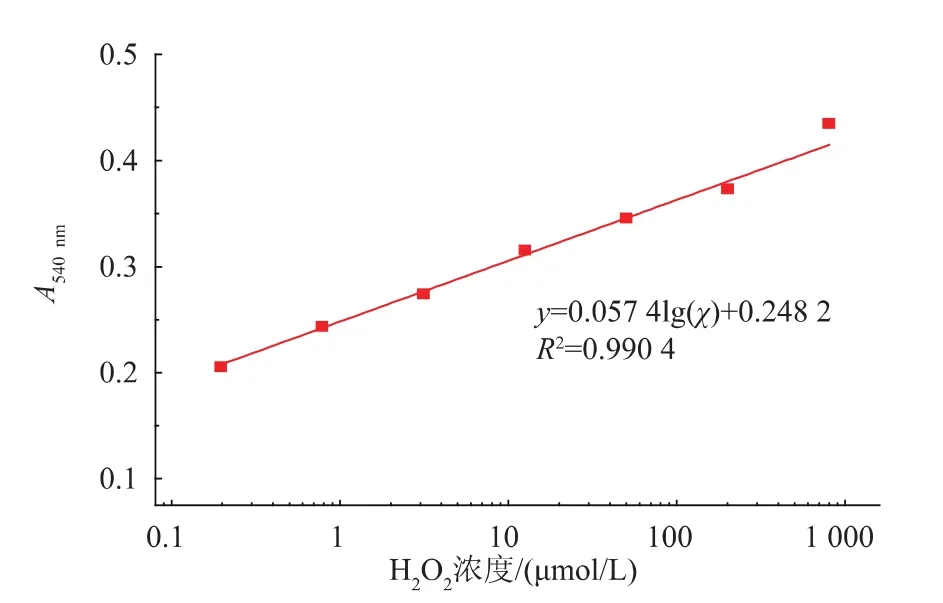
图7 过氧化氢标准曲线Fig.7Standard curve of hydrogen peroxide
2.5牛百叶样品检测
牛百叶是餐桌上的美味佳肴,受到许多消费者的喜爱。牛百叶本身略带黄色,但经过氧化氢处理后可变得洁白,因此,检测牛百叶中的过氧化氢对保障牛百叶的安全食用具有实际的价值[18]。对牛百叶样品经过简单的处理,提取和稀释提取液后,检测其中的H2O2,结果如表1所示。对牛百叶中添加10,25和100 μg/g的H2O2,其检测回收率可达到75.2%~82.5%,检测相对偏差小于13%。检测无添加H2O2的牛百叶样品,其质量分数为(0.8±0.12)μg/g。定义该方法对样品的检测限空白样品检测值加上3倍标准偏差。可得到该方法对牛百叶中过氧化氢的最低检测限为1.2 μg/g。考虑到该方法所用的的样品提取液没有经过复杂的预处理,可以认为该检测方法具有较高的准确度和灵敏度。采用肉眼观察,可见添加质量分数为100和25.0 μg/g的样品,最终呈明显淡蓝色;而添加质量分数为10.0 μg/g的样品,肉眼难以区分其与空白样品的差别。因此,该方法肉眼检测牛百叶中过氧化氢的灵敏度可达到25.0 μg/g。
3 结语
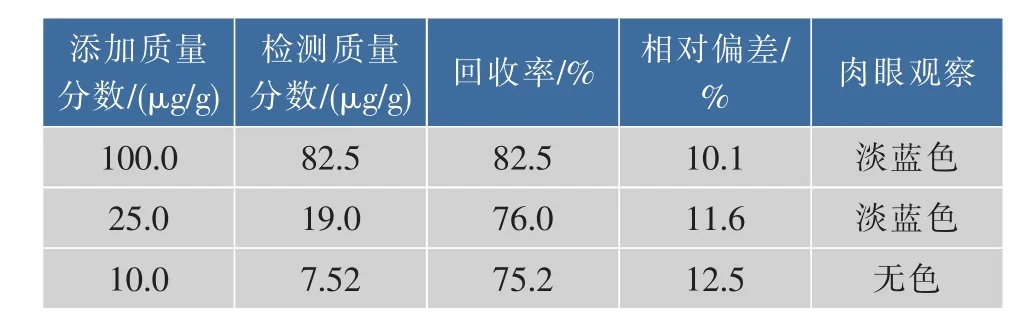
表1 牛百叶样品中H2O2的检测回收率(n=3)Table 1Recovery of hydrogen peroxide in samples(n=3)
在HEPES,柠檬酸钠和大分子PVP的协同作用下,H2O2可以还原氯金酸形成不同颜色的金纳米粒子。基于上述原理建立了灵敏度的H2O2检测方法,该H2O2检测方法可采用肉眼观察结果,灵敏度可达到0.8 μmol/L;采用分光光度法分析,灵敏度可达到0.06 μmol/L。以牛百叶样品验证,结果表明该方法准确性高、样品处理方法简单。因此,该方法有望应用于各类食品或生物基质中H2O2的检测。
[1]Abbas ME,LUO W,ZHU LH,et al.Fluorometric determination of hydrogen peroxide in milk by using a Fenton reaction system[J].Food Chemistry,2010(120):327-331.
[2]王晓娜,徐晓敏,邱理红,等.羟基红花黄色素A对过氧化氢致L02细胞谷胱甘肽氧化的影响[J].食品科学,2013,34(23):317-320.
WANG Xiaona,XU Xiaomin,QIU Lihong,et al.Effect of hydroxysafflor yellow a on the Oxidation of intracellular glutathione Induced by hydrogen peroxide in L02 cells[J].Food Science,2013,34(23):317-320.(in Chinese)
[3]张丽霞,周剑忠,黄开红,等.黑莓花色苷对过氧化氢诱导血管内皮细胞损伤的保护作用[J].食品科学,2013,34(13):257-261.
ZHANG Lixia,ZHOU Jianzhong,HUANG Kaihong,et al.Protective effect of blackberry anthocyanins against hydrogen peroxide Induced damage in human umbilical vein endothelial cells[J].Food Science,2013,34(13):257-261.(in Chinese)
[4]孙佳,毛燕,李刚,张丽.应用亲水作用液相色谱法测定食品中过氧化氢[J].食品安全质量检测学报,2013,4(6):1873-1879.
SUN Jia,MAO Yan,LI Gang,ZHANG Li.Application of hydrophilic interaction liquid chromatography to determine hydrogen peroxide in food[J].Journal of Food Safety and Quality,2013,4(6):1873-1879.(in Chinese)
[5]迟晓妮,李金焕,等.非酶反应体系过氧化氢含量荧光测定方法研究及分析应用[J].山东农业大学学报:自然科学版,2005,36(3):377-380.CHI Xiaoni,LI Jinhuan,et al.Study no the fluorometric method for quantitative determination of hydrogen peroxide in a non-enzymatic system and its analytical application[J].Journal of Shandong Agricultrual University:Natural Science,2005,36(3):377-380.(in Chinese)
[6]李晓霞,申丽华,漆红兰.毛细管固定过氧化物酶流动注射化学发光法测定过氧化氢的研究[J].分析检测学报,2008,27(4):419-422. LI Xiaoxia,SHEN Lihua,QI Hong1an.Determination of hydrogen peroxide on a peroxidase-immobilized capillary column by flow-injection chemiluminescence[J].Journal of Instrumental Analysis,2008,27(4):419-422.(in Chinese)
[7]Hitomi Y,Takeyasu T,et al.Detection of enzymatically generated hydrogen peroxide by metal-based fluorescent probe[J]. Analytical Chemistry,2011(83):9213-9216.
[8]WANG F,LIU X Q,et al.Cysteine-mediated aggregation of Au nanoparticles-H2O2sensor and oxidase-based biosensors[J]. American Chemical Society(ACS NANO),2013,7(8):7278-7286.
[9]王文凤,吴世嘉,马小媛,等.基于纳米金标记-适配体识别的伏马菌素B1检测新方法[J].食品与生物技术学报,2013,32(5):501-508.
WANG Wenfeng,WU Shijia,MA Xiaoyuan,et al.Novel Methods for Fumonisins B1 Detection Based on AuNPs Labeling and Aptamer Recognition[J].Journal of Food Science and Biotechnology,2013,32(5):501-508.(in Chinese)
[10]Parnklang T,Lertvachirapaiboon C,et al.H2O2-triggered shape transformation of silver nanospheres to nanoprisms with controllable longitudinal LSPR wavelengths[J].RSC Advances,2013(3):12886-12894.
[11]易静,吴绒,南俊民,等.Pt-Pd/UCNTs无酶生物传感器的研制与葡萄糖检测的应用[J].食品与生物技术学报,2012,31(4):385-390.
YI Jing,WU Rong,NAN Junmin,et al.Fabrication and its glucose detection application of a nonenzymatic Pt-Pd/UCNTs biosensor[J].Journal of Food Science and Biotechnology,2012,31(4):385-390.(in Chinese)
[12]De la Rica R,Stevens M M.Plasmonic ELISA for the ultrasensitive detection of disease biomarkers with the naked eye[J].Nature Nanotechnology,2012,7(12):821-824.
[13]Abdelghany A M,Abdelrazek E M,Rashad D S.Impact of in situ preparation of CdS filled PVP nano-composite[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2014,130:302-308.
[14]LIN Z,XIAO Y,YIN Y Q,et al.Facile synthesis of enzyme-inorganic hybrid nanoflowers and its application as a colorimetric platform for visual detection of hydrogen peroxide and phenol[J].ACS Appl Mater Interfaces,2014,6(13):10775-10782.
[15]Gaynor J D,Karakoti A S,Inerbaev T,et al.Enzyme-free detection of hydrogen peroxide from cerium oxide nanoparticles immobilized on poly(4-vinylpyridine)self-assembled monolayers[J].J Mater Chem B,2013,1:3443-3450.
[16]WANG G L,ZHU X Y,JIAO H J,et al.Ultrasensitive and dual functional colorimetric sensors for mercury(II)ions and hydrogen peroxide based on catalytic reduction property of silver nanoparticles[J].Biosensors and Bioelectronics,2012,31(1):337-342.
[17]ZHANG W M,M A D,DU J X.Prussian blue nanoparticles as peroxidase mimetics for sensitive colorimetric detection of hydrogen peroxide and glucose[J].Talanta,2014,120:362-367.
[18]徐晨,李洁,等.水发牛百叶中过氧化氢残留及其影响因素研究[J].上海预防医学杂志,2006,18(4):189-190.
XU Chen,LI Jie,et al.A research on hydrogenperoxide residua in waterishlogged tripe and its influencing factors[J].Shanghai Journal of Preventive Medicine,2006,18(4):189-190.(in Chinese)
Rapid Detection of Hydrogen Peroxide Based on the Generation of Gold Nanoparticles
PENG Chifang,DUAN Xiaohui,XIE Zhengjun,LI Yan
(School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
A rapid detection method of hydrogen peroxide(H2O2)was established,which was based on the optical signal of gold nanoparticles(AuNPs)generated.With the synergetic effect of 4-(2-Hydroxyethyl)-1-piperazineethanesulfonic acid(HEPES),sodium citrate and polyvinylpyrrolidone(PVP),H2O2reduced chloroauric acid and AuNPs of different colors were generated with different concentrations of H2O2.H2O2could thus be qualitatively detected by the naked eyes,and the sensitivity of 0.8 μmol/L was reached.By the spectrophotometry,0.06 μmol/L of H2O2could be detected with the linear range of 0.2~1 000 μmol/L.Using the method,the beef omasum samples spiked with 10,25 and 100 μg/g H2O2were analyzed with the detection recoveries of 75.2%~82.5% and relative deviation of less than 13%.Moreover,by the naked eyes 25 μg/g of H2O2in beef omasum could be detected.The developed method is therefore highly sensitive,low cost,convenient and rapid and has high application potential in the H2O2detection for various foods and biologicalsamples.
hydrogen peroxide,food,gold nanoparticles
TS 207.3
A
1673—1689(2015)10—1027—06
2014-09-16
国家自然科学基金项目(31371767);国家“十二五”科技支撑计划项目(2012BAK08B01);江苏省自然科学基金项目(BK20141108)。
彭池方(1975—),男,湖北荆州人,工学博士,副教授,硕士研究生导师,主要从事食品安全检测与控制研究。
E-mail:pcf@jiangnan.edu.cn

