对虾白斑综合征病毒表面抗原基因免疫保护性的研究
张娜 刘骁
(湛江出入境检验检疫局 广东湛江 524000)
对虾白斑综合征病毒表面抗原基因免疫保护性的研究
张娜 刘骁
(湛江出入境检验检疫局 广东湛江 524000)
将对虾白斑综合征病毒(White Spot Syndrome Virus,WSSV)的VP19、VP28基因融合克隆入pVAX1.0真核表达载体制备成多价DNA疫苗,并用构建的DNA疫苗制备成饲料免疫实验对虾,用RT-PCR检测DNA疫苗在对虾体内的表达,同时比较构建的多价DNA疫苗与VP19、VP28单价DNA疫苗对抗WSSV的保护率。结果显示构建的DNA疫苗有抗WSSV免疫保护性,且pVAX1.0-VP19-VP28多价DNA疫苗保护率高于单价疫苗。
南美白对虾;白斑综合征病毒;表面抗原;免疫活性
1 前言
南美白对虾(Litopenaeus vannamei)是当今世界养殖产量最高的三大虾类之一,随着养殖量的大量增加、养殖品种的日益增多和养殖规模的不断扩大,各种对虾疫病也日益增多,特别是病毒病已成为阻碍对虾养殖业发展的主要因素。白斑综合征(White Spot Syndrome)是对养殖对虾危害最大的病毒性疾病之一[1],其具有致病性强、危害性大、地域分布和宿主范围广泛等特点,是世界动物卫生组织(OIE)、联合国粮农组织(FAO)及亚太地区水产养殖发展网络中心(NACA)规定需要报告的重要水生动物疾病。自1993年首次暴发性流行以来,至今已造成巨大的经济损失,同时也给海洋生态平衡带来了很大的威胁。
近年的研究表明,对虾存在类免疫机制,尽管不能够产生抗体,没有免疫记忆,但先天性免疫系统同样能在被感染后产生有效而快速的免疫反应,从而有效保护它们免受微生物的侵袭[2]。
本研究利用分子生物学技术将对虾白斑综合征病毒(White Spot Syndrome Virus,WSSV)的VP28、VP19基因串联克隆为融合基因,再克隆至pVAX1.0真核表达载体,制备多价基因DNA疫苗,并检测疫苗在对虾体内的表达情况和抗WSSV的保护效果,为对虾抗WSSV DNA疫苗的进一步研究奠定了基础。
2 材料与方法
2.1材料
2.1.1实验动物
南美白对虾喂养在长100cm、高50cm、宽30cm的水槽中,用不含有任合抗病毒药物的饲料饲养7d以上备用,随机挑取3尾虾用PCR方法进行病毒排除检测。
2.1.2质粒与菌株
pMD18-T载体:大连宝生物(TaKaRa)工程有限公司产品;pET-28a(+)质粒、pVAX1.0载体质粒:本实验室购买;大肠杆菌BL21:本实验室保存。
2.1.3工具酶与主要试剂
rTaq酶、DL2000Marker、限制性内切酶BamHⅠ、EcoRⅠ、XhoⅠ、T4-DNA连接酶、胶回收试剂盒:均购自大连宝生物(TaKaRa)公司。
2.1.4主要仪器设备
PCR扩增仪(PC48HY-8):德国Biometra公司;凝胶成像仪(BAD Digital):德国Biometra公司;高速冷冻离心机:Eppendorf centrifuge 5417R,转速≥13000rpm;电泳仪(DYY-8C):北京市六一仪器厂。
2.2方法
2.2.1设计WSSV VP19和VP28扩增引物
依据GenBank上发表的VP19、VP28基因序列,设计引物。VP19上游引物:5-GGATCCATGGCCACC ACGACTAACAC-3(划线处为BamH酶切位点);下游引物:5-GAATTCTTACTGCCTC CTCTTGGGGT-3(划线处为EcoRⅠ酶切位点)。VP28上游引物:5-AGAGAATTCATGGATCTTTCTTTCAC-3(划线处为EcoRⅠ酶切位点);下游引物:5-CACAAGCTTTTACTCGGTCTCAGTGC-3(划线处为XhoⅠ酶切位点)。
2.2.2WSSV VP19和VP28基因的PCR扩增
使用QIAGEN试剂盒提取病料虾组织DNA。PCR反应体系为:10×buffer 2.5 μL,引物(40 pmol)各1.5 μL,dNTP 2 μL,Taq酶0.5 μL,模板4 μL,加水至25 μL。反应程序:94℃4min,94℃1min,55℃1 min,72℃2 min;32循环,72℃10 min。
2.2.3WSSV VP19基因和VP28基因片段的克隆与序列分析
将PCR产物目的条带进行回收和纯化,分别与pMD18-T载体连接并转化受体菌E.coli DH5a进行克隆,分别进行酶切鉴定;送上海英骏生物技术有限公司测序,分别与GenBank进行同源性分析。
2.2.4DNA疫苗pVAX1.0-VP19和pVAX1.0-VP28的构建
BamHⅠ、EcoRⅠ双酶切pMD-18-T-VP19和pVAX1.0,EcoRⅠ、XhoⅠ双酶切pMD18-T-VP28和pVAX1.0,分别回收VP19、pVAX1.0片段和VP28、pVAX1.0片段连接构建pVAX1.0-VP19和pVAX1.0-VP28重组质粒。
2.2.5多价DNA疫苗pVAX1.0-VP19-VP28的构建
重新设计VP19引物(上游含有BamHⅠ酶切位点,下游含有EcoRⅠ酶切位点,去除终止密码子),以pMD18-T-VP19为模板,PCR扩增VP19-2基因,将它克隆到pMD18-T载体,记为pMD18-TVP192。用BamHⅠ和EcoRⅠ双酶切pMD18-TVP192和pVAX1.0,回收各片段,连接构建pVAX1.0-VP192质粒;用EcoRⅠ和XhoⅠ双酶切pVAX1.0-VP192和pMD18-T-VP28,连接构建pVAX1.0-VP19-VP28质粒。
2.2.6DNA疫苗在虾体内表达情况的检测
取3个构建好的重组质粒保存的菌种分别进行培养得到菌液,将得到的菌液3L 6000g离心10min,得到菌体;以反复冻融法灭活菌体,拌入饲料中,包裹蛋清,阴干,分装。试验分为4组,分别为3组疫苗组和1组空白对照组,每组10尾虾,分别在免疫10 d和20 d取3尾虾虾鳃,用RT-PCR法分别扩增VP28和VP19基因。
2.2.7多价DNA疫苗免疫保护性实验
试验共分为5组,每组20尾虾,随机分组,淘汰体重过低或过高的虾,平均体重约10±0.5 g。各组分别为非感染非免疫对照组、感染非免疫对照组、pVAX1.0-VP19组、pVAX1.0-VP28组、pVAX1.0-VP19-VP28组。分别投喂制备的各组饵料,每日3次,每次4 g。在饲料投喂20 d后,每只虾分别口服1 mL病毒液(经对虾传代3次的WSSV[3],经过病毒收集)进行WSSV攻毒,每天观察虾的情况。相对保护率(%)=(1-实验组死亡率/对照组死亡率)×100%。
3 结果
3.1VP19基因、VP28基因PCR扩增结果
以病料虾组织DNA为模板进行PCR扩增,产物经琼脂糖凝胶电泳,结果显示约375 bp和633 bp的特异性目的条带,与预计大小一致(见图1)。
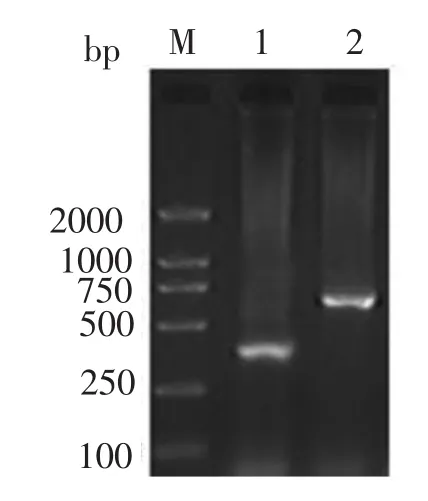
图1 VP19基因、VP28基因的RT-PCR产物电泳分析
3.2VP19基因和VP28基因片段克隆酶切鉴定
VP19基因和VP28基因PCR产物分别连接PMD18-T克隆载体,经双酶切后,结果显示片断与预计大小一致(见图2)。所得VP19基因序列开放阅读框长375 bp,与GenBank:DQ681071.1核苷酸同源性99.2%,氨基酸同源性100%;所得VP28基因序列开放阅读框长633 bp,与GenBank:DQ979320.1核苷酸同源性100%,氨基酸同源性100%。
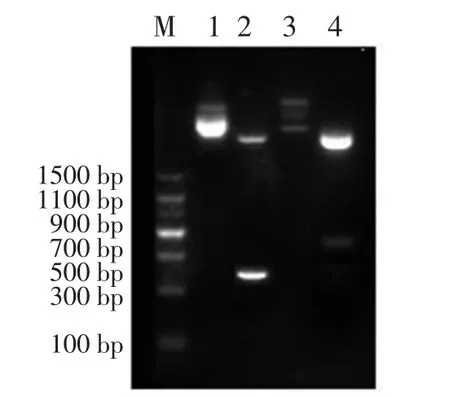
图2 PMD18-T-VP19、PMD18-T-VP28重组质粒、双酶切鉴定
3.3DNA疫苗pVAX1.0-VP19、pVAX1.0-VP28、pVAX1.0-VP19-VP28的构建
用内切酶BamHⅠ、EcoRⅠ、XhoⅠ分别双酶切构建好的重组质粒,电泳显示大小分别与VP19基因、VP28基因相一致的DNA片段(见图3)。
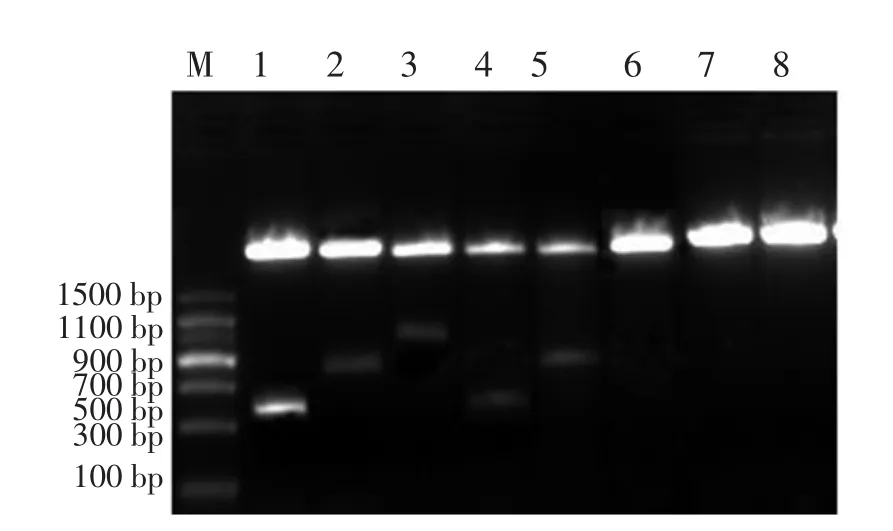
图3 PVAX1.0-VP19、PVAX1.0-VP28、pVAX1.0-VP19-VP28质粒双酶切鉴定
3.4DNA疫苗在虾体内表达情况的检测
构建的3组重组质粒分别免疫对虾,用RTPCR法分别扩增出与VP28基因和VP19基因条带,非免疫组未能检测到。结果表明VP19、VP28基因重组质粒和与两个基因融合的重组质粒均能在口服免疫的对虾虾鳃中转录出mRNA(见图4)。
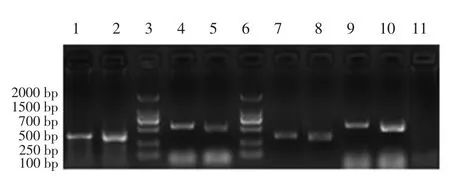
图4 RT-PCR法检测DNA疫苗在对虾体内的表达
3.5DNA疫苗免疫南美白对虾后抗WSSV的相对保护率
DNA疫苗免疫南美白对虾后抗WSSV的试验结果见表1。
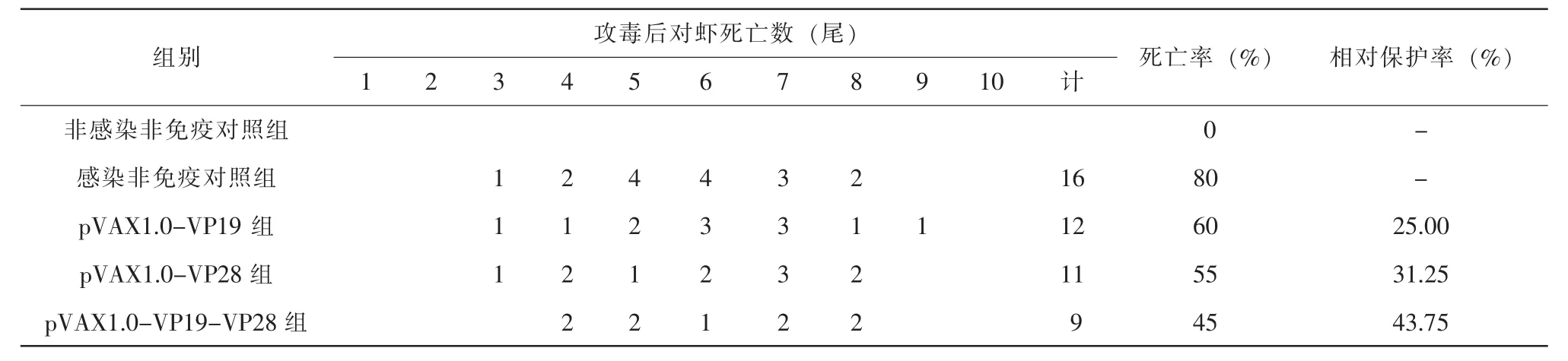
表1 DNA疫苗免疫南美白对虾后抗WSSV的死亡率和相对保护率
结果显示:非感染非免疫对照组对虾无死亡,感染非免疫对照组死亡率为80%;pVAX1.0-VP19组死亡率为60%,相对保护率为25%;pVAX1.0-VP28组死亡率为55%,相对保护率为31.25%;pVAX1.0-VP19-VP28组死亡率为45%,相对保护率为43.75%。结果还显示:对虾在口服疫苗免疫后攻毒第5天出现高死亡率,在第8天死亡趋于稳定;pVAX1.0-VP19-VP28疫苗组死亡率低于pVAX1.0-VP19组和pVAX1.0-VP28组。
经过统计学方差分析,各组间差异均非常显著(P<0.05)。
4 讨论
目前为止,国内还没有生产南美白对虾SPF种苗,所以对虾养殖企业主要依赖从国外引进原种。随着对虾养殖量的增加,每年种虾需求也在不断增加。在进境亲虾的检验检疫工作中发现,进境南美白对虾(亲虾)具有抗病不稳定遗传的特征,育成的第一代商品虾苗具有良好的抗病能力,但是第二代虾苗抗病能力差,虾苗大小不一,质量下降。所以企业在一代商品苗后需要重新引进种苗,此项技术壁垒给我国对虾养殖业造成了巨大的经济压力。因此,从免疫抗原基因入手,研究对虾抗病毒作用机制对于对虾疫病防控非常重要。
国内外已有很多实验室采用将一部分虾病毒的功能性基因通过pVAX1或pcDNA3.1载体,以肌肉注射的方式注射到虾体内,从而在体内表达出蛋白,取得了很好的试验效果[4,5]。张敬艳等[6]通过VP28重组核酸疫苗肌肉注射和饲料添加的形式对凡纳缤对虾抗WSSV感染的保护效果,实验证明在注射组中VP28的相对保护率为22.4%,饲料免疫组中VP28的相对保护率可达到36.84%,进一步研究表明虾STAT基因、Dicer基因、Argonaute基因都有明显升高。魏国强[7]将含有VP28基因的重组杆状病毒感染家蚕蛹,配制成药饵口服免疫鳌虾,结果表明该疫苗可以激活鳌虾血清中抗菌活力、溶菌活力、酚氧化酶活性等活性,说明VP28囊膜蛋白具有增强虾体免疫功能的作用。
5 结论
(1)DNA疫苗经对虾口服免疫10 d和20 d后均可以在虾鳃中检测到VP28基因和VP19基因的表达,且20 d后的表达量高于10 d的表达量。说明口服免疫可以在对虾体内进行表达,口服疫苗的时间较长可以有效提高其免疫保护性,更详细的结果还需要进一步研究。
(2)构建的DNA疫苗经过口服免疫对虾均可以使虾具有抗WSSV感染保护效果,其中pVAX1.0-VP19-VP28多价疫苗的保护性效果比单价疫苗效果好。说明WSSV病毒表面抗原VP19和VP28基因具有有效的免疫保护性,但其作用位点和引发对虾体内相应免疫因子的表达等问题还需要进一步的深入研究。
[1]Li ghmer D V.A handbook of shrimp pathology and diagnostic procedures for disease of cultured penaeid shrimp[M].Baton Rouge Louisiana USA:World Aquaculture Society,1996:304.
[2]章跃陵,王三英,彭宣宪.无脊椎动物适应性免疫的研究进展[J].水产科学,2005,24(8):43-45.
[3]朱建中,陆承平.对虾白斑综合症病毒在鳌虾动物模型的感染特性[J].水产学报,2001,25(1):47-51.
[4]李响,刘庆慧,侯林.DNA疫苗与多糖类免疫促进剂在对虾疾病控制上的应用研究进展[J].动物医学进展,2008,29(11):52-54.
[5]Wang S H,Chen J C.The protective effect of chitin and chitosan against Vibrio alginolyticus in white shrimp Litopenaeus vannamei[J].Fish Shellfish Immunology,2005,19(3):191-204.
[6]张敬艳,刘庆慧,黄倢.vp28重组核酸疫苗对凡纳滨对虾抗WSSV感染的免疫反应和保护效果[J].动物医学进展,2008,29(11):52-54.
[7]魏克强,许梓荣.家蚕蛹表达的重组VP28疫苗对克氏原鳌虾的抗病毒保护效应[J].实验生物学报,2006,39(6):572-536.
Research on Immune Protection of White Spot Syndrome Virus Surface Antigen Gene
Zhang Na,Liu Xiao
(Zhanjiang Entry-Exit Inspection and Quarantine Bureau,Zhanjiang,Guangdong,524000)
In this report,we constructed multivalent DNA vaccine by the combination of gene VP19、VP28 and tested their protective effects on the shrimp against the challenge of White Spot Syndrome Virus(WSSV).The results indicated that DNA vaccines could protect shrimp from WSSV infection.The best one of them was PVAX1.0-VP19-VP28 multivalent DNA vaccine.
Litopenaeus vannamei;White Spot Syndrome Virus;Surface Antigen Gene;Immune Protection
S941.41
E-mail:vien512@126.com
广东出入境检验检疫局科技计划项目(2012GDK07)
2014-08-15

