宫颈上皮内瘤变妊娠患者高危型HPV感染情况的调查分析
曹丽丽
(青岛市平度市张舍卫生院,山东 平度 266719)
宫颈上皮内瘤变妊娠患者高危型HPV感染情况的调查分析
曹丽丽
(青岛市平度市张舍卫生院,山东 平度 266719)
目的 探讨宫颈上皮内瘤变(CIN)妊娠患者高危型乳头状瘤病毒(HR-HPV)感染情况。方法 选取2011年1月至2014年12月青岛市平度市张舍卫生院收治的CIN妊娠患者200例,其中Ⅰ级100例、Ⅱ级50例、Ⅲ级50例;检测并观察各级患者孕期及产后6个月HR-HPV DNA载量的变化,对比各级患者孕期HR-HPV阳性率,产后6个月转阴率。结果 ①CINⅠ级、Ⅱ级、Ⅲ级患者孕期HRHPV阳性率分别为77%、86%、96%,差异具有统计学意义(P<0.05);HR-HPV阳性率与CIN病变级别呈正相关(r=0.779,P<0.05);CINⅠ级、Ⅱ级、Ⅲ级患者产后6个月HR-HPV转阴率分别为55%、36%、6%;差异具有统计学意义(P<0.05);HR-HPV转阴率与CIN病变级别呈负相关(r=0.776,P<0.05);②CINⅠ级、Ⅱ级、Ⅲ级患者孕期HR-HPVDNA载量比较差异无统计学意义(P>0.05);产后6个月CINⅢ级患者的HR-HPVDNA载量明显高于Ⅱ级、Ⅰ级患者,差异具有统计学意义(P<0.05);同一级别CIN患者孕期HRHPVDNA载量明显高于产后6个月,差异具有统计学意义(P<0.05)。结论 妊娠合并CIN患者孕期HR-HPV感染情况及产后转归与CIN病变级别密切相关。
妊娠;宫颈上皮内瘤样病变;乳头状瘤病毒感染
宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)是临床常见的妇科疾病,是宫颈癌重要的前期表征,能够反应宫颈癌的发展趋势[1]。临床研究发现非孕患者中高危型乳头状瘤病毒(high-risk type human papillomavirus,HR-HPV)感染与CIN的发生、发展关系密切[2]。但对于CIN妊娠患者与HR-HPV感染关系的研究尚比较少见[3]。本研究检测不同级别CIN患者孕期及产后6个月的HR-HPVDNA载量,观察孕期HR-HPV阳性率及产后6个月的转阴率,探讨CIN病变级别与HRHPV感染的关系,希望能对CIN妊娠患者的病情预测及诊治提供一定的帮助。
1 资料与方法
1.1研究对象:选取2011年1月至2014年12月我院收治的CIN妊娠患者200例,年龄21~22岁;其中Ⅰ级100例、Ⅱ级50例、Ⅲ级50例。纳入标准:①孕13~25周;②孕检液基薄层细胞学检查(TCT)筛查结果异常;进一步行阴道镜下宫颈活检确诊为CIN;③自愿加入本研究,能够配合检测及观察者;④排除既往有阴道手术史、习惯性流产史,前置胎盘、胚胎移植、珍贵胎儿孕妇及精神疾病者。本研究获得本院医学伦理委员会批准。
1.2方法
1.2.1TCT及病理检查:采用TCT系统采集宫颈表面及经管脱落上皮细胞,送细胞学检查,诊断标准参照国际癌症协会宫颈细胞学分类系统分类法(2001年版)。TCT检查异常的孕妇,行阴道镜检查,使用莱卡电子阴道镜,按照标准步骤进行检查,对宫颈组织进行活检,病理诊断参照WHO制定的国际疾病分类标准(2003年版)。
1.2.2HR-HPVDNA载量检测:采用宫颈管刷(美国Digene公司)在宫颈外口旋转3周并停留1 min,采集宫颈外口分泌物。采用第二代杂交捕获试验(HC-Ⅱ)技术进行HR-HPV定性及半定量检测HR-HPV类型,HR-HPVDNA载量半定量检测具体方法参照WHO制定的人乳头状瘤病毒感染及病毒载量检测方法。
1.2.3随访复查:CIN妊娠患者孕期每8~12周复查阴道镜,对宫颈可疑病变取活检并同时HR-HPVDNA载量检测。产后6个月复查阴道镜,对宫颈可疑病变取活检并同时HR-HPVDNA载量检测。若孕期病情进展为宫颈癌,适当处理或终止妊娠。本研究无孕期进展为宫颈癌病例,无产后失访病例。
1.2.4统计方法:采用SPSS20.0版统计学软件进行处理。计数资料以百分率表示,组间比较采用卡方检验,计量资料以均数加减标准差表示,组间比较采用t检验,多组间比较采用方差分析,CIN病变级别与HR-HPV关系采用Spearman等级相关性分析,以P<0.05表示差异具有统计学意义。
2 结 果
2.1不同级别CIN患者孕期HR-HPV阳性率及产后6个月转阴率:CINⅠ级、Ⅱ级、Ⅲ级患者孕期HR-HPV阳性率分别为77%、86%、96%,差异具有统计学意义(P<0.05);HR-HPV阳性率与CIN病变级别呈正相关(r=0.779,P<0.05);CINⅠ级、Ⅱ级、Ⅲ级患者产后6个月HR-HPV转阴率分别为55%、36%、6%;差异具有统计学意义(P<0.05);HR-HPV转阴率与CIN病变级别呈负相关(r=0.776,P<0.05);见表1。

表1 不同级别CIN患者孕期HR-HPV阳性率及产后6个月转阴率[n(%)]
2.2不同级别CIN患者孕期及产后6个月HR-HPVDNA载量变化:CINⅠ级、Ⅱ级、Ⅲ级患者孕期HR-HPVDNA载量比较差异无统计学意义(P>0.05);产后6个月CINⅢ级患者的HR-HPVDNA载量明显高于Ⅱ级、Ⅰ级患者,差异具有统计学意义(P<0.05);同一级别CIN患者孕期HR-HPVDNA载量明显高于产后6个月,差异具有统计学意义(P<0.05),见表2。
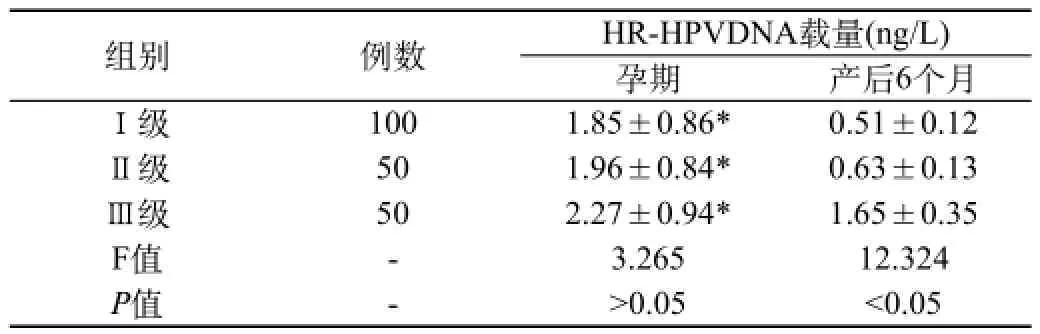
表2 不同级别CIN患者孕期及产后6个月HR-HPVDNA载量变化
3 讨 论
宫颈癌是妇科常见恶性肿瘤,严重危害女性的健康及生命安全。宫颈癌的发病原因及机制尚未完全清楚,但HR-HPV持续感染已成为公认的宫颈癌发生发展的重要影响因素[4]。HPV是一种属于乳多空病毒科的乳头瘤空泡病毒A属,是球形DNA病毒,能引起人体皮肤黏膜的鳞状上皮增殖[5]。HPV目前已分离出130多种,其中黏膜高危型HPV-16、18、30、31、33、35、39与宫颈癌与宫颈癌关系密切[6]。大量文献已经证明,宫颈病变程度越重,HR-HPV阳性率越高[7]。Amarosa等[8]报道,非孕期CINⅠ、Ⅱ、Ⅲ患者中HR-HPV阳性率分别为30.5%、57.8%和64.6%,在宫颈癌中高达100%。Iwata等[9]报道合并CIN的孕妇在孕中晚期HR-HPV阳性率为86.5%。本研究发现孕中晚期的CIN患者HR-HPV阳性率为84.2%(101/120),并且随着CIN病变程度的升高HR-HPV阳性率也逐渐升高,与以往的报道基本一致。可见,孕期检测HR-HPV对于预测CIN的发生发展具有重要的临床意义。
本研究同时对CIN不同病变级别患者产后6个月的HR-HPV自然转阴情况进行观察,结果发现,CIN病变级别越高术后6个月的HRHPV自然转阴率越低,也说明宫颈病变越高,越容易造成HR-HPV的持续感染,提示对于妊娠合并CIN尤其是Ⅲ级患者,产后应尽早进行复查,并根据活检结果给予适时合理的治疗。文献报道,高HR-HPVDNA载量是进展性CIN及宫颈癌的危险因素[10]。研究HRHPVDNA载量对于CIN的诊治均具有重要的指导意义[11]。Joshi等[12]报道非孕期CIN患者病变级别越高HR-HPVDNA载量越高,二者呈正相关。但Depuydt等[13]报道非孕期CIN患者的病变级别与HR-HPVDNA载量无明显相关性。本研究结果显示不同病变级别CIN患者孕期HR-HPVDNA载量无明显差异,而产后6个月时CINⅢ级患者的HRHPVDNA载量明显高于其他各级别,表明孕期CIN病变级别越高产后HR-HPV越难清除,尤其是Ⅲ级患者。本研究同时发现同级别CIN患者孕期HR-HPVDNA载量明显高于产后6个月,分析原因为CIN患者孕期免疫力低下,同时感染多种HR-HPV亚型的可能性升高,产后患者的免疫力逐渐恢复,低致病力亚型的病毒容易被清除,由低致病力亚型病毒引起的CINⅠ级和Ⅱ级患者,可能会降低为正常或Ⅰ级;而高致病力亚型病毒(如16、18型)不容易被清除,由高致病力亚型病毒导致的CINⅢ级患者产后自然逆转的可能性极小。因此,对于合并CIN的妊娠患者,孕期应进行HR-HPV分型筛查,并可根据产后复查的病毒载量预测疾病转归。
综上所述,孕期HR-HPV分型及DNA载量检测是宫颈病变及宫颈癌筛查的重要指标。对于合并CIN的妊娠患者孕期进行HR-HPV分型检测,产后进行病毒载量检测对于判断病变程度、预测疾病发展,预防疾病进展,具有重要的临床意义。
[1]蒋静,刘玉娟,敬巧.妊娠合并子宫颈上皮内瘤变患者高危型HPV感染分析[J].海南医学院学报,2013,19(6):825-827.
[2]袁运水.中晚期妊娠合并宫颈上皮内瘤变患者高危型HPV感染的临床分析[J].中国妇幼保健,2014,29(11):1541-1542.
[3]黄平.妊娠合并子宫颈上皮内瘤变患者高危型人乳头状瘤病毒感染的临床研究[J].中国肿瘤临床与康复,2013,20(11):1211-1213.
[4]钱雪珍,方丽娟,俞菊仙,等.宫颈环形电切术治疗宫颈上皮内瘤变疗效观察[J].上海预防医学,2012,24(11):109-111.
[5]蓝允莲,王岩,郑丽萍.宫颈病变患者人乳头状瘤病毒感染调查分析[J].中华医院感染学杂志,2015,25(13):3105-3107.
[6]邱琳,张雅琪,周爱芬.1955例武汉市农村妇女HPV感染状况与危险因素分析[J].实用妇产科杂志,2013,29(9):662-664.
[7]徐明堂,何春年,许长田,等.宫颈鳞状上皮病变中人乳头状瘤病毒16/18存在状态的研究[J].中华病理学杂志,2013,42(6):400-401.
[8]Amarosa EJ,Winer RL,Hong KJ,et al.Impact of Possibly Oncogenic High-Risk Human Papillomavirus (HPV) Types in Triage for ASC-US Cervical Cytology Results[J].J Low Genit Tract Dis,2015,6(30):873-876.
[9]Iwata T,Hasegawa T,Ochiai K,et al.Human Papillomavirus Test for Triage of Japanese Women With Low-Grade Squamous Intraepithelial Lesions[J].Reprod Sci,2015,6(19):1028-1032.
[10]Kang WD,Kim SM.Human papillomavirus genotyping as a reliable prognostic marker of recurrence after loop electrosurgical excision procedure for high-grade cervical intraepithelial neoplasia (CIN2-3) especially in postmenopausal women[J].Menopause,2015,6(8):120-125.
[11]Qiu C,Zhi Y,Shen Y,et al.High-resolution melting analysis of HPV-16L1 gene methylation: A promising method forprognosing cervical cancer[J].Clin Biochem,2015,5(14):874-877.
[12]Joshi S,Kulkarni V,Darak T,et al.Cervical cancer screening and treatment of cervical intraepithelial neoplasia in female sex workers using "screen and treat" approach[J].Int J Womens Health,2015,5(4):477-483.
[13]Depuydt CE,Jonckheere J,Berth M,et al.Serial typespecific human papillomavirus (HPV) load measurement allows differentiation between regressing cervical lesions and serial virion productive transient infections[J].Cancer Med,2015,5(20):765-768.
The Investigation and Analysis of High Risk HPV Infection in Patients with Cervical Intraepithelial Neoplasia
CAO Li-li
(Pingdu Zhangshe Health Center, Pingdu 266719, China)
Objective To investigate the infection status of the high-risk type human papillomavirus (HR-HPV) in cervical intraepithelial neoplasia (CIN)pregnancy patients. Methods Selected 200 cases of CIN pregnancy patients from January 2011 to December 2014 in Qingdao Pingdu city Zhangshe health center, Ⅰ level 100 cases, Ⅱ level 50 cases, Ⅲ level 50 cases. Detected and observed the change of the HR-HPV DNA capacity at the time of pregnancy and postpartum 6 months. Contrast the HR-HPV positive rate at the time of pregnancy, the negative conversion rate at the time of postpartum 6 months. Results ①The HR-HPV positive rate of the CIN Ⅰ, Ⅱ, Ⅲ level patients at the time of pregnancy respectively was 77%, 86%, 96%, the difference had statistical significance (P<0.05); HR-HPV positive rate and the lesions level of CIN were positively correlated (r=0.779, P<0.05). The HR-HPV negative conversion rate of the CIN Ⅰ, Ⅱ, Ⅲ level patients at the time of postpartum 6 months respectively was 55%, 36% and 6%, the difference had statistical significance (P<0.05); HR HPV negative conversion rate and the lesions level of CIN were negative correlation (r=0.776, P<0.05); ②The HR-HPVDNA capacity of the CIN Ⅰ, Ⅱ, Ⅲ level patients at the time of pregnancy had no statistically significant difference (P>0.05). The HR-HPVDNA capacity of the CIN Ⅲ level patients at the time of postpartum 6 months are significantly higher than the CINⅠ, Ⅱ level patients , had statistically significant difference(P<0.05). The HR-HPVDNA capacity of same level of CIN patients at the time of the pregnancy was significantly higher than the postpartum 6 months,had statistically significant differences (P<0.05). Conclusion The infection status and the postpartum outcome of HR-HPV in CIN pregnancy patients was closely related to the level of CIN lesions.
The pregnancy; Cervical intraepithelial neoplasia; HPV
R737.33;R714.2
B
1671-8194(2015)26-0008-03

