氯化苯生产废水制备Fe3O4颗粒的研究及应用
祁方
(安徽八一化工股份有限公司,安徽 蚌埠 233010)
氯化苯生产废水制备Fe3O4颗粒的研究及应用
祁方
(安徽八一化工股份有限公司,安徽 蚌埠 233010)
介绍了一种氯化苯生产废水制备Fe3O4的方法,通过实验得出最佳反应条件,并在此基础上进行工业化设计及应用,解决了氯化苯生产废水处理难度大的问题,废物得到资源化利用,大大降低了环境污染,为氯化苯生产废水处理开辟了一种新的途径。
氯化苯;废水;Fe3O4;铁粉
四氧化三铁是一种多功能磁性材料,在物理、化学、机械、医疗、矿业等领域都有广泛应用。其制备合成方法众多,主要分为物理法、化学法和物化综合法。化学法按照分散介质种类可划分为气相法、液相法和固相法。液相法制备纳米颗粒具有成核和成长过程易调配,微粒的化学组成、形状和大小容易控制的显著特点,按反应机理可分为以下5种,即共沉淀法[1]、沉淀氧化法[2]、还原沉淀法[3、4]、水热法[5、6]、微乳液法[7]和溶胶凝胶法[8]等。
氯化苯是采用苯与氯气以三氯化铁为触媒在氯化反应器内反应制取,反应后的氯化液进入水洗和碱洗工序,水洗后的废酸水主要含有三氯化铁(15~20 g/L)、盐酸(质量浓度5%~10%)和少量有机物;碱洗后的废碱水主要含有氢氧化钠(质量浓度3%~7%)、氢氧化铁和少量有机物。水洗和碱洗废水进入废酸水和废碱水储槽进行酸-苯以及碱-苯分离,上部有机物溢流进有机物回收储槽,然后送至氯化系统循环利用;废酸水和废碱水由储槽底部采出,送至酸碱中和槽进行酸碱中和后生成氢氧化铁(俗称“红泥”)水溶液。氢氧化铁水溶液送至压滤机,压滤后的“红泥”作为废固处理。
徐宁等[9]用染化厂铁泥废料制备Fe3O4,得出反应最佳条件;郑龙熙等[10,11]利用工业酸洗废液制备铁磁流体,取得很好的效果和应用;林春绵等[12]用硫铁矿废水制备氧化铁黑颜料,使其得到资源化利用。上述主要是针对含有Fe2+的废水进行处理,且废水成分相对简单,但是对于氯化苯生产废水在这方面的处理应用却未见报道。本文结合上述文献,采用中和还原沉淀法对氯化苯生产废水制备Fe3O4进行探索性实验,取得良好效果,且得出最佳反应条件并对其可行性进行经济核算,最终在该公司得到了工业化应用。
2 小试实验及结果分析
2.1试剂与仪器
水洗废酸水;碱洗废碱水;铁粉(100目,工业级);恒温水浴锅;水银温度计(0~100℃);三口烧瓶;滴液分液漏斗;铁架台。
2.2实验原理
废酸水中按比例加入一定量还原剂铁粉,待溶解完全加入沉淀剂废碱水,过程中一直搅拌并维持恒温,一段时间后即可得到Fe3O4,反应如下:
2Fe3++Fe→3Fe2+(1)
2H++Fe→Fe2++H2↑(2)
OH-+H+→H2O(此步为副反应)(3)
Fe3++3OH-→Fe(OH)3↓(4)
Fe2++2OH-→Fe(OH)2↓(5)
2Fe(OH)3+Fe(OH)280℃搅拌→Fe3O4+4H2O(6)
由反应式(1)和(2)可知,二价铁离子有2个来源,主要来自第二个反应。由于溶液中含有大量酸,因此,沉淀剂加入以后会先发生酸碱中和副反应,然后生成Fe(OH)3和Fe(OH)2沉淀,并且在沉淀生成过程中共聚脱水生成Fe3O4。
2.3四氧化三铁制备
将车间取得废水过树脂柱除苯,量取一定量废酸水加入三口烧瓶,用水浴锅加热至80℃保持恒温,向三口烧瓶中加入还原铁粉并开启搅拌至完全溶解;用滴液漏斗加入沉淀剂废碱水,使体系pH≥12,反应结束后陈化30 min,用软水反复洗涤至中性,过滤后干燥研磨即可得到粉末状Fe3O4颗粒。
2.4影响因素探讨
为了得到粒度均匀、晶型单一、分散良好的Fe3O4颗粒,对反应过程中影响Fe3O4粒子性能的各因素进行对比研究。
2.4.1pH值的影响
Fe2+、Fe3+在水溶液中开始沉淀和完全沉淀时的pH值见表1。
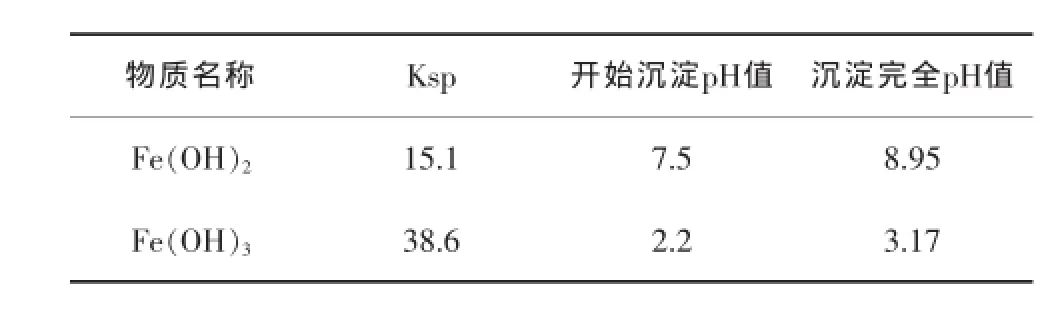
表1 Fe2+、Fe3+氢氧化物沉淀的pH值[13-15]
从表1中可以看出,共沉淀时pH值应保持在9以上,pH值太低Fe2+沉淀不完全,影响Fe3O4的纯度。表2列出沉淀完全时不同pH值的产物情况。
从表2得出,在制备过程中,随着沉淀剂的加入,最先出现的产物是棕红色空位尖晶石结构的Fe2O3,随即Fe2+和OH-中的氧离子补充进空位中得到深黑色的Fe3O4粒子。如果pH值较低,则使溶液中OH-太少,OH-中的氧离子就不足以与Fe2+同时补充进空位中得到深黑色的Fe3O4粒子,而是生成Fe(OH)2包裹在Fe2O3外面。因此,综合确定将共沉淀后体系的pH值控制在12左右。
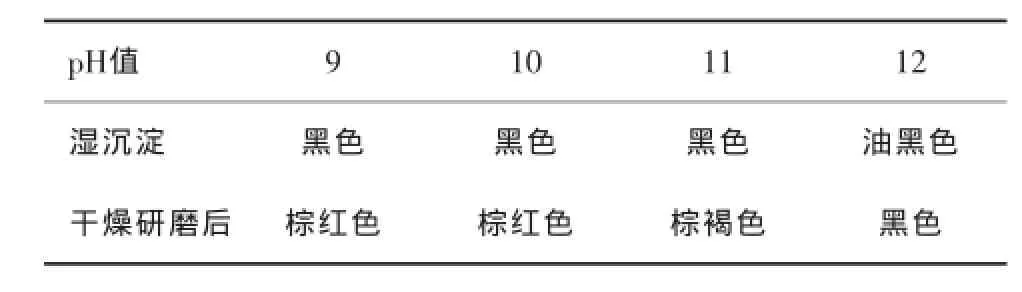
表2 沉淀完全时不同pH值对应产物颜色
2.4.2R值的影响
制备Fe3O4粒子的基本化学反应式见2.2,由反应式(5)可以看出,Fe2+和Fe3+的最佳摩尔比为1∶2,由于反应过程中二价铁离子容易被氧化,因此,反应步骤(1)和(2)中的铁粉要适当过量,即保证反应中二价铁离子过量。实验时,通过改变Fe3+、Fe2+摩尔比R制得一系列样品,得到R值对产品收率影响见图1。
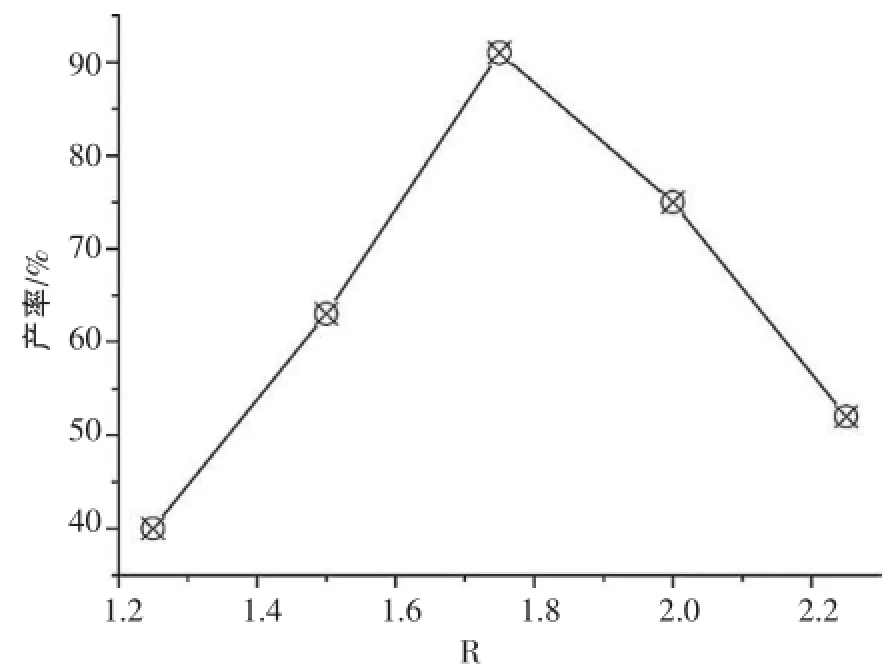
图1 R值对产品收率的影响
由图1可见,R值在1.25~1.75,Fe3O4产率逐渐增大;当R=1.75时,产率达到最大值;随着R的继续增大,产率反而逐渐下降。这是因为达到最大产率后,随着R的继续增大,产物中Fe2O3含量在增加,Fe3O4的含量在降低。综上,确定Fe3+、Fe2+最佳摩尔比R为1.75。
2.4.3温度的影响
温度对产物产率的影响见图2。
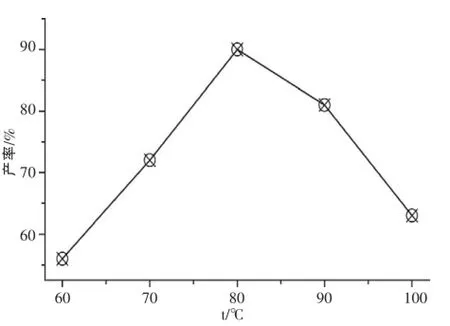
图2 温度对产品收率的影响
从图2可以看出,当温度达到80℃时,产物产率最大,温度太低或太高都不利于产物的形成。所以温度亦是液相化学反应中的一个重要影响因素,反应温度的高低会影响形成产物的种类和纯度。实验表明,温度低于或高于80℃,形成δ-FeOOH和Fe3O4的混合物相。
2.4.4搅拌的影响[3]
通过搅拌可以显著提高共沉淀反应和扩散的结果,因此,为了制备细小颗粒,液相共沉淀反应过程中必须进行充分搅拌。搅拌可以避免局部高温,加快反应速度和新相的生成,同时有助于通过团聚形成微小颗粒。
3 工业化应用
基于上述实验室小试,在确定了各项参数后,对颗粒状Fe3O4生产进行工业化设计并成功投运,流程图见图3。
流程简述:含三氯化铁酸水除苯后加入反应釜1中,开启搅拌同时开启蒸汽阀门给反应釜加热,待反应温度达到80℃左右,按比例加入还原剂铁粉至完全溶解,然后加入沉淀剂(除苯后废碱水与32%浓碱配制成20%左右淡碱水)调节pH值至12左右,停汽冷却至常温由铁泥中间泵2输送至澄清桶3[16]。澄清桶顶部清水溢流至清水槽6,并由清水泵7输送至树脂柱8进行除苯,合格清水进入地池;底部泥浆进入铁泥槽4,由铁泥泵5送至压滤机脱水,脱水后湿泥饼去真空干燥机再次脱水,出来的干泥饼去球磨机粉碎后包装外售。
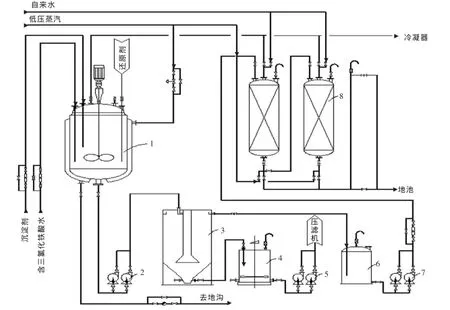
图3 Fe3O4工业生产流程图
4 经济核算
按照氯苯车间现有数据统计,每年产生废酸水21 600 m3,产生废碱水10 800 m3,按照新老工艺对比进行经济核算,结果如下。
4.1碱耗计算
用老工艺生产 “红泥”,反应需耗碱747.6 m3/a(按照32%液碱计),折合59.81万元/a;用新工艺生产“铁泥”,反应需要碱量634.4m3/a(按照32%液碱计),折合50.75万元/a。新老工艺对比,碱耗每年节约成本9.06万元。
4.2蒸汽消耗计算
老工艺蒸汽消耗来自2部分:中和后压滤废水曝气处理和活性炭再生。两项合计每年消耗蒸汽5 638.2 t,折合51.5万元/a;新工艺来自反应釜加热和树脂脱吸再生,每年消耗蒸汽4 620 t,折合42.2万元/a。新老工艺对比,蒸汽消耗每年节约成本9.3万元。
4.3铁粉消耗计算
新工艺每年消耗铁粉56 t,折合20.16万元/a。
4.4Fe3O4销售计算
新工艺每年产出粉末状 Fe3O4269.5 t,折合59.29万元/a。
综上,采用新工艺以后,每年可实际节约生产成本57.49万元。
[1]黄菁菁,徐祖顺,易昌凤,等.化学共沉淀法制备纳米四氧化三铁粒子.湖北大学学报(自然科学版),2007,29(1):50-52.
[2]刘俊.沉淀氧化法制备Fe3O4磁流体.武汉工业学院学报,2009,28(2):42-44.
[3]WANG Huan,XU Li-hua,DI Yun-ping etc.Preparation of Nanosized Magnetism Fe3O4Powders by Reduction Co-precipitation Method,Nanoscience&Nanotechnology,2007,(6):33-49.
[4]ShengchunQu, HaibinYang,DaweiRenetc.Magnetite Nanoparticles Prepared by Precipitation from PartiallyReduced Ferric Chloride Aqueous Solutions,Journal of Colloid and Interface Science,1999,(215):190-192.
[5]吴明在,张启花,刘艳美,等.水热法制备Fe3O4粒子及其形貌控制.安徽大学学报(自然科学版),2009,33(3):60-64.
[6]柴多里,刘忠煌,陈刚,等.水热法合成纳米Fe3O4及其对含酚废水的处理.硅酸盐学报,2010,38(1):105-109.
[7]柴波,张文军,李德忠,等.微乳法制备W/O型Fe3O4磁流体及其清除水面浮油模拟研究.环境科学,2005,24(4):419-422.
[8]Hongzhang Qi,Biao Yan,Chengkui Li.Preparation and magnetic properties of magnetite nanoparticles by sol-gel method,INEC.2010. Vols 1and2.
[9]徐宁,李云,黎章,等.铁泥制备纳米四氧化三铁.沈阳化工学院学报,2007,21(4):279-282.
[10]郑龙熙,高福祥,王文生,等.用酸洗废水制备铁磁流体的方法. 1993,CN1077308A.
[11]王文生,郑龙熙,高福祥,等.用轧钢酸洗废液制备铁磁流体的研究.金属矿山,1994,(1):44-46.
[12]林春绵,徐明仙,李雁,等.一种资源化处理硫铁矿废水制备氧化铁黑颜料的方法.2010,CN 101746836 A.
[13]张文秀,丁文中.金属离子氢氧化物沉淀完全时的pH值.杭州教育学院学报,1993,(2):39-41.
[14]邓同舟.氢氧化物沉淀的pH值范围图.化学通报,1979,(2):27-28.
[15]曹义先.氢氧化物沉淀与pH值的关系.四川师院学报(自然科学版),1984,(1):69.
[16]李德昌,祁方,朱林林,等.一种道尔式蜂窝斜管填料澄清桶. 2013,CN 203017815 U.收稿日期:2015-03-10
Research and application on preparation of Fe3O4particles by waste water in production process of chloride benzene
QI Fang
(Anhui Bayi Chemical Industry Co.,Ltd.,Bengbu 233010,China)
This paper introduces a method of preparing Fe3O4with waste water in the production of chlorinated benzene.Through the test in laboratory,it is concluded that the best reaction conditions are as follows.On this basis,we carried out the design and application of industrialization.Comparing with the old process,which has solved the difficult problem of waste water treatment in chloride benzene production and recycles the waste resource,and greatly reduces environmental pollution.It has opened up a new way for the production of chloride benzene waste water treatment.
chloride benzene;wastewater;Fe3O4;iron powder
X781.2
B
1009-1785(2015)10-0025-03

