文山生姜叶多糖纯化工艺研究
王红萍,郭庆森
(文山学院 化学与工程学院,云南 文山 663099)
文山生姜叶多糖纯化工艺研究
王红萍,郭庆森
(文山学院 化学与工程学院,云南 文山 663099)
为了纯化文山生姜叶中的多糖,采用了热水粗提取生姜叶多糖,去除蛋白质、色素等操作之后,用大孔树脂和聚酰胺来吸附纯化多糖,做单因素以及正交试验。通过对溶剂浓度、样品上样量、树脂种类、树脂的量等单因素进行研究,确定了最佳纯化条件为:用sevage法除蛋白、用活性炭脱色、醇沉浓度95%,选择AB-8树脂,在最佳工艺条件下多糖的纯化量为4.5 %。
生姜叶;多糖;大孔树脂;纯化工艺
文山盛产生姜,但是只食用生姜的根茎部,生姜采收时,大量的生姜叶子废弃在地里,没有得到充分的利用。据有关文献报道,生姜叶中糖含量为鲜重每百克中含有56.68 g[1],本实验对文山生姜叶多糖进行提取和纯化,可为生姜叶的开发利用提供理论依据。
1 材料与方法
1.1材料
文山小黄姜生姜叶,采自云南砚山县农户家中,经文山学院环境与资源学院陈云老师鉴定,为百合纲,姜目,姜科,姜族中的小黄姜(Globba racemosa Smith)姜叶。
1.2仪器与试剂
仪器:分光光度计(V-1100型,上海美谱达仪器有限公司)、离心机(800型,江苏大地自动仪器厂)、抽滤机(2x-1A型,沈阳微电机厂)、真空干燥机(DZF-6020,上海乔跃电子有限公司)、比旋光仪(WXG-4型,上海长方光学仪器厂)、层析管、200 mL容量瓶。
试剂:95 %乙醇、60 %乙醇、葡萄糖标准品、硫酸蒽酮、树脂AB-8和60目的聚酰胺。
1.3文山生姜叶多糖的粗提取
取10 g的生姜叶碎片过一个多孔筛,用80 ℃蒸馏水提取2次,第1次加8倍量水,第2次加7倍量水,加3.5倍量95 %乙醇沉淀,沉淀抽滤离心后,用50 ℃真空干燥[2],得到生姜叶粗多糖1.0141 g。
1.4标准曲线制备
精密称取经105 ℃干燥恒重的葡萄糖100 mg,置100 mL量瓶中,加水适量使溶解,稀释至刻度,摇匀,精密吸取10 mL,置100 mL量瓶中,加水至刻度,摇匀,备用,此标准溶液l mL含葡萄糖0.1 mg。分别准确吸取葡萄糖标准溶液0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL(相当于葡萄糖0 mg、0.02 mg、0.04 mg、0.06 mg、0.08 mg、0.1 mg),置于25 mL比色管中,准确补充水至2.0 mL,加入50 g/L苯酚溶液1.0 mL,混匀,小心加入浓硫酸10.0 mL摇匀后沸水浴10 min,取出至室温后用分光光度计在490 nm波长处测定吸收度[3],以吸光度值为Y,葡萄糖浓度为X,得回归方程[4]。
1.5生姜叶粗多糖除蛋白
由于蛋白质不溶于水且在氯仿中变性,将多糖水溶液、氯仿、戊醇(或正丁醇)之比调为25∶4∶1,混合后摇动20~30 min,生成凝胶再离心,除去水层和交界处的变性蛋白质,上清液为去蛋白的多糖溶液[5-9]。
脱蛋白质率= (C0- C1)/C0×100 %
式中:C0为脱色前蛋白质的质量浓度;C1为脱色后蛋白质的质量浓度[10]。
1.6生姜叶粗多糖除色素
活性炭属非极性吸附剂,有较强的吸附能力,特别适合于水溶性物质的分离。它的来源充足,价格便宜,上柱量大,适用于大量制备性分离。目前用于色谱分离的活性炭主要为粉末状活性炭[11]。
脱色率= (Α0- Α1) /Α1×100 %
式中:Α0为脱色前吸光度;Α1为脱色后吸光度。
用蒽酮-硫酸法测定多糖并计算保留率,采用葡萄糖作对照,线性回归方程为:
Α(吸光度)=1.8262C-0.0010(R2=0.9992)
式中:C为以葡萄糖计的多糖质量浓度。
保留率(多糖)=M2/M1×100 %
式中:M1为脱色前多糖的质量,M2为脱色后多糖的质量[10,12]。
1.7树脂的预处理
1.7.1大孔树脂AB-8预处理
先使用蒸馏水冲洗AB-8到无泡沫后用无水乙醇浸泡24 h,并用无水乙醇冲洗AB-8到无白色浑浊,再用蒸馏水洗到无醇味。分别用酸(5 % HCl)和碱(2% NaOH)冲洗,用溶液冲洗AB-8,使洗出液为酸性和碱性后用5 % HCl和碱2 % NaOH浸泡4 h,再用蒸馏水洗到中性备用[12-13]。
1.7.2聚酰胺树脂预处理
将60目的聚酰胺放在95 %乙醇中煮沸0.5 h,取出离心甩干,换上新乙醇再煮,再甩干,重复几次可达效果。也可用沸腾乙醇回流,但只要流动相不含乙醇,这步处理就可省略。
1.8大孔树脂和聚酰胺树脂的吸附率以及解析率
1.8.1树脂AB-8和聚酰胺对生姜叶多糖的吸附率
称取经上述处理过的AB-8和聚酰胺1.00 g放入100 mL锥形瓶中后加入30 mL生姜叶多糖粗提液振荡,每间隔1 h取样测定多糖量并计算其吸附量和吸附率。
吸附量(mg/g)={(C0-C1)×V }/M
吸附率(%)= (C0-C1)/C0×100%
式中:C0为吸附前多糖浓度;C1为吸附后多糖浓度(mg/mL);V为液体体积(mL);M为湿树脂重(g)[12,14]。
1.8.2树脂AB-8和聚酰胺对生姜叶多糖的解析率
将充分吸附后的AB-8和聚酰胺过滤,用蒸馏水冲洗滤干放到锥形瓶中,加入30 mL 60%乙醇塞口后振荡,每间隔1 h取样,测定多糖的含量计算解析率。
解析率(%)= m0/(m-m1-m2)×100%
式中:m0为解析液多糖质量(mg);m为上柱液多糖质量(mg);m1为漏出液多糖质量(mg);m2为水洗液多糖质量(mg)[12]。
1.9单因素及正交实验
大孔吸附树脂法纯化姜叶多糖的主要影响因素为上样量,稀释倍数,和湿树脂量,现以吸光度为指标,安排单因素实验。以姜叶多糖纯度为指标,安排正交实验,各因素水平见表1。
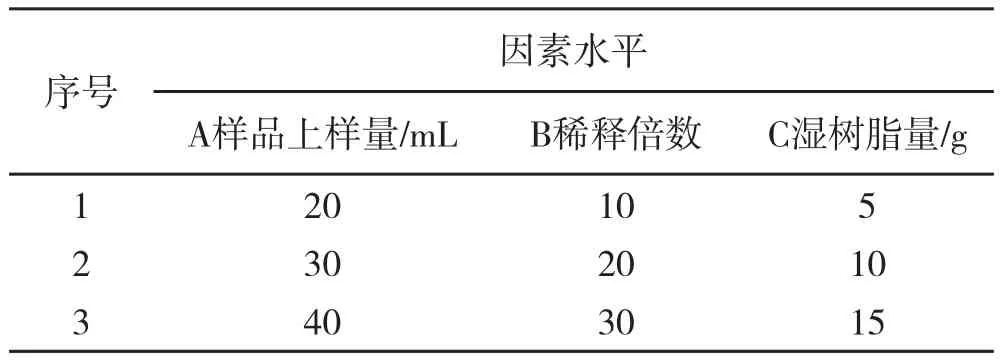
表1 因素水平表
1.10生姜叶多糖的纯化检验
在纯化后的生姜多糖水溶液中加入乙醇至其浓度为10%左右后离心,得沉淀1。取上清液再加入乙醇使其浓度为20%~25%离心,得到沉淀2,比较沉淀1、2的比旋度。若比旋度相同,则此多糖是纯品[15-16]。
2 结果与讨论
2.1文山生姜叶多糖研究结果与分析
2.1.1标准曲线
根据1.4方法得出的不同浓度下的不同吸光度值绘制标准曲线。图1是根据在490 nm处不同浓度的标准葡萄糖溶液的吸光度作标准曲线:

图1 标准曲线图
2.1.2各除杂操作实验结果分析比较
根据1.5、1.6的方法得到表2数据。

表2 两种树脂效果比较
2.2AB-8和聚酰胺的吸附、解析率研究结果分析
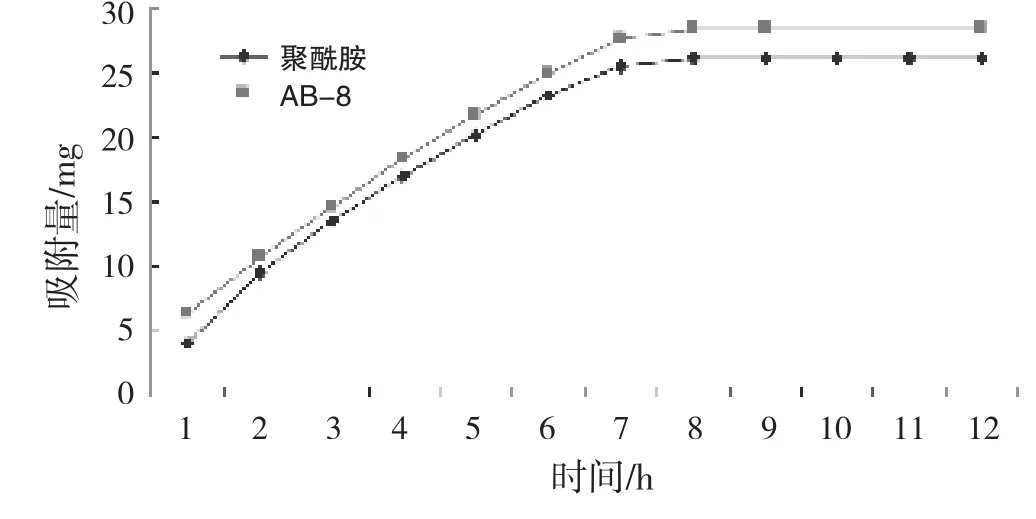
图2 树脂吸附量与时间关系

图3 树脂解析率与时间关系图
图2表明,吸附在前6 h内,AB-8和聚酰胺能够快速吸附姜叶多糖,其后速率放缓,在9 h左右吸附量达到饱和和吸附平衡。AB-8和聚酰胺的静态吸附量是:AB-8大于酰胺。由图2知AB-8静态饱和吸附量为28.3 mg/g,说明AB-8对姜叶多糖的吸附具有选择性,吸附能力与树脂类型有关。
图3表明,60%乙醇溶液对AB-8和聚酰胺具有较好的解析能力, 4 h内就基本达到解析平衡。由图3可知AB-8最大解析率可达96.70%。
综上可知:AB-8对生姜叶多糖有较强的吸附和解析能力,所以用AB-8纯化生姜叶多糖。
2.3单因素及正交实验结果分析
2.3.1单因素结果分析
单因素实验结果见表3~表4:
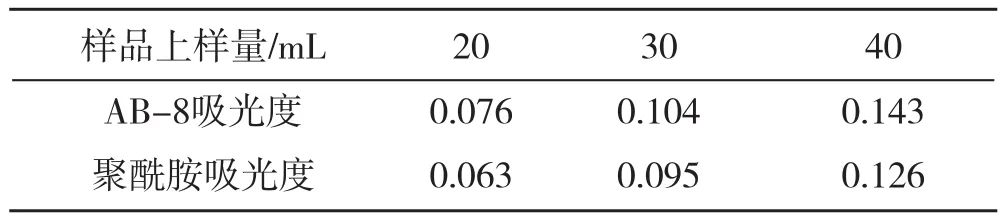
表3 样品上样量与吸光度
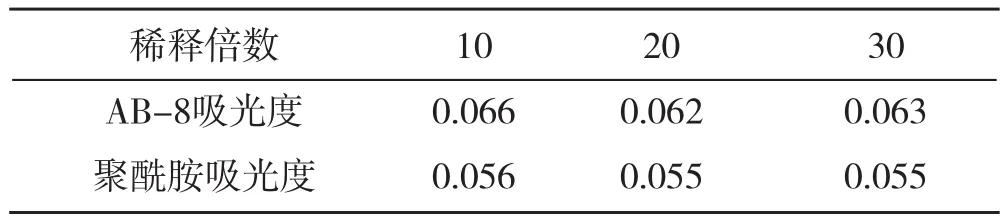
表4 稀释倍数与吸光度
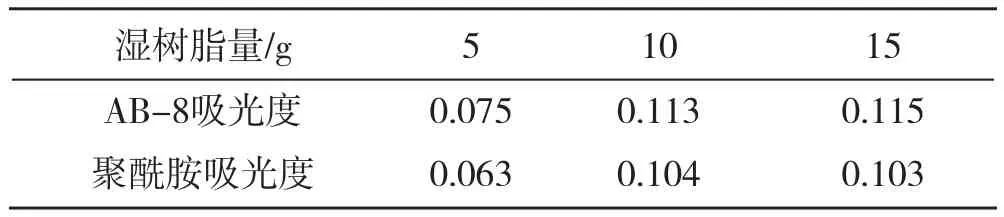
表5 湿树脂量与吸光度
实验结果表明:样品上样量与吸附量成正比关系,稀释倍数小一些更好。吸附量多少在于多糖含量的多少,树脂量要根据上样量多少适度增减。
2.3.2正交实验结果分析
现以姜叶多糖纯度为指标,安排正交实验,实验结果见表6。

表6 正交实验结果
由表6可见,3个因素极差表现为:B>A>C,对生姜叶多糖所得率影响最大的因素是稀释倍数,其次是样品上样,再次是树脂量。生姜叶多糖的最优工艺条件为A2B2C2,经验证试验测定,在此最佳工艺纯化条件下生姜叶多糖含量最高可达4.5 % 。
正交实验中,A2B2C2条件下和正交中A2B2C3条件下的提取率一样的原因是AB-8已经完全吸附了多糖成分,所以才出现提取率相等的结果。
3 结论
通过对文山小黄姜姜叶中多糖的纯化研究,得出如下结论:
1)通过单因素、正交试验研究,确定了最佳纯化条件为:用sevage法除蛋白、用活性炭脱色、醇沉浓度95%,树脂选择为AB-8树脂,在最佳工艺条件下多糖的纯化量为4.5%。
2)AB-8对生姜叶多糖有较强的吸附和解析能力,所以用AB-8纯化生姜叶多糖。
3) 三个因素极差表现为:B>A>C,对生姜叶多糖所得率影响最大的因素是稀释倍数,其次是样品上样,再次是树脂量。生姜叶多糖的最优工艺条件为A2B2C2,即在样品上样量为30 mL、稀释倍数为20倍、湿树脂量为10 g的时候文山生姜叶的纯化效果最佳。
[1] 石太渊,于淼.生姜叶营养成分分析及饮料制备工艺研究[J].食品工业,2013(4):54-56.
[2] 张锦雀,黄丽英,苏聪枚,等.中草药多糖提取分离纯化研究进展[J].中药材,2008(11):17.
[3] 杨金枝.和田玉枣多糖的研究及其口服液的生产工艺初探[D].陕西:陕西师范大学,2008.
[4] 穆旻,冯春华.植物性天然香料提取新技术研究进展[J].香料香精化妆品,2008(8):10.
[5] 谢红旗,周春山.香菇多糖脱色工艺研究[J].离子交换与吸附,2007(2):158.
[6] 叶凯贞,黎碧娜,王奎兰.多糖的提取、分离与纯化[J].广州食品工业科技,2004(3):144-145.
[7] 叶凯贞.南瓜多糖的提取纯化及其性能研究[D].广州:广东工业大学,2005.
[8] 金婷.沙棘多糖的提取纯化、结构鉴定及其抗氧化性的研究[D].哈尔滨:东北农业大学,2006.
[9] 郑渊月.毛竹叶活性多糖、类黄酮的中试提取及分离纯化研究[D].南昌:南昌大学,2006.
[10]李厚兵,任爱农,邹义芳.大孔吸附树脂纯化野菊花多糖工艺[J].中国实验方剂学杂志,2012(2):49-52.
[11] 何首林,何军,高保卫,等.28种植物提取物对苹果、番茄防腐保鲜活性研究[J].西南林学院学报,2012(6):6.
[12] 任海伟,陈海秀,唐学慧,等.大孔树脂纯化薏苡多糖的研究[J]. 食品工业科技,2012(3):249-251.
[13]毛燕,王学利.毛竹叶、枝多糖的提取[J].林产化工通讯,2001(2):2.
[14] 陈红惠,彭光华. 大孔树脂纯化雪莲果叶酚酸工艺的研究[J].食品工业科技,2009(12):228-232.
[15] 林颖,吴毓敏,吴雯,等.天然产物中的糖含量测定方法正确性的研究[J].天然产物研究与开发,1996(9):8.
[16] 徐渭沅.黄精多糖的提取工艺及其纯化、分离[D].贵阳:贵州大学,2006.
A Study on the Polysaccharide Purifi cation Process of Wenshan Ginger Leaves
WANG Hongping, GUO Qingsen
(School of Chemistry and Chemical Engineering, Wenshan University, Wenshan Yunnan 663099, China)
In order to purify the polysaccharide in Wenshan ginger leaves, coarse polysaccharide is extracted from ginger leaves by hot water, polysaccharide is absorbed and purifi ed with macroporous resin and polyamide after removing protein and pigment and the single factor and orthogonal experiment are done. By the study of solvent concentration, sample quantity, the type of resin, and the amount of resin and single factor and orthogonal test, the optimum purifi cation conditions are determined as follows: remove protein by sevage method, decolor with active carbon , alcohol concentration of 95%, choiced AB 8 resin. Under the optimum condition, the amount of purifi ed polysaccharide is 4.5%. The results can provide theoretical basis for the development and utilization of ginger leaves.
ginger leaves; polysaccharide; macroporous resin; purifi cation process
S567
A
1674 - 9200(2015)06 - 0049 - 04
(责任编辑 张铁)
2015 - 03 - 19
文山学院科研基金项目“文山生姜叶的营养成分分析及多糖的提取与纯化”(14WSY12)。
王红萍,文山学院化学与工程学院讲师,硕士。

