L-α-氨基酸金属螯合物的制备模型研究
徐怀春,解成骏,刘俊
(文山学院 化学与工程学院,云南 文山 663099)
L-α-氨基酸金属螯合物的制备模型研究
徐怀春,解成骏,刘俊
(文山学院 化学与工程学院,云南 文山 663099)
建立以L-α-氨基酸和金属盐为原料,制备L-α-氨基酸金属螯合物的研究模型。用L-α-氨基酸与金属盐制备L-α-氨基酸金属螯合物,探究制备适合的物料比 、最佳的pH值、适宜的温度、最佳的反应时间等,根据L-α-氨基酸和L-α-氨基酸金属螯合物的结构特征以及它们理化性质的差异,用红外光谱法来验证产物,建立了以L-α-氨基酸和金盐属为原料,制备L-α-氨基酸金属螯合物及IR法表征的研究模型,为复杂背景条件下制备L-α-氨基酸金属螯合物提供依据。
L-α-氨基酸金属螯合物;制备模型
大豆、花生富含蛋白的植物果实中含有18种氨基酸,其中赖氨酸、色氨酸、苯丙氨酸、蛋氨酸、苏氨酸、亮氨酸、异亮氨酸、缬氨酸等8种为必须氨基酸,人体或动物体不能合成或合成速度及数量不能满足正常生长需要[1]。L-α-氨基酸金属螯合物作为金属微量元素的载体,既有补充微量元素,又有补充氨基酸的作用,而且由于其结构与生物体催化酶具有结构相似性,能排除无机盐阴离子的污染,具有吸收速率快,稳定性好,抗干扰,毒性小,生物利用率高的特点,为双重营养素。
由于L-α-氨基酸的特殊结构,可以接纳的金属离子是特定的[2]。通过人为控制条件,可以获得L-α-氨基酸金属螯合物,又由于L-α-氨基酸与L-α-氨基酸金属螯合物的结构是特定、稳定的,因而应用IR法对L-α-氨基酸与L-α-氨基酸金属螯合物合成的光谱图特征基团峰的变化可以快速表征,为生产控制提供依据。
传统生产L-α-氨基酸金属螯合物的方法是利用富含蛋白的动物材料,酸水解得到L-α-氨基酸,再与金属盐螯合,这种方法产率低,工艺控制困难,成本高,污染严重,分离纯化困难。
研究表明,可以在适当的工艺条件下先使蛋白质立体空间结构中的纵向联接被解离而得直链蛋白质,恰当的时间加金属离子,此时金属离子可把直链蛋白质分子中的L-α-氨基酸基团拖出而与之螯合成L-α-氨基酸金属螯合物,L-α-氨基酸与L-α-氨基酸金属螯合物的结构的特殊性与理化性质的差异性等,可应用IR法等快速表征所制备的产物,该方法工艺简单,制备和检测条件易于控制,产率高,可减少设备投入,降低能耗,无污染,容易分离纯化,缩短了工艺时间,很多富含蛋白质的农作物能得到有效利用。
为更好地研究复杂背景条件下L-α-氨基酸金属螯合物的制备,先制备出纯的L-α-氨基酸金属螯合物,研制出L-α-氨基酸金属螯合物的IR图,便于对照检测。
1 模型设计
1.1制备流程设计
按图1所示流程,研究制备的最佳条件。

图1 制备流程图
1.2单因素影响试验模型设计
1.2.1物料配比对螯合反应的影响
L-α-氨基酸与金属离子的配位比是影响螯合反应的重要因素。配体的浓度过低则螯合率不高,不能形成稳定的螯合结构,不能形成稳定的螯合物,且浪费金属盐;配位比太大则形成多配体螯合物,稳定性过高,微量元素难以被生物体吸收利用,同时也会造成氨基酸的浪费。故要求螯合反应既能达到一定程度的最小配位比以保证产品质量,又要能充分利用L-α-氨基酸。为探究螯合反应最佳原料配比,按照 L-α-氨基酸盐酸盐和金属盐摩尔比从 1∶ 1 到 4∶1对比合成实验,并对产物的量或螯合率进行了分析,确定单因素的最佳值,模型见表1。产物的量或螯合程度达到最大值时为螯合反应体系最佳物料配比。
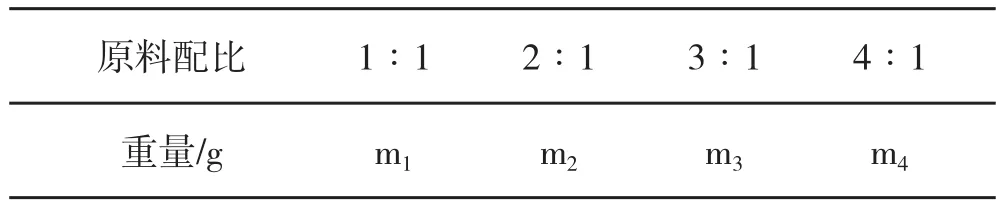
表1 物料配比对螯合反应的影响设计
1.2.2pH值对螯合反应的影响
螯合反应受酸碱条件的影响较大,在pH值较低的酸性条件下,由于酸效应的影响,体系中的氢离子将与金属离子竞争氨基酸提供的供电子基团,L-α-氨基酸难以解离,因而螯合困难;而在pH值较高的碱性条件下,金属离子则会发生水解,以氢氧化物的形式沉淀析出来。表2的对比合成实验(不同的原料,可增减)对产物的量或螯合程度进行了分析,确定单因素的最佳值。产物的量或螯合率达到最大值时的pH值为螯合反应体系最佳酸碱条件。
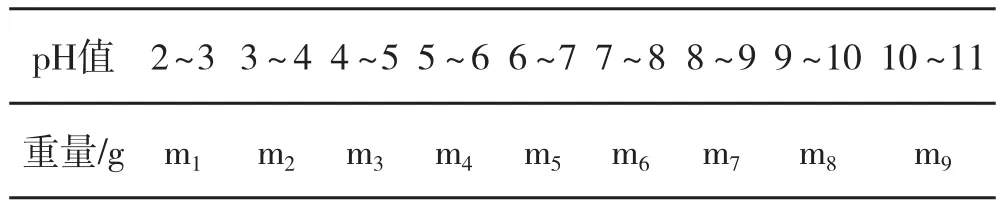
表2 pH值对螯合反应的影响
1.2.3反应温度对螯合反应的影响
温度的变化直接影响反应的速度和螯合的程度,L-α-氨基酸与金属离子螯合反应为吸热反应,因而反应温度越高对反应越有利,但温度太高容易破坏L-α-氨基酸及其螯合物;温度过低则反应速度较慢,产率较低。因此,设计不同温度的螯合反应见表3(不同的原料,可增减)进行分析。产物的量或螯合率达到最大值时的反应温度即为螯合反应体系的最佳反应温度。
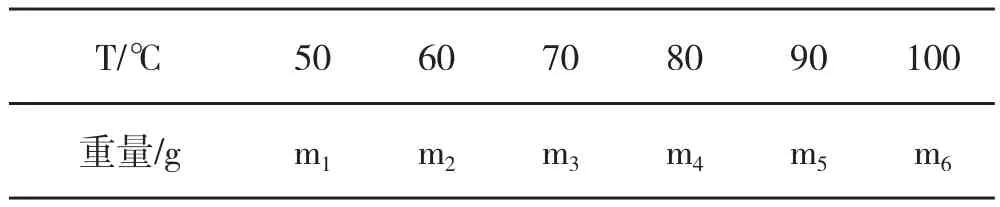
表3 反应温度对螯合反应的影响设计
1.2.4反应时间对螯合反应的影响
反应时间直接影响到螯合反应是否进行得完全,反应时间过短将导致反应不彻底,反应时间过长,产物复杂多变,而且造成浪费。当反应时间增加时,产物的产率也随之升高,在某一时间反应已基本完成,再延长时间对产率的影响不大,因此可确定最佳螯合反应时间。设计不同反应时间情况见表4(不同的原料,可增减)。产物的量或螯合率达到最大值时的反应时间为螯合反应体系最佳反应时间。

表4 反应时间对螯合反应的影响设计
1.2.5其它因素(如,抗氧化剂)对螯合反应的影响
由于有的金属离子容易被氧化,在反应过程中,需要加入抗氧化剂,可根据金属离子选择(如亚铁盐还原铁粉)。
1.3正交试验设计
采用物料配比A(n酸∶nM)、反应的PH值B、反应温度C(T/℃)、反应时间D(t/h),进行4因素3水平L9(34)正交试验设计,见表5。

表5 L-α-氨基酸金属螯合物制备的最佳条件设计
1.4产品分离纯化
根据原料及产品的结构及理化性质的差异采取适当的方法进行纯化。利用某溶剂来沉降纯化产品,控制单一溶剂或复合溶剂提取,或控制pH值分离纯化 ,或低温结晶等。
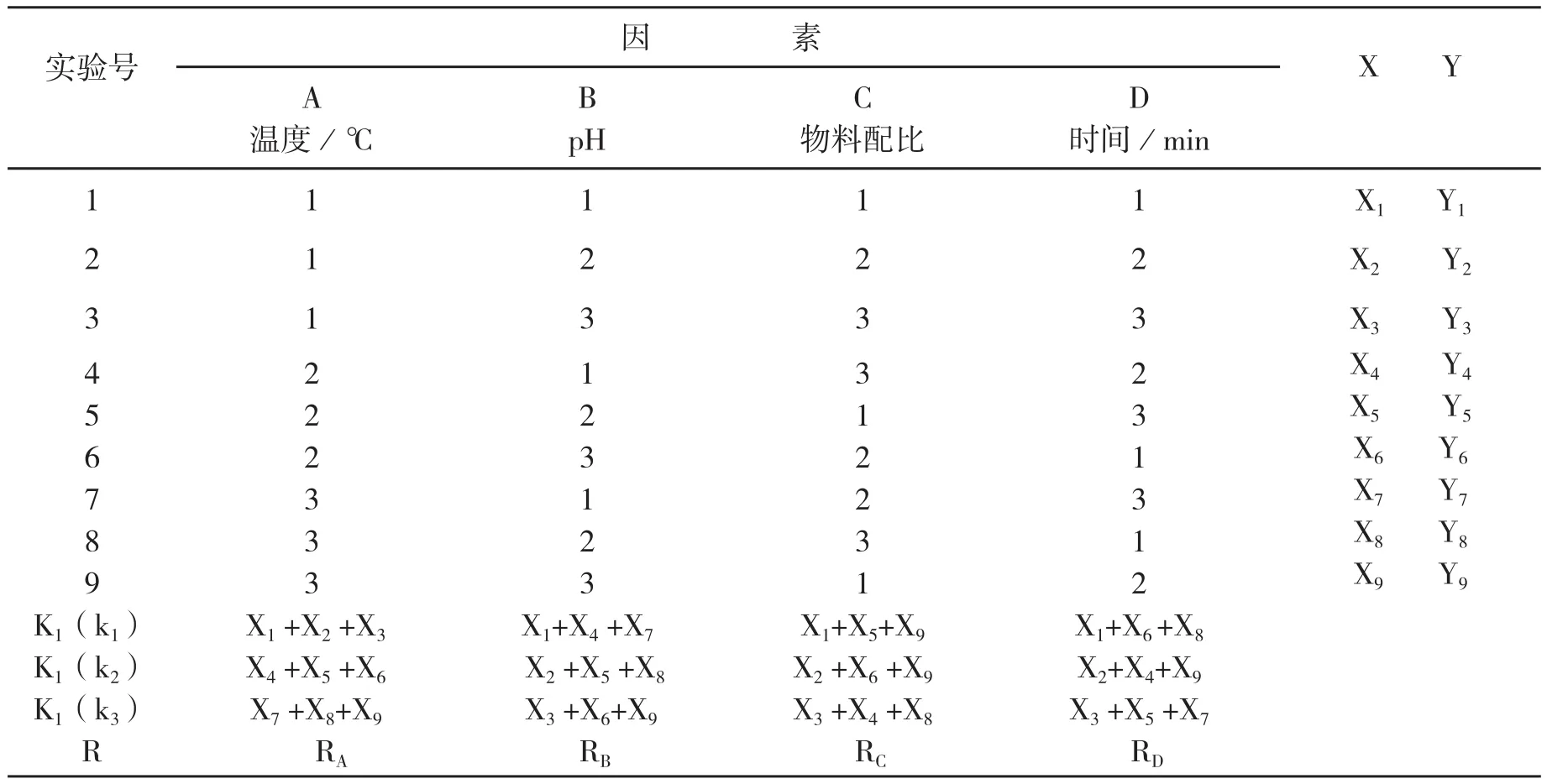
表6 正交试验方案
1.4表征研究
有机化合物的成键能级差决定了有机化合物的紫外吸收,共轭体系的能极差决定了有机化合物的红外吸收,有机化合物的极性决定了有机化合物的色谱性质,因而有机化合物特殊的结构决定了有机化合物的光谱吸收及色谱性,故可以用L-α-氨基酸特征的UV图、IR图以及色谱表征L-α-氨基酸。
根据L-α-氨基酸与L-α-氨基酸金属螯合物的结构的特殊性与理化性质的差异性等,应用IR法、UV法、薄层色谱法等表征所制备的产物。
各种L-α-氨基酸不同就在于R-不同,R-的大小、极性、吸电子、供电子等、NH2-与COO-的相互影响、COO-的吸电子等决定了有机化合物的各成键的能级差、共轭体系的能级差、有机化合物的极性等。
从L-α-氨基酸与金属盐螯合形成了L-α-氨基酸金属螯合物,L-α-氨基酸金属螯合物形成了特殊的螯合键,参见图2,因而影响了它的共轭体系的能级差,影响了各种成键的能级差,还影响着有机物的极性,因而改变了IR光谱图、UV光谱图、改变了薄层色性质。故比较L-α-氨基酸与某产物的IR光谱图、UV光谱图、薄层色谱,可以表征螯合物的形成。
本研究模型主要研究了IR法的表征。
红外光谱是由于分子的振动能级的跃迁而产生的,当物质吸收一定波长的红外光的能量时,就发生振动能级的跃迁。

图2 L-α-氨基酸转化为L-α-氨基酸金属螯合物
分子的振动有伸缩振动和弯曲振动两种类型。分子伸缩振动是紫外吸收,影响着羧基(COO-)的指成键原子沿着键轴的伸长或缩短(键长发生改变,键角不变),而弯曲振动是指键角改变的振动。
一个化学键的振动频率υ与化学键的强度κ及振动原子的折合质量μ有关,它们的关系式为:
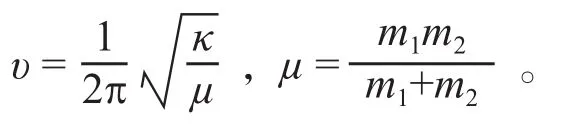
振动频率与成键原子折合质量倒数的平方根成正比,与键的力常数的平方根成反比。上述公式可以看出,吸收频率随键的强度的增加而增加,力常数越大即键越强,键振动所需要的能量就越大,振动频率就越高,吸收峰将出现在高波数区;相反,吸收峰则出现在低波数区。
化学键越强,原子越轻,IR的波数越高,越往可见光移动。 不同化合物中相同化学键或官能团的红外吸收频率近似一致。
2 实验结果
在该模型的指导下,以L-α-精氨酸螯合钙的合成为例,验证该模型。
2.1制备
2.1.1单因素对螯合率的影响
物料配比对螯合率的影响。选取不同L-α-精氨酸与氯化钙的物质的量比,于pH 7.0,60 ℃条件下螯合反应3 h。用无水乙醇沉淀后,测定反应体系中游离钙含量,并计算钙离子螯合率, 结果见表7。

表7 物料配比对螯合物的影响
由表7可知,随着L-α-精氨酸的用量不断增加,螯合后游离钙逐渐减少,螯合率逐渐增大。当L-α-精氨酸与钙离子的摩尔比为2∶1时,钙离子利用最充分,螯合率最高。若继续增加L-α-精氨酸的用量,则难于完全溶解。
pH对螯合率的影响。按L-α-精氨酸与钙含量摩尔比为2∶1,分别在不同pH条件下,在70 ℃螯合反应3 h。用无水乙醇沉淀产品后,测定反应体系中游离钙含量,并计算钙离子螯合率,结果见表8。

表8 pH对螯合率的影响
由表8可知,随着pH的增大,钙离子的螯合率先增大后减少。当pH为7.0时,钙离子的螯合率达到最大值;若继续增大pH,螯合环境引起副反应,钙离子螯合率降低,所以最适pH为7.0。
反应温度对螯合率的影响。按L-α-精氨酸与钙含量摩尔比为2∶1,于pH 7.0条件下,在不同温度下分别螯合3 h。用无水乙醇产品后,测定反应体系中游离钙含量,并计算钙离子螯合率,结果见表9。

表9 反应温度对螯合率的影响
由表9看出,随着螯合温度的增大,钙离子的螯合率先增大后减小。当螯合温度为70 ℃时,钙离子的螯合率达到最大值;若继续提高螯合温度,会引起螯合物的降解,导致钙离子螯合率降低,所以螯合的最佳温度为70 ℃。
反应时间对螯合率的影响 按L-α-精氨酸与钙含量摩尔比为2∶1,于pH 7.0条件下,在70 ℃下分别螯合不同时间。用无水乙醇沉淀产品后,测定反应体系中游离钙含量,并计算钙离子螯合率,结果见表10。

表10 反应时间对螯合率的影响
由表10看出,随着螯合时间的增大,钙离子的螯合率先增大后减小。当螯合时间为3 h时,钙离子的螯合率达到最大值;若继续增加螯合时间,可能由于搅拌作用引起螯合物的降解,导致钙离子螯合率降低,所以最适螯合时间为3 h。
2.1.2正交试验
为了进一步确定最佳反应条件,在单因素试验的基础上选取了反应温度、反应 pH、氯化钙与L-α-精氨酸物料配比、反应时间作为反应条件。选用L9(34)型正交表进行了正交试验。具体结果见表11、表12。

表11 正交设计的因素水平表

表12 正交试验的设计方案及实施结果
通过正交试验, 确定合L-α-精氨酸钙的最佳工艺条件为:C2B1D1A2,即反应温度为70 ℃,pH为6,反应物物料配比为n氯化钙∶ nL-α-精氨酸=1∶ 1 ,反应时间控制在2 h。
2.2表征研究
用KBr压片法测定L-α-精氨酸和产品在400~4000 cm-1的红外光谱,见表13和图 3所示。

表13 L-α-精氨酸与产品的红外光谱特征峰

图3 L-α-精氨酸与L-α-精氨酸钙的红外光谱图
由图3及表6知,O-H键消失,C-O、N-H等键的吸收峰都发生明显的变化,这说明—COOH和—NH2与Ca2+形成了配位键,发生了螯合反应。
3 结论
通过研究模型的建立,提供从大豆糟粕或花生糟粕等富含蛋白质的材料中制备出各种L-α-氨基酸、各种L-α-氨基酸金属螯和物的思路,通过消除背景干扰,可以快速、简便、可靠地用IR法表征所得到的产物。该研究模型的建立也可以为受物料、PH值、温度、时间等诸要素影响的天然产物的提取、纯化以及制备、合成、表征等的研究工作提供参考。
[1] 宁海龙,李文霞,潘相文,等.大豆氨基酸组分影响蛋白质含量的通径分析[J].大豆科学,2002(4):259-262.
[2] 朱中煌,李健民,张懋森,等.由阳离子半径估算氨基酸过渡金属螯合物的稳定常数[J].中国科学技术大学学报,1983(增):63-67.
A Study on the Model of Producing L-α- Amino Acid Metal Complexes
XU Huaichun, XIE Chengjun, LIU Jun
(School of Chemistry and Chemical Engineering, Wenshan University, Wenshan Yunnan 663099, China)
The paper studies the model of producing L-α- amino acid metal complexes with L-α- amino acid and metal salt. Material ratio, the optimal pH value, suitable temperature and the optimal reaction time are studied in the production process and the product are tested using infrared spectrometry based on the structural features and differences between their physical and chemical features of L-α- amino acid metal complexes. The study model of producing L-α- amino acid metal complexes and IR representation is made, which provides
for producing the complexes and their representation under the complex condition.
L-α- amino acid metal complexes; producing model
S816.72
A
1674 - 9200(2015)06 - 0044 - 05
(责任编辑 张铁)
2015 - 07 - 08
云南省教育厅科研基金项目“从大豆饼或花生饼中制备氨基酸金属螯合物”(2014Y475)。
徐怀春, 文山学院化学与工程学院教授。

