老瓜头耐盐内生真菌抗真菌活性筛选研究
刘悦 段海婧 刘成 吴秀丽 陈靖

摘要
[目的] 对荒漠植物老瓜头(Cynanchum komarovii Al. Iljinski)中以稻瘟霉模型初筛得到的耐盐内生真菌进行抗真菌活性复筛。[方法] 采用微量液基稀释法,以白假丝酵母菌、近平滑假丝酵母菌、光滑假丝酵母菌、新生隐球菌、石膏状小孢子菌、红色毛癣菌、烟曲霉菌等8株常见病原真菌为活性筛选菌株,进行抗真菌活性复筛,检测供试品的最低抑菌浓度(MIC)。[结果] 菌株5%-11对新生隐球菌有一定的抑制活性(MIC=32 μg/ml),其他菌株对8株常见病原菌的活性较弱(MIC>64 μg/ml)。[结论] 复筛得到一株对新生隐球菌有抑制活性的耐盐内生真菌。
关键词 老瓜头;耐盐;抗真菌;内生真菌;MIC
中图分类号 S188 文献标识码 A 文章编号 0517-6611(2015)03-012-03
Study on AntiFungi Efficacy of AntiSalt Endophytic Fungi Obtained from Cynanchum komarovii
LIU Yue1, DUAN Haijing2, LIU Cheng3, CHEN Jing1* et al
(1. Hui Medicine Modern Engineering Research Center, School of Pharmacy, Ningxia Medical University, Yinchuan, Ningxia 750004; 2. School of Pharmacy of Gansu University of Traditional Chinese Medicine, Lanzhou, Gansu 730000; 3. Science and Technique Center, Ningxia Medical University, Yinchuan, Ningxia 750004)
Abstract [Objective] This paper aimed to give a secondary screening on antifungal activities of antisalt endophytic fungi primarily obtained from Cynanchum komarovii by Magnaporthe grisea model. [Method] By the micro liquid dilution method, 8 common pathomycete strains were chose as active screening strains, namely Canidia albicans, Candida parapsilosi, smooth Candida mycoderma bacteria, Cryptococcus neoformans, Microsporum gypseum, Trichophyton rubrum, Aspergillus fumigatus, etc. Minimum inhibitory concentration (MIC) was determined. [Result] Strain 5%11 has an inhibition activity (MIC=32 μg/ml) on Cryptococcus neoformans, but other strains have a weak bioactivity or no efficacy on 8 pathomycete(MIC>64 μg/ml). [Conclusion] One antisalt endophytic fungous which has an inhibition effect on Cryptococcus neoformans was obtained by a secondary screening.
Key words Cynanchum komarovii; Antisalt; Antipathomycete; Endophytic fungus; MIC
基金项目 宁陕合作项目(细胞膜色谱法筛选老瓜头镇痛活性成分及提取工艺研究);2012年宁夏医科大学大学生创新创业训练计划项目(201210752003)。
作者简介
刘悦(1993-),女,四川汉源人,本科生,专业:药学。*通讯作者,教授,博士,从事沙生植物药效物质基础研究。
收稿日期 20141203
研究表明,植物内生真菌能够产生与宿主植物活性成分相同或相似的生物活性物质,其中存在大量具有抗菌活性、抗肿瘤活性、抗病毒活性及其他生物活性的次级代谢产物[1]。许多具有药理活性的内生真菌被陆续筛选出来,因此通过植物内生真菌筛选新颖、高效、低毒的生物活性物质具有巨大的潜力,为开发新的抗生素、抗菌药物及保护荒漠植物提供重要依据。大量研究表明,植物内生真菌代谢物具有抗菌作用。周生亮等[2]对5种药用植物内生真菌抑菌活性进行了研究,结果表明5种药用植物中共分离出124株内生真菌,其中37株内生真菌对一种或多种供试菌株有抑制作用,高抑菌活性菌株有11株。李治滢等[3]从川乌植物中分离得到61株内生真菌,有29株具有抗菌活性,其中抗菌谱广且活性高的有3株。李桂玲等[4]从三尖杉(Cephalotaxus fortunei Hook.f.)、南方红豆杉(Taxus Chinensis var. mairei)及香榧(Torreya grandis Merrillii)中分离出172株内生真菌,对其進行抗菌活性检测,结果表明90株内生真菌对一种或多种植物病原真菌等有抑制作用。赵春安等[5]从华凤仙(Impatiens chinensis L.)、问荆(Equisetum arvense L.)和轮叶狐尾藻(Myriophyllum verticillatum L.)3种植物中共分离到内生真菌155株,同时对其内生真菌代谢产物进行抗菌活性研究。结果表明,有37株内生真菌(占分离菌株总数的23.9%)显示出对一种或多种病原菌的抑菌活性。
在稻瘟霉模型活性初筛的基础上,采用微量液基稀释法,以白假丝酵母菌(Candida albicans)Y0109、白假丝酵母菌SC5314、近平滑假丝酵母菌(Candida parapsilosis)、光滑假丝酵母菌(Candida glabrata)、新生隐球菌(Cryptococcus neoformans)、石膏状小孢子菌(Microsporum gypseum)、红色毛癣菌(Trichophyton rubrum)、烟曲霉菌(Aspergillus fumigatus)等8株常见病原真菌为活性筛选菌株,进行抗真菌活性复筛,以筛选得到具有较强抗真菌活性的耐盐内生真菌。
1 材料与方法
1.1 试验材料
1.1.1
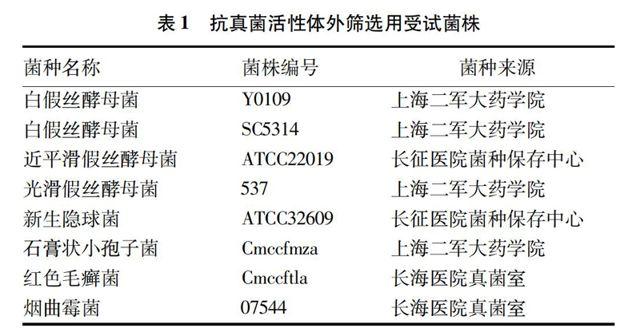
药材与试剂。受试菌株来源及编号见表1。
1.1.2
真菌培养基。RPMI 1640培养液组成为:RPMI 1640 10 g,吗啉丙磺酸34.5 g,NaHCO32.0 g,三蒸水1 000 ml,在25 ℃下用0.5 mol/L NaOH调pH至7.0,双层纱布过滤,4 ℃冰箱保存备用。
YEPD培养液组成为:酵母浸膏10 g,葡萄糖20 g,蛋白胨20 g,三蒸水1 000 ml,2 mg/ml氯霉素50 ml,121 ℃高压蒸汽灭菌30 min,4 ℃冰箱保存备用。
SDA培养基(沙堡葡萄糖琼脂)组成为:蛋白胨10 g,琼脂18 g,葡萄糖40 g,三蒸水1 000 ml,2 mg/ml氯霉素50 ml,调pH至7.0,115 ℃高压蒸汽灭菌30 min,4 ℃冰箱保存备用。
PDA培养基组成为:土豆200 g,琼脂20 g,葡萄糖20 g,水1 000 ml,121 ℃高压蒸汽灭菌30 min,4 ℃冰箱保存备用。
1.1.3
供试样品。前期筛选得到的11株抗稻瘟霉活性较强的菌株(D3、D4(Z)为非耐盐内生真菌,Z表示正丁醇层萃取物;5%-3、5%-5、5%-7、5%-8、5%-8(Z)、5%-9、5%-10(Z)、5%-11、5%-18)。
试剂及对照品有吗啉啉丙磺酸(Sigma);二甲基亚砜(DMSO,国药集团);琼脂(BIOSHARP);葡萄糖(天津市大茂化学试剂厂);蛋白胨(北京奥博星生物技术有限责任公司);酵母浸膏(上海西王淀粉糖有限公司);氟康唑(FCZ,二军大药学院有机化学教研室);ICZ(伊曲康唑,Sigma);VCZ(立康唑,Sigma);酮康唑(KCZ,二军大药学院有机化学教研室);特比萘芬(TBF,上海医工研究院)。
1.2 方法
采用美国临床实验室标准化研究所(Clinical and Laboratory Standards Institute,CLSI即原NCCLS)M38A2[6]和M27-A3[7]文件推荐的微量液基稀释法,进行抗真菌活性筛选,检测供试品对假丝酵母菌和丝状真菌的最低抑菌浓度(MIC)。
1.2.1
供试品的配制。供试品均用DMSO溶解成6.4 mg/ml母液,-80 ℃保存。
1.2.2
阳性对照品的配制。氟康唑2 mg/ml(母液浓度为1 280 μg/ml)注射液,-80 ℃保存备用;用DMSO溶解伊曲康唑、伏立康唑、酮康唑、特比萘芬,分别制成6.4 mg/ml母液,-80 ℃保存备用。
1.2.3
药敏板制备。在RPMI 1 640培养液中加入母液,充分振荡,混匀,稀释至640 μg/ml,备用。
1.2.4
MIC测定药敏板制备。将50 μl供试品和阳性对照品母液(6.4 mg/ml)加入到1 ml深孔板中(含RPMI 1 640培养液450 μl),充分混匀;将160 μl氟康唑母液,加入到1 ml深孔板(含RPMI 1 640培养液340 μl)中,充分混匀,得各药物浓度均为640 μg/ml测试液;10级倍比稀释,使其分别成为640、320、160、80、40、20、10、5、2.5、1.25 μg /ml 10个浓度的测试液。
分别取20 μl以上10个浓度的测试液,分装于96孔板每排2~11号孔内,制成药敏板,薄膜密封,-80 ℃保存备用。
1.2.5
真菌菌悬液制备。
1.2.5.1
酵母菌菌悬液制备。① 将受试菌株接种至SDA斜面,于30 ℃培养,活化2次;
②将活化好的菌株于SDA平皿上划线接种,35 ℃培养24 h;
③选取菌落直径>1 mm的菌落5个,溶解于灭菌后的三蒸水中,充分振荡15 s,使其成为菌悬液;
④在SDA斜面上加适量RPMI 1640培养液,用吸管吹打斜面,四层无菌纱布过滤,用血细胞计数板计数,调整菌悬液浓度至1×106~5×106CFU/ml(相当于麦氏浊度0.5)。计算公式为:菌悬液浓度=5个方格内细胞数×5×104;
⑤用RPMI 1640培养液将上述菌悬液稀释1 000倍,使其浓度在1×103~5×103CFU/ml之间。
1.2.5.2
丝状真菌菌悬液制备。
①将受试菌株接種于PDA培养基上,活化7 d,诱导分生孢子和孢囊孢子的形成;
②将浓度0.85%盐水1 ml(含有0.01 ml Tween 20)加入活化好的菌落上,制备菌悬液;静置3~5 min,使大颗粒完全沉淀后,取上层液体,用RPMI 1640培养液调整菌悬液浓度至2×106~1×107CFU/ml,计算公式为:菌悬液浓度=5个方格内孢子数×5×104;
③用RPMI 1640培养液将上述菌悬液稀释1 000倍,使其浓度在2×103~1×104CFU/ml之间。
1.2.6
接种。取药敏板,每排1号孔为空白对照,加200 μl RPMI 1640培养液;12号孔作阳性对照,不加药物,加200 μl新鲜配制的菌液;每排2~11号孔分别加180 μl菌液,供试品均10级4倍稀释,使各孔的药物最终浓度分别为64.000、32.000、16.000、8.000、4.000、2.000、1.000、0.500、0.250、0.125 μg/ml,各孔中DMSO含量均低于1%;H排为质控菌株近平滑念珠菌和氟康唑。
1.2.7
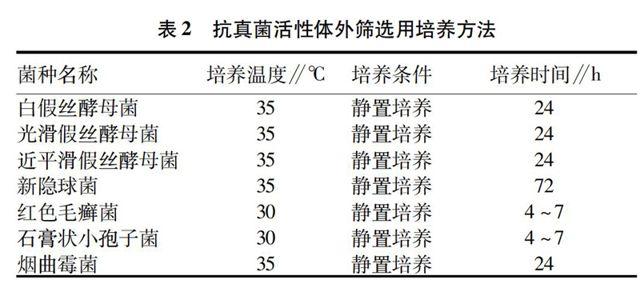
培养。各受试菌株采用不同条件的培养方法见表2。
1.2.8
结果判读方法。
1.2.8.1
吸光度判断法。用全自动酶标仪检测吸光度值。与阴性对照相比,吸光度值下降80%,即为药物MIC。
1.2.8.2
肉眼判断法。
读取MIC值,在阅读镜辅助下,将各受试孔中真菌的生长情况与对照孔相比,进行评分。4分示表示生长无抑制;3分示代表生长轻微减少或相当于对照品的75%;2分示表示生长明显减少或相当于对照品的50%;1分示表示轻微生长或相当于对照品的25%;0分示表示未见生长或肉眼观察澄清。
1.2.8.3
酵母菌。待筛选化合物MIC值判定为相当于生长对照有50%或更多的生长减少时的最低药物浓度(读数为2)。
氟康唑、伊曲康唑、伏立康唑、酮康唑和特比萘芬MIC值判定为相当于生长对照有50%或更多的生长减少时的最低药物浓度(读数为2)。
1.2.8.4
丝状真菌。供试品MIC值判定为生长相当于对照品的50%或更多的生长减少时的最低药物浓度(读数为2)。
待筛选化合物MIC值判定为相当于生长对照有50%或更多的生长减少时的最低药物浓度(读数为2)。
伏立康唑MIC值判定为没有可见生长的最低药物浓度(读数为0)。
氟康唑、伊曲康唑、酮康唑、特比萘芬MIC值判定为相当于生长对照有50%或更多的生长减少时的最低药物浓度(读数为2)。
结果判定的步骤为:首先进行吸光度测定,判断MIC,然后采用肉眼判定,以确认结果的可靠性。
安徽农业科学 2015年
1.2.8.5
质量控制。每块药敏板第H行为质控菌株和质控化合物,其目的在于监测药敏试验的准确度、精密度、所用试剂、测试条件以及仪器的情况,以保证试验者的操作以及结果的准确客观。质控化合物采用氟康唑,质控菌株采用近平滑念珠菌ATCC22019。
近平滑念珠菌ATCC22019 MIC参考值见表3。只有当MIC值在下述范围内,方可认为试验操作准确,试验数据可靠。当试验菌株也生長良好时,可认为试验成功,结果准确可靠。
2 结果与分析
11种供试品对8株常见致病真菌的MIC值见表4。菌株5%-11对新隐有一定的抑制活性(MIC=32 μg/ml)。
表4 系列化合物对常见致病真菌体外活性
μg/ml
化合物Y0109SC5314近平22019新隐32609光滑537烟曲07544红毛石小
D3>64>64>64>64>64>64>64>64
5%-3>64>64>64>64>64>64>64>64
D4(Z)>64>64>64>64>64>64>64>64
5%-5>64>64>64>64>64>64>64>64
5%-7>64>64>64>64>64>64>64>64
5%-8>64>64>64>64>64>64>64>64
5%-8(Z)>64>64>64>64>64>64>64>64
5%-9>64>64>64>64>64>64>64>64
5%-10(Z)>64>64>64>64>64>64>64>64
5%-11>64>64>6432>64>64>64>64
5%-18>64>64>64>64>64>64>64>64
ICZ111111≤0.1250.25
TBRL64>6420.540.25≤0.125≤0.125
KCZ≤0.125≤0.1250.250.50.254≤0.1251
VCZ≤0.125≤0.125≤0.125≤0.1250.250.25≤0.125≤0.125
FCZ≤0.1250.25221>64132
3 讨论
植物内生真菌的次生代谢过程具有复杂性与灵活性,故而产生一些结构新颖、具有独立生物活性成分的物质,缓解由植物资源短缺而引起的生态平衡紊乱。目前,关于药用荒漠植物内生真菌的研究较少,因而植物内生真菌成为应用前景非常广阔的微生物资源。相关研究将有利于我国天然产物、生药、微生物药物的开发和稀有珍稀药用植物资源的保护与利用。
该研究采用CLSI推荐的微量液基稀释法,首次对荒漠植物牛心朴子内生真菌及耐盐内生真菌发酵液乙酸乙酯萃取物及正丁醇萃取物以白假丝酵母菌、近平滑假丝酵母菌、光滑假丝酵母菌、新生隐球菌、石膏状小孢子菌、红色毛癣菌、烟曲霉菌等8株常见病原真菌为活性筛选菌株,选择初筛得到的11株抗稻瘟酶活性较强的内生真菌发酵液萃取物进行抗真菌活性复筛。复筛结果表明,除了5%-11对新生隐球菌有抑制作用之外,其他10个萃取物的抗真菌活性均较弱。这可能与菌种的选择有关。郭蕾等[8]從粗疣合叶苔中分离得到内生真菌47株,以稻瘟霉孢子形态异常或生长抑制为活性指标,进行活性初步筛选,得到40株有活性的菌株,占总分离菌株的85.1%。经过多次反复筛选得到活性较好的8株,进一步采用微量液基稀释法,以白色念珠菌、新生隐球菌、红色毛癣菌、薰烟曲霉菌作为受试菌株,考察8株菌的抗真菌活性,结果显示大多菌株都有较好的抗病原真菌作用,且活性强于原植物本身。徐丽莉等[9]从5年生园参和15年生移山参中分离得到内生真菌48株,其中16株能完全抑
制稻瘟霉活性。采用微量液基稀释法,以白色念珠菌、新生隐球菌、红色毛癣菌、薰烟曲霉菌为受试菌株,对这16株菌株进行抗真菌活性检测,其中11株有较好的抗真菌活性。后期研究拟更换病原真菌,进一步进行抗真菌活性的复筛,以寻找到活性较强的耐盐内生真菌,为替代资源研究奠定基础。
参考文献
[1]
FROHLICH J,HYDE K D.Palm Microfungi,Fungal Diversity Research Series[M].Hong Kong:Fungal Diversity Press,2000:3.
[2] 周生亮,陈才法,房兴堂,等.5种药用植物内生真菌的分离及其抑菌活性的研究[J].徐州师范大学学报:自然科学版,2007,25(4):69-72.
[3] 李治滢,陈有为,吴少华,等.川乌植物内生真菌抗菌活性的研究[J].天然产物研究与开发,2009,21(4) :676-678,701.
[4] 李桂玲,王建锋,苏文金,等.几种药用植物内生真菌抗真菌活性的初步研究[J].微生物学通报,2001,28(6):64-68.
[5] 赵春安,罗珊珊,李海燕,等.三种水生植物内生真菌多样性及其抗真菌活性[J].微生物学通报,2009,36(9):1305-1310.
[6] Clinical and Laboratory Standards Institute/National Committee for Clinical Laboratory Standards:Reference method for broth dilution antifungal susceptibility testing of Yeast.Approved Standard,edn 3; Document M38-A2[M].Wayne,PA:Clinical and Laboratory Standards Institute,2008.
[7] Clinical and Laboratory Standards Institute/National Committee for Clinical Laboratory Standards:Reference method for broth dilution antifungal susceptibility testing of Yeast.Approved Standard,edn 3; Document M27-A3[M].Wayne,PA:Clinical and Laboratory Standards Institute; 2009.
[8] 郭蕾,吴锦忠,秦路平,等.利用稻瘟霉模型筛选粗疣合叶苔内生真菌中的活性菌株[J].中草药,2009,40(7):1090-1094.
[9] 徐丽莉,韩婷,秦路平,等.人参内生真菌的分离及其体外抗真菌、抗肿瘤活性[J].第二军医大学学报,2009,30(6):699-702.

