板栗壳中多酚的提取纯化及其抑制α-葡萄糖苷酶活性的研究
刘 莉,唐新玥,张欣珂,王珺璟,欧阳杰,*(1.北京林业大学生物科学与技术学院食品科学与工程系,北京100083;2.林业食品加工与安全北京市重点实验室(北京林业大学),北京100083)
板栗壳中多酚的提取纯化及其抑制α-葡萄糖苷酶活性的研究
刘莉1,2,唐新玥1,2,张欣珂1,2,王珺璟1,2,欧阳杰1,2,*
(1.北京林业大学生物科学与技术学院食品科学与工程系,北京100083;2.林业食品加工与安全北京市重点实验室(北京林业大学),北京100083)
以板栗壳为原料,经回流提取、浓缩、萃取和大孔树脂吸附洗脱,提取纯化多酚并研究其对α-葡萄糖苷酶的抑制作用。大孔吸附树脂的静态吸附动力学曲线表明,AB-8对板栗壳中多酚的吸附效果明显,达到了4.41mg/g。静态解吸实验表明,当乙醇体积分数60%时解吸的效果最好,能达到95%以上;而pH对解吸的效果影响不大。由动态解吸曲线得到流速对解吸的效果影响较小。多酚洗脱曲线和对α-葡萄糖苷酶抑制率曲线的峰值重叠性较好,说明多酚能有效抑制该酶的活性,抑制率最大达到21.78%。
板栗壳,多酚,α-葡萄糖苷酶,抑制
板栗壳为壳斗科植物栗(Castanea mollissima Bl)的外果皮,其药理作用主要有抗菌、抗炎、抗凝血、治疗慢性支气管炎和治疗菌痢等。板栗壳中含有酚类、有机酸、糖、多糖、黄酮、植物甾醇和鞣质等化学成分[1]。其中,板栗壳中的黄酮具有很好的抑菌效果,多酚具有较高的抗氧化能力[2-5]。
α-葡萄糖苷酶存在于人体肠道,能将食物中的碳水化合物降解为单糖,从而加速机体对糖的吸收,显著提升人餐后的血糖含量,因此它与糖尿病和肥胖症紧密相连。α-葡萄糖苷酶抑制剂通过竞争性抑制小肠粘膜上皮细胞的α-葡萄糖苷酶,延缓肠道对碳水化合物的吸收,减缓餐后血糖升高而达到对糖尿病的治疗[6-7]。目前已研发出以α-葡萄糖苷酶抑制剂为基础的药物有Acarbose和M iglitol等,多种中药提取物也表现出对α-葡萄糖苷酶有明显的抑制作用[8]。有研究指出多酚类物质能有效地抑制α-葡萄糖苷酶的活性[9],但关于从板栗壳中分离出具有抑制α-葡萄糖苷酶活性物质的研究报道较少。本文以板栗壳为原料,经过回流提取、浓缩、萃取和大孔树脂吸附洗脱,提取对α-葡萄糖苷酶有抑制作用的多酚,为板栗壳的进一步加工利用和相关抗糖尿病功能食品开发奠定基础。
1 材料与方法
1.1材料与仪器
板栗壳河北迁西板栗,品种为早丰;福林酚试剂、α-葡萄糖苷酶(30000U/g) 北京化学试剂公司;没食子酸、无水乙醇、石油醚(60~90℃)、氯仿、乙酸乙酯、正丁醇等均为分析纯,北京化学试剂公司;对硝基苯-α-D-吡喃半乳糖苷(PNPG)、AB-8北京化学试剂公司。
Rotavapor R-210旋转蒸发仪广州艾欣科学仪器有限公司;POWERDRY LL1500真空冷冻干燥箱深圳市三诺仪器仪表有限公司;Bio-Rad 680酶标仪美国Bio-Rad公司;752紫外可见分光光度计上海美谱达仪器有限公司;HC-0110-02 10mm×200mm普通层析柱上海锦华层析设备厂。
1.2测定方法
1.2.1α-葡萄糖苷酶抑制活性的测定方法以PNPG水解产生PNP的量作为α-1,4-葡萄糖苷酶活性大小的判定标准。测定时,取40μL 120U/m L的α-葡萄糖苷酶溶液和10μL洗脱后的样品预混,在37℃下预混10m in。后加入20μL 10mmol/L的PNPG开始反应,整个反应在37℃的恒温中持续30m in。之后加入100μL的0.1mol/L Na2CO3终止液,5min后于波长405nm处测定吸光度值。酶活力单位定义为在37℃、pH6.8条件下,1m in内水解PNPG释放1μmol对硝基酚(PNP)所需的酶量[10]。抑制剂活力单位定义为在相同条件下降低1个酶活力单位所需的抑制剂量。抑制率(%)=[(A-B)-(C-D)]/[A-B]×100,式中,A为未加提取物样品的加酶混合液所测的吸光度;B为未加提取物样品亦未加酶的混合液所测的吸光度;C为加提取物样品和酶的混合液所测的吸光度;D为加提取物样品而未加酶的混合液所测的吸光度。
1.2.2多酚的测定方法取2mg没食子酸加水定容于100m L,得0.02mg/m L溶液,分别取1.0、2.0、3.0、4.0、5.0m L于试管中,加入0.5m L福林酚,1.5m L 1.89mol/L的Na2CO3,定容至10m L,混匀后于75℃反应10min,冷却后于760nm处测吸光度值。以没食子酸浓度为横坐标,吸光度值为纵坐标,绘制没食子酸标准品的标准曲线[11]。线性回归后得方程:y=84.643x-0.04,R2= 0.9978,线性范围为0~0.015mg/m L。取待测液按上述方法测吸光度值,由标准曲线可计算出待测液中多酚的浓度。
1.3板栗壳多酚粗提物的制备方法
将板栗壳洗净、烘干后粉碎,按料液比1∶12(W/V)加75%乙醇回流提取4h,减压过滤后得到板栗壳提取液。减压浓缩得到浸膏,加水定容后依次用石油醚、氯仿、乙酸乙酯、水饱和正丁醇进行萃取[12]。萃取完后用旋转蒸发仪分别浓缩各萃取部分,冷冻干燥成粉末后保存备用。
1.4大孔吸附树脂分离纯化多酚物质
1.4.1树脂预处理将AB-8[13]和D101[14]树脂用无水乙醇浸泡24h后,用蒸馏水洗至无醇味。用1.0mol/L HCl浸泡3h后用蒸馏水洗至中性,再用0.5mol/L NaOH浸泡3h,用蒸馏水洗至中性。
1.4.2静态吸附实验
1.4.2.1AB-8和D101树脂对多酚的最大吸附量取AB-8和D101树脂各1g于锥形瓶中,加入50m L 0.46mg/m L的样品液进行吸附;间隔一定时间取0.5m L样品溶液进行多酚含量的测定,可得到吸附多酚的最大吸附量。
1.4.2.2洗脱液浓度对解吸率的影响取AB-8树脂1g于锥形瓶中,加入50m L 0.46mg/m L的样品液进行吸附。吸附6h后取出0.5m L测定多酚的含量。减压抽滤后将吸附好的树脂放入锥形瓶中,分别用30%、40%、50%、60%、70%、80%乙醇25m L进行静态解吸。1h后取出0.5m L进行多酚含量的测定,得到不同浓度洗脱液的解吸率。
1.4.2.3洗脱液pH对解吸率的影响取AB-8树脂1g于锥形瓶中,加入50m L 0.46mg/m L的样品液进行吸附。吸附6h后取出0.5m L测定多酚的含量。减压抽滤后将吸附好的树脂放入锥形瓶中,分别用pH为3、4、5、6、7、8的60%乙醇溶液25m L进行静态解吸,1h后取出0.5m L进行多酚含量的测定,得到不同pH洗脱液的解吸率。
1.4.3洗脱液流速对动态洗脱的影响将预处理好的AB-8树脂加适量蒸馏水浸泡后进行湿法装柱,装柱完后分别用4BV的去离子水和3BV 10%的乙醇冲洗,洗去杂质,静置30min。分别用浓度为1mg/m L的样品溶液13m L进行上样,上样完毕后静置30m in。分别用60%的乙醇以1、2、3BV/h的流速进行洗脱,每2m L接一管,测定多酚的含量,绘制不同流速洗脱液的动态洗脱曲线。
1.4.4多酚的洗脱曲线和对α-葡萄糖苷酶的抑制活性曲线根据优化后的条件,将板栗壳提取液的水饱和正丁醇部分在AB-8树脂上样,用60%的乙醇以3BV/h的流速进行洗脱,每4m L接一管,测定多酚的含量以及对α-葡萄糖苷酶的抑制活性,绘制动态洗脱曲线。
1.5数据统计方法
所有实验重复三次,采用SPSS 17.0进行显著性分析。
2 结果与讨论
2.1板栗壳多酚粗提物的制备
板栗壳用75%乙醇回流提取后的提取液中多酚含量为0.054g/g。将所得浸膏分别用石油醚、氯仿、乙酸乙酯、水饱和正丁醇进行萃取,将收集的萃取液脱去溶剂后,再分别进行多酚含量测定。结果显示,石油醚、氯仿、乙酸乙酯萃取部分多酚含量都为0,而水饱和正丁醇萃取部分多酚含量为0.292g/g,因此用正丁醇萃取部分用于大孔树脂的分离纯化。
2.2大孔吸附树脂对板栗壳多酚粗提物的分离纯化
将水饱和正丁醇部分的萃取液用乙醇配制成0.46mg/m L,进行大孔吸附树脂的静态和动态吸附实验。
2.2.1大孔吸附树脂对板栗提取物中多酚的静态吸附实验大孔吸附树脂D101和AB-8对多酚均有较好的吸附效果,两种树脂在5h内基本吸附饱和。树脂静态吸附动力学曲线显示,AB-8树脂对多酚的饱和吸附量是4.41mg/g,D101树脂对多酚饱和吸附量为3.58mg/g。在有关对板栗苞多酚的吸附实验中,AB-8树脂的效果也较好[15]。
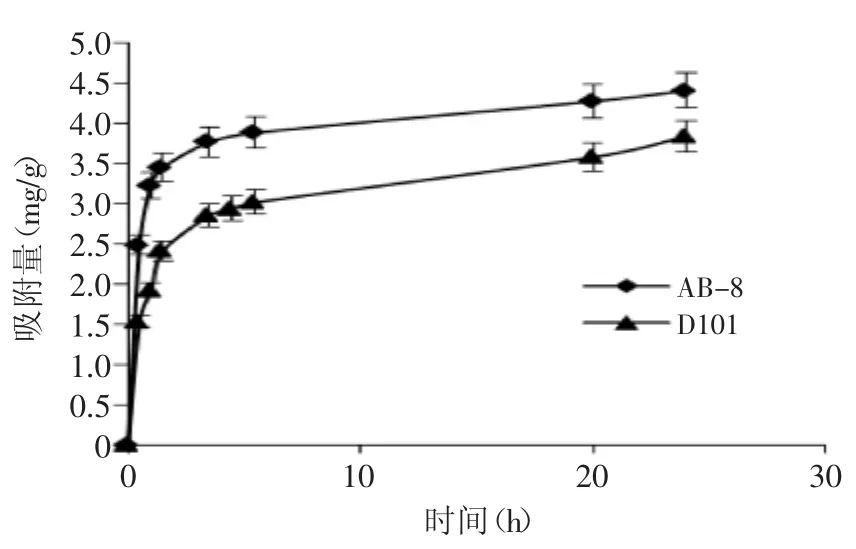
图1 大孔吸附树脂对多酚静态吸附动力学曲线Fig.1 The adsorptive kinetics curves of polyphenols of macroporous resin
2.2.2解吸液乙醇浓度对静态吸附的影响如图2所示,当乙醇浓度分别为60%、70%、80%时,它们之间的解吸效果没有显著性差异(p>0.05),但均显著高于50%乙醇解吸液(p<0.05),为节约成本,选取60%的乙醇用于AB-8树脂的动态洗脱。石恩慧等研究发现,从板栗总苞中提取纯化多酚用70%乙醇解吸液效果最优[16],和本实验结果接近。
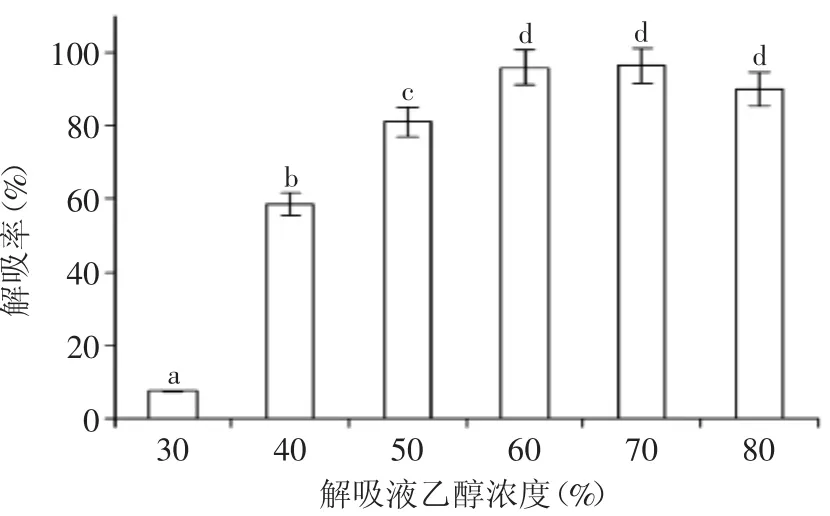
图2 解吸液乙醇浓度对解吸的影响Fig.2 The influence of ethanol concentration on the desorption rate
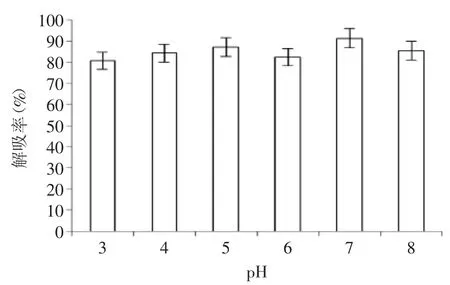
图3 pH对解吸的影响Fig.3 The influence of pH on the desorption rate
2.2.3解吸液pH对静态吸附的影响从图3可知,pH 3~8之间的解吸液的解吸效果不存在显著性差异(p>0.05),解吸液的pH对静态吸附的影响较小。板栗壳中多酚多为黄酮类,黄酮类属于中性酚类[17],其溶解度和化学性质受pH的影响小,因此在不同pH的溶液中吸附作用波动不大。
2.2.4流速对动态洗脱影响从图4可以看出,在多酚的洗脱中,随着流速的增加,洗脱的峰形无太大变化,且都无滞后,无拖尾现象,说明流速对实验洗脱效果没有太大影响。因此,选取3BV/h的流速来进行动态洗脱。

图4 多酚动态吸附实验Fig.4 Dynamic desorption curves of polyphenols
2.3大孔树脂分离纯化多酚及α-葡萄糖苷酶抑制活性测定
按照上述优化条件用AB-8树脂进行多酚的吸附洗脱,每4m L/管收集洗脱液,并对多酚含量和对α-葡萄糖苷酶的抑制活性进行检测,结果如图5所示。多酚洗脱峰和抑制率的峰值重叠性较好,洗脱液体积16、20m L处多酚的含量分别为0.063、0.036mg/m L,抑制率分别为20.59%、21.78%,说明多酚能有效抑制α-葡萄糖苷酶的活性。多酚的降血糖作用也在其他天然提取物如茶叶中得到证实[18]。

图5 洗脱液多酚含量及其抑制率Fig.5 The concentration of polyphenols and inhibition rate in eluent
3 结论
板栗壳乙醇提取液中多酚含量为0.054g/g,正丁醇萃取部分多酚含量为0.292g/g。采用大孔吸附树脂AB-8对提取物进行分离纯化,乙醇浓度对解吸影响较大,60%(v/v)的乙醇溶液解吸效果较好;而洗脱液pH和洗脱流速对解吸影响不大。洗脱液中,多酚类物质和抑制率的峰值部分重叠性较好,说明多酚是有效抑制α-葡萄糖苷酶的活性的成分。进一步的实验将进行板栗壳中多酚的放大洗脱、分离纯化、多酚类物质的结构分析和对α-葡萄糖苷酶活性的抑制机理等进行研究。
[1]赵德义,高文海,花成文,等.板栗壳化学成分的初步研究[J].陕西林业科技,2003(2):1-3.
[2]段蕊,张俊杰.板栗壳棕色素的纯化和初步定性[J].淮海工学院学报,2000,9(3):63.
[3]李云雁,宋光森.板栗壳色素的提取及其主要成分定性分析[J].广州食品工业科技,2003,19(3):11-12.
[4]李云雁,宋光森.板栗壳提取物抑菌作用研究[J].林产化学与工业,2004,24(4):62-64.
[5]李金凤,段玉清,马海东.板栗壳中多酚的提取及体外抗氧化性研究[J].林产化学与工业,2010,30(1):54-58.
[6]李玉萍,白冰.α-葡萄糖苷酶抑制剂的制备和活性研究进展[J].食品科学,2008,29(9):617-620.
[7]Inzucchi S E.Oral antihyperglycemic therapy for type 2 diabetes[J].The Journal of the American Medical Association,2002,287(3):364.
[8]杨倩,张茜,张德甫,等.11味中药提取物中α-葡萄糖苷酶抑制剂的筛选[J].时珍国医国药.2011,22(12):3011-3012.
[9]SalesPM,Souza PM,SimeoniLA,etal.α-Amylase inhibitors:A review of raw material and isolated compounds from plant source[J].Journal of Pharmacy&Pharmaceutical Sciences,2012,15(1):141-183.
[10]吴酬飞,许杨,李燕萍.α-葡萄糖苷酶抑制剂筛选模型的研究进展[J].国际药学研究杂志,2008,35(1):9-12.
[11]龚文菲,王铁山,林敬明.小油桐叶中总多酚的含量测定[J].南方医科大学学报,2010,30(6):1321-1322.
[12]席芳.板栗壳化学成分的研究[D].郑州:郑州大学,2007.
[13]李红.大孔树脂对花生壳多酚吸附实验的研究[D].长春:吉林大学,2013.
[14]周向军,高义霞,张慧芳,等.大孔吸附树脂纯化乳苣多酚的研究[J].食品工业科技,2012,33(12):281-288.
[15]石恩慧.板栗总苞多酚的提取、纯化及其抗氧化性能研究[D].北京:北京农学院,2013.
[16]石恩慧,李红,谷明灿,等.板栗总苞多酚纯化工艺优化及其对细胞活力的影响[J].中国食品学报,2013,13(6):134-139.
[17]Valles BS,Victorero JS,Alonso JM,etal.High-performance liquid chromatography of the neutral phenolic compounds of low molecular weight in apple juice[J].Journal of Agricultural and Food Chemistry,1994,42:2732-2736.
[18]陈静,程永强,刘晓庆.食品中α-葡萄糖苷酶抑制剂的研究进展[J].食品科学,2007,28(4):360-363.
Extraction of polyphenols from chestnut shelland the bioactivity of inhibitingα-glycosidase
LIU Li1,2,TANG Xin-yue1,2,ZHANG Xin-ke1,2,WANG Jun-jing1,2,OUYANG Jie1,2,*
(1.Departmentof Food Science and Engineering,College of Biological Science and Technology,Beijing Forestry University,Beijing 100083,China;2.Beijing Key Laboratory of Forest Food Processing and Safety,Beijing Forestry University,Beijing 100083,China)
Polyphenols were extrac ted and purified by boiling reflux,vacuum concentration,liquid-liquid extraction and macroporous adsorp tive resin elution from Chinese chestnut shells,and the inhibiting effect onαg lycosidase was investigated.The static adsorp tion kinetic curves showed that AB-8 had good adsorp tion on polyphenols w ith the capacity of 4.41mg/g.The desorp tion rate reached above 95%w ith 60%(v/v)ethanol as eluent.The eluent pH and flow rate had low effects on the desorp tion rate.There was good overlap between elution curve of polyphenols and inhibition rate,which indicated that polyphenols could inhibit the ac tivity of α-g lycosidase effectively,and themaximal inhibition rate reached 21.78%.
chestnut shell;polyphenol;α-g lycosidase;inhibition
TS209
B
1002-0306(2015)06-0265-04
10.13386/j.issn1002-0306.2015.06.050
2014-07-02
刘莉(1991-),女,大学本科,研究方向:农产品加工及贮藏工程。
欧阳杰(1971-),男,博士,副教授,研究方向:农产品加工及贮藏工程。
国家林业公益性行业科研专项(201204401);2012年北京市大学生科学研究与创业行动计划项目(121002221)。

