NaN3处理马齿苋种子的最适剂量与叶绿素荧光辅助筛选的方法
王瑞聪等

摘要:以不同剂量NaN3处理马齿苋种子,从种子萌发、植株生长、光合性能的角度确定最适NaN3处理剂量,并分析以叶绿素荧光动力学方法辅助筛选的可行性。结果表明,1.0 mmol/L NaN3处理8 h或0.5 mmol/L NaN3处理12 h均可显著提高种子萌发率和萌发质量,而更高浓度、更长时间的处理则使萌发率和萌发质量逐渐下降;根据长势初筛后的各处理组种子萌发苗,其株高均高于对照或与对照相当,单叶面积(2.0 mmol/L NaN3 8 h处理组除外)则低于对照;各处理组叶片PSⅡ的潜在和实际光化学效率普遍高于对照(其中2.0 mmol/L NaN3 8 h处理组最高),但除2.0 mmol/L NaN3 8 h处理组外,各组对高光强的抵御能力,特别是快速保护能力均有所下降。2.0 mmol/L NaN3 8 h处理组中马齿苋种子获得植株的株型最高、单叶面积最大、潜在和实际光化学活性最强、抵御强光胁迫能力最强。可见,以2.0 mmol/L NaN3处理8 h是马齿苋种子的最适处理条件,而采用叶绿素荧光动力学分析技术可实现对当代植株光合能力、高光强抗性的无损伤分析,极有利于提高筛选效率。
关键词:马齿苋;NaN3;种子萌发;生长;叶绿素荧光
中图分类号:S335;Q945.34文献标志码: A文章编号:1002-1302(2015)09-0224-05
马齿苋(Portulaca oleracea)别称马齿菜、长生菜、五行草等,为马齿苋科(Portulacease)马齿苋属(Portulaca)的一年生肉质草本植物。马齿苋的蛋白质、总黄酮含量高,氨基酸种类齐全,富含ω-3不饱和脂肪酸、钾元素,并含有去甲肾上腺素、褪黑激素等多种保健营养成分,具有改善血液循环、提高人体免疫力、防治心血管疾病、抑制微生物生长等多重功效[1-3]。此外,马齿苋对高温、干旱、高湿、高盐、重金属污染等逆境的抵抗能力强大,且是优良的生态修复植物[4]。马齿苋集保健、食用、药用、生态价值于一身,具有进一步研究开发的意义。
我国马齿苋主要以野生状态存在,其株形匍匐、分枝多、抗白粉病能力弱、主要生长于盛夏高温季节等原因限制了马齿苋的开发应用及推广。为改善这一现状,须筛选并培育出株形高大、生长旺盛、适应范围广的马齿苋新种质。诱变育种是获得新种质最常见的方法,而由于化学诱变操作简便、对设备依赖程度低等原因,使其在该领域占有重要地位[5]。化学诱变多为隐性突变,遗传变异须在诱变后的子一代甚至子二代中才能被检出[6-7],使得诱变育种的最大工作量集中于筛选,而寻找简便有效的筛选方法始终是诱变育种的主题和难题。传统研究中多数选择半致死剂量(LD50)作为诱导最适剂量[8],或以子一代、子二代的叶色变化代表诱变率来筛选最适剂量,并直接对目标性状进行筛选。近年来得以发展的RAPD、SRAP多态性等分子生物学方法,对于从遗传学角度辅助确立最适剂量,以及确定是否发生了可稳定的突变发挥着越来越大的作用。但由于致死不与诱变直接相关,叶色异常、DNA指纹图谱等不与目标优良性状直接相关,且RAPD、SRAP等方法步骤繁琐、耗时耗材,致使诱变剂量的确定及后续突变株的筛选成为诱变育种中最关键、最耗时的步骤。
近年来得以发展的叶绿素荧光动力学技术,可快速、高效、无损伤地检测植物的实际和潜在光合能力、抗逆境胁迫能力等,从而在光合、生态、品种筛选上发挥着越来越大的作用[9-10]。诱变育种中对目标性状筛选前,先利用叶绿素荧光动力学技术将正常及逆境条件下光合能力增强的植株筛选出,将便于长势旺盛的突变株及目标株系的筛选,极大减少目标性状筛选的工作量。而关于叶绿素荧光动力学技术辅助筛选突变株的报道尚较少。
NaN3具有高效、低毒、价廉、使用安全等优点,是一种常用的化学点突变诱变剂[11-12]。本研究在不同处理浓度、处理时间下以NaN3处理马齿苋种子,通过综合比较种子萌发速度、萌发质量、诱变当代植株的形态和长势、叶绿素荧光动力学参数等,得到最佳的NaN3处理浓度和处理时间,并初步筛选植株高、长势旺盛、抗逆能力强的潜在优良植株,为叶绿素荧光动力学技术在诱变育种中的进一步应用提供参考。
1材料与方法
马齿苋种子于2012年9月下旬采自南京师范大学生命科学学院植物园。试验分为2个部分,即分析NaN3处理对马齿苋种子萌发的影响;比较经NaN3处理后各组幼苗生长、光合性能的变化。
1.1种子萌发
选择饱满、整齐的种子并均分为10组,每组设3个重复。各组分别用0.0、0.5、1.0、1.5、2.0 mmol/L NaN3溶液(pH值为4)浸种8、12 h,并用清水冲洗30 min,其中8 h处理组须再用清水浸种4 h以达到12 h的最佳浸种时间[11]。参照杨子仪等的培养皿滤纸法[13],于CONVIRON A-1000型人工智能生物物候培养箱[14 h/10 h(L/D),32 ℃/28 ℃,照度300 μmol/(m2·s),相对湿度(RH) 65%]中萌发种子并记录萌发种子数,萌发结束时每组随机选取20棵幼苗测定其胚根与下胚轴的长度,并计算发芽率、发芽指数、活力指数。
1.2幼苗培养
将萌发的芽苗移入Jiffy泥炭育苗块中,置于CONVIRON A-1000型人工智能生物物候培养箱[14 h/10 h(L/D),32 ℃/28 ℃,照度300 μmol/(m2·s),RH 65%]中培养。10 d后筛选长势优良的幼苗20株并继续培养,待幼苗长至约15 cm时对各植株进行叶绿素荧光相关指标的测定;45 d时测定各植株的生长相关指标,并在生长后期种子成熟时收集种子。
1.3叶绿素荧光参数的测定
利用FC-1000-H型便携式叶绿素荧光成像系统进行叶绿素荧光检测。该系统提供的测量光为620 nm红光,强度为500 μmol/(m2·s),照度为500 μmol/(m2·s),持续时间为2 min;饱和脉冲强度为1 800 μmol/(m2·s),持续时间为0.8 s。endprint
首先选取马齿苋植株上的第5张完全展开叶,暗适应 20 min 后测量最小荧光Fo和暗适应下的最大荧光Fm;随后打开光化学诱导荧光动力学程序,并间隔30 s打开饱和脉冲测量光适应下的最大荧光Fm′;光化学光持续10 min后将其关闭,并在关闭后第60、100、1 000 s分别打开饱和脉冲测量最大荧光Fm″。
荧光参数的定义采用van Kootan等的方法[14],并由仪器自带软件完成计算。光化学光关闭后100、1 000 s时的非光化学淬灭,与光化学光打开时非光化学淬灭的差值分别为qE、qT,1 000 s 时的非光化学淬灭为qI[15]。
1.4生长指标的检测
马齿苋移栽45 d后用直尺测量其株高,并采用ADC-AM300 型多用途叶面积仪测量第5张完全展开叶的面积。
1.5数据处理
采用SPSS 19软件分析试验数据,采用GraphPad Prism 6软件制作图表。试验结果以“平均值±标准差”表示,表中不同小写字母表示在单因素方差分析时不同处理间差异显著(P<0.05)。
2结果与分析
2.1NaN3处理对种子萌发的影响
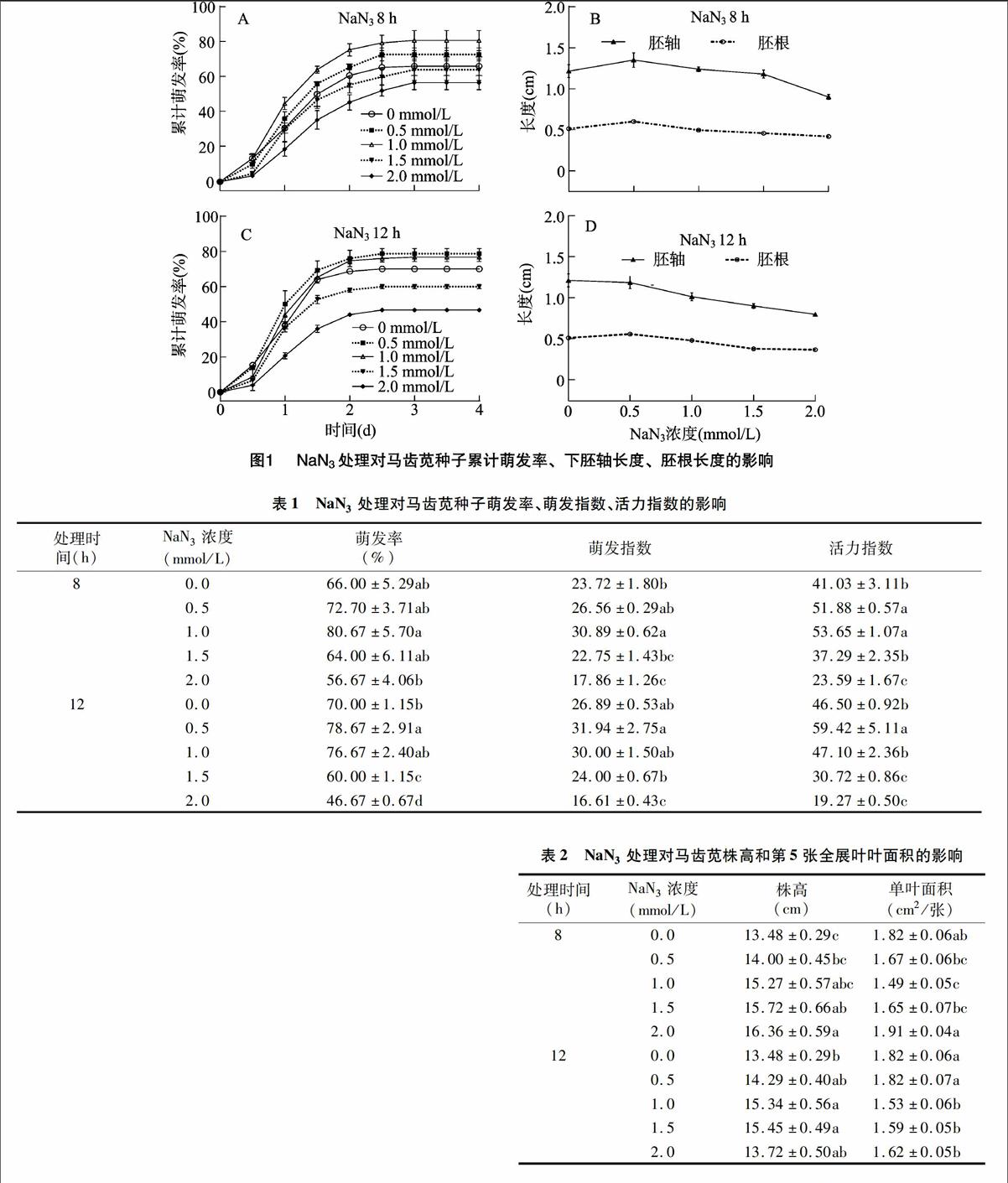
以不同浓度NaN3溶液浸种,分别处理马齿苋种子8、12 h,再在正常条件下萌发。由图1-A、图1-C可知,NaN3处理8、12 h对种子初始萌动时间的影响不大,但随萌发时间的延长,浓度≤1.0 mmol/L的NaN3处理可显著提高种子的累计萌发率;1.0 mmol/L NaN3 8 h处理组的累计萌发率最高,高达80.67%±5.7%;0.5、1.0 mmol/L NaN3 12 h处理组对种子萌发的促进效果相当;2.0 mmol/L NaN3处理8 h与1.5~2.0 mmol/L NaN3处理12 h则显著降低了种子的累计萌发率和最终萌发率(表1)。
NaN3处理不仅影响种子的萌发速度和萌发率,对芽苗质量也有一定影响(表1)。0.5 mmol/L NaN3处理8 h时,芽苗下胚轴长度、胚根长度均显著高于对照,但随着NaN3处理浓度的增加,当处理时间延长至12 h,芽苗的胚根长度、胚轴长度逐渐下降(图1-B、图1-D)。虽然马齿苋种子的萌发指数、活力指数对NaN3处理更为敏感,但低浓度、短时间的NaN3处理能提高马齿苋种子的萌发速度和质量,反之则表现为抑制。
2.2NaN3处理对马齿苋生长的影响
为检测NaN3处理对马齿苋幼苗的生长是否有影响,经NaN3处理的种子萌发后将其移栽到育苗块于正常条件下培养,并间苗留下优势株,45 d后比较马齿苋植株株高、第5张全展叶的叶面积(表2)。除0.5、2.0 mmol/L 12 h处理组外,各组的马齿苋株高均显著高于对照,但各组间差距较小,其中 2.0 mmol/L NaN3 8 h处理组的平均株高最高;0.5~1.5 mmol/L NaN3 8 h各处理组以及1.0~2.0 mmol/L NaN3 12 h各处理组的单叶面积均小于或接近于对照,其中2.0 mmol/L NaN3 8 h处理组显著高于其他组。可见,NaN3处理马齿苋种子可显著提高马齿苋株高,但多数情况下会减小单叶面积。在本试验的处理浓度及处理时间范围内,2.0 mmol/L NaN3处理8 h时,马齿苋植株的单叶面积稳中有升,且株高增幅最大(较对照提高21.36%),表明 2.0 mmol/L NaN3处理马齿苋种子8 h可显著提高植株长势。
2.3NaN3处理对马齿苋植株光合性能的影响
在叶绿素荧光参数指标中,Fv/Fm值代表PSⅡ的最大光化学效率,绝大多数正常生长植物的Fv/Fm值恒定在0.80~0.85范围内,而Fv/Fo值则代表实际检测条件下PSⅡ的光化学活性[16]。由表3可知,对照组马齿苋叶片的Fv/Fm值高达
表2NaN3处理对马齿苋株高和第5张全展叶叶面积的影响
0.850,表明马齿苋叶片的潜在光合性能很高,而各NaN3处理组植株叶片的Fv/Fm值均显著高于对照,其中2.0 mmol/L NaN3 8 h处理组的Fv/Fm值高达0.865;各NaN3处理组的Fv/Fo值均显著高于对照,同样以2.0 mmol/L NaN3 8 h 处理组最高,高达6.38。可见,以NaN3处理马齿苋种子不仅能提高植株叶片的潜在光化学性能,还可显著提高植株的实际光化学活性,从而提高植株的实际光合能力。就马齿苋而言,以表3NaN3处理对马齿苋叶片叶绿素荧光参数的影响
2.0 mmol/L NaN3处理种子8 h对于植物潜在、实际光合性能的提高最有利。
植物叶绿素吸收的光能不仅用于光化学反应,还有部分能量用于非光化学耗散(NPQ)。非光化学耗散所消耗的能量主要包括qE、qT、qI,分别表示植物在高光强不同阶段的光保护能力[14,17-18]。
qE通过提高内囊体内侧的pH值,并诱导激发态叶绿素分子中过量的光能以热的形式耗散,从而对激发态叶绿素淬灭,减少强光诱变下自由基的产生,以减少细胞损伤[18-19]。qE使叶片在几秒至几分钟内快速对强光诱变作出调节,减轻植物受到的光诱变伤害。qE/NPQ的值越大,表明植物对强光环境的适应能力越强。在饱和脉冲刺激下,0.5、2.0 mmol/L NaN3 8 h处理组的qE/NPQ值均与对照相当,2.0 mmol/L NaN3 8 h处理组显著高于0.5 mmol/L NaN38 h处理组,而其余各组的qE/NPQ值均显著低于对照。可见在正常生长情况下,NaN3处理马齿苋种子可促进植株潜在光合性能、实际光化学效率的提高,但在强光胁迫下,多数处理组植株对光胁迫的快速保护能力下降,而2.0 mmol/L NaN3 8 h处理组植株对光胁迫的快速保护能力稳中有升。endprint
qT在三者中所占比例最小,代表激发能由PSⅡ向PSⅠ分配的情况。强光刺激下qT升高表明在几分钟内促进能量由PSⅡ向PSⅠ分配,从而避免PSⅡ的光能吸收过量而引起光损伤[20]。在本试验的NaN3处理浓度、处理时间范围内,只有0.5、2.0 mmol/L NaN3 8 h处理组的qT/NPQ值与对照差异不显著,其余各处理组均显著高于对照。可见,虽然各处理组对光胁迫的快速保护能力下降,但仍可通过将激发能由PSⅡ向PSⅠ转移,从而在几分钟内提高植株对光胁迫的保护能力,此保护能力相对较小。0.5、2.0 mmol/L NaN3 8 h处理组的植株能量由PSⅡ向PSⅠ的分配比例与对照相当。
在强光下,反应中心D1蛋白受损伤的速度超过其修复速度,qI代表捕光色素蛋白复合体吸收的光能未被有效利用而引起的能量耗散,这部分能量主要转化为热能或形成活性氧[18]。虽然qI是光损伤和光保护混合作用的结果,但qI/NPQ的值越大往往代表植物所受的光抑制越强[18,21]。由表3可知,2.0 mmol/L NaN3 8 h处理组的 qI/NPQ 值与对照相当,而其余各组均显著高于对照,且各12 h处理组的 qI/NPQ 值显著高于各8 h处理组。可见,除2.0 mmol/L NaN3 8 h处理组外,其余各处理组植株在强光下的损伤均显著高于对照组,且植物在强光下的保护能力随NaN3处理时间的延长而减弱。
3结论与讨论
NaN3作为一种高效的诱变剂,被广泛应用于水稻、小麦、西瓜的种子处理以及组织培养中的外植体处理,以促进诱变的发生。NaN3诱变时,突变多为隐性突变,且具有无定向性等特点,导致诱变处理后多数植株长势减弱,目标性状在子一代或子二代后才能显现。若以种子萌发势、当代或子一代植株叶片畸形率等来确定最适剂量,则可能导致大量后代植株长势偏弱,这与目标性状的筛选相违背;因此,本研究综合种子萌发、植株长势、光合能力来确定NaN3的最适处理剂量,并采用叶绿素荧光动力学技术辅助筛选抗性较强的植株,以加速筛选进程。
绝大多数研究结果表明,NaN3处理可延缓种子萌发并降低种子萌发率[6,11]。而本研究中,1.0 mmol/L NaN3处理8 h或 0.5 mmol/L NaN3处理12 h均可显著提高种子的萌发率及萌发质量;更高处理浓度、更长处理时间则会使马齿苋种子的萌发率、萌发质量逐渐下降。马齿苋种子对NaN3处理的抗性大于其他种子,因此不应采用常规半致死率来确定马齿苋种子的最适NaN3诱变剂量。
将萌发种子在育苗块上培养,间苗筛选留下长势旺盛的植株,并比较各组植物的生长及光合性能。结果显示,初筛后各处理组植株的株高均高于对照或与对照相当,且正常生长条件下植株的潜在(Fv/Fm值)、实际光化学活性(Fv/Fo值)均强于对照或与对照相当[16],但各处理组增大幅度不一。虽然活力指数对NaN3处理最敏感,但株型最高、光合性能最强的2.0 mmol/L NaN3 8 h处理组在种子萌发期的活力指数为 57.49%。可见,为使后代植株中出现更多长势旺盛、光合能力强的植株,应综合萌发质量、长势、光合能力等指标来确定NaN3的最适处理剂量。
正常条件下生长旺盛的植株不一定具有高抗性,而农业生产中生长旺盛、抗性强的植株更具有应用价值。若在当代先筛选长势旺盛、光合能力强的植株,并在子一代筛选抗性强的植株,则会遗漏当代植株中长势不强但抗性较强的植株,同时增加子一代植株的筛选工作量。若能筛选当代植株中长势旺盛且抗性强的植株,对减少遗漏、加快筛选进程、减少工作量等极为有利。
叶绿素荧光动力学技术可通过改变外源光强,无损伤检测植株在正常光强下的光合性能,及其在强光下非光化学淬灭各组分比例(qE/NPQ、qT/NPQ、qI/NPQ)的变化,并分析植株在正常条件下的光合潜能和高光强抵御能力[21]。该方法已在优良品种的抗性筛选上发挥了一定作用。本研究以此方法分析正常生长条件下马齿苋植株的抗逆能力,并综合植株的其他性状选择NaN3最适处理剂量和目标性状的备选株系。结果表明,NaN3处理可提高植株在正常条件下的光合性能,但也会导致多数植物对高光强逆境的抵御能力减弱。NaN3处理降低了除2.0 mmol/L NaN3 8 h处理组外其余各组植物对光胁迫的快速保护能力(qE/NPQ),并促进其将PSⅡ吸收的多余能量向PSⅠ转移的能力(qT/NPQ),而由于此能力有限,最终导致这些植株在强光下的损伤高于对照 (qI/NPQ)。2.0 mmol/L NaN3 8 h处理组的植株不仅PSⅡ的潜在(Fv/Fm)、实际光化学性能(Fv/Fo)提升幅度最大,且该组植物在强光胁迫下可将非光化学淬灭中的能量更多地应用于快速光保护(qE/NPQ),而用于热耗散和产生自由基的能量比例相应减少(qT/NPQ),最终导致植物对高光强的抵御能力增强。试验证实了正常条件下长势旺盛的植株,其抗逆性不一定强;利用叶绿素荧光动力学技术可无损伤筛选同时具有光合旺盛、抗逆性强特性的植株。
综合不同浓度NaN3处理下的种子萌发质量、初筛后植株的长势、植株光合能力、抗高光强能力可知,以2.0 mmol/L NaN3处理8 h是马齿苋种子的最适处理条件;采用叶绿素荧光动力学分析技术分析植株的潜在和实际光合性能、抗高光强能力,极大地提高筛选效率。后续研究将对收集的种子在子一代中进一步筛选,以筛选出生长旺盛、抗性强、抗白粉病、营养丰富的马齿苋种质。
参考文献:
[1]Simopoulos A P,Tan D X,Manchester L C,et al. Purslane:a plant source of omega-3 fatty acids and melatonin[J]. Journal of Pineal Research,2005,39(3):331-332.endprint
[2]Feng P C,Haynes L J,Magnus K E. High concentration of (—)-noradrenaline in Portulaca oleracea L.[J]. Nature,1961,191:1108.
[3]Sauer L A,Dauchy R T,Blask D E. Polyunsaturated fatty acids,melatonin,and cancer prevention[J]. Biochemical Pharmacology,2001,61(12):1455-1462.
[4]Tiwari K K,Dwivedi S,Mishra S,et al. Phytoremediation efficiency of Portulaca tuberosa rox and Portulaca oleracea L. naturally growing in an industrial effluent irrigated area in Vadodra,Gujrat,India[J]. Environmental Monitoring and Assessment,2008,147(1/2/3):15-22.
[5]安学丽,蔡一林,王久光,等. 化学诱变及其在农作物育种上应用[J]. 核农学报,2003,17(3):239-242.
[6]杜连恩,魏玉昌,可福存,等. 大豆化学诱变育种及其规律的研究[J]. 华北农学报,1989,4(2):39-43.
[7]董颖苹,连 勇,何庆才,等. 植物化学诱变技术在育种中的运用及进展 Ⅱ.突变体的筛选及分子检测[J]. 种子,2005,24(8):54-58.
[8]陈庭,王爱敏,刘运权,等. NaN3对宝巾的诱变效应初步研究[J]. 中国农学通报,2012,28(25):191-195.
[9]Codrea M C,Hakala Y M,Krlund M A,et al. Mahalanobis distance screening of Arabidopsis mutants with chlorophyll fluorescence[J]. Photosynthesis Research,2010,105(3):273-283.
[10]Ptushenko V V,Ptushenko E A,Samoilova O P,et al. Chlorophyll fluorescence in the leaves of Tradescantia species of different ecological groups:induction events at different intensities of actinic light[J]. Bio Systems,2013,114(2):85-97.
[11]陈灿,徐庆国,彭波,等. 不同化学诱变剂对水稻种子萌发和生长的影响[J]. 种子,2008,27(3):9-13.
[12]杨子仪. 野生型与栽培型马齿苋萌发特性与抗逆能力比较[D]. 南京:南京师范大学,2014.
[13]杨子仪,徐亚莉,葛峰,等. 兽药洛克沙胂处理对空心菜生长代谢和营养价值的影响[J]. 地球与环境,2013,41(4):441-450.
[14]van Kooten O,Snel J F H. The use of chlorophyll fluorescence nomenclature in plant stress physiology[J]. Photosynthesis Research,1990,25(3):147-150.
[15]Walters R G,Horton P. Resolution of components of non-photochemical chlorophyll fluorescence quenching in barley leaves[J]. Photosynthesis Research,1991,27(2):121-133.
[16]Schreiber U,Bilger W,Hormann H,et al. Chlorophyll fluorescence as a diagnostic tool:basics and some aspects of practical relevance[M]. Cambridge:Cambridge University Press,1998:320-336.
[17]Hodges M,Comic G,Briantais J M. Chlorophyll fluorescence from spinach leaves:resolution of non-photochemical quenching[J]. Biochimica et Biophysica Acta(BBA)-Bioenergetics,1989,974(3):289-293.
[18]Müller P,Li X P,Niyogi K K. Non-photochemical quenching:a response to excess light energy[J]. Plant Physiology,2001,125(4):1558-1566.
[19]Demmig A B,Adams Iii W W. The role of xanthophyll cycle carotenoids in the protection of photosynthesis[J]. Trends in Plant Science,1996,1(1):21-26.
[20]Fork D C,Bose S,Herbert S K. Radiationless transitions as a protection mechanism against photoinhibition in higher plants and a red alga[J]. Photosynthesis Research,1986,10(3):327-335.
[21]Rohácˇek K,Soukupová J,Barták M. Chlorophyll fluorescence:a wonderful tool to study plant physiology and plant stress[M]//Schoefs B.Plant cell compartments-selected topics. Kerala,India:Research Signpost,2008:41-104.endprint

