微囊藻毒素ELISA检测方法的建立与评估
胡乐琴等


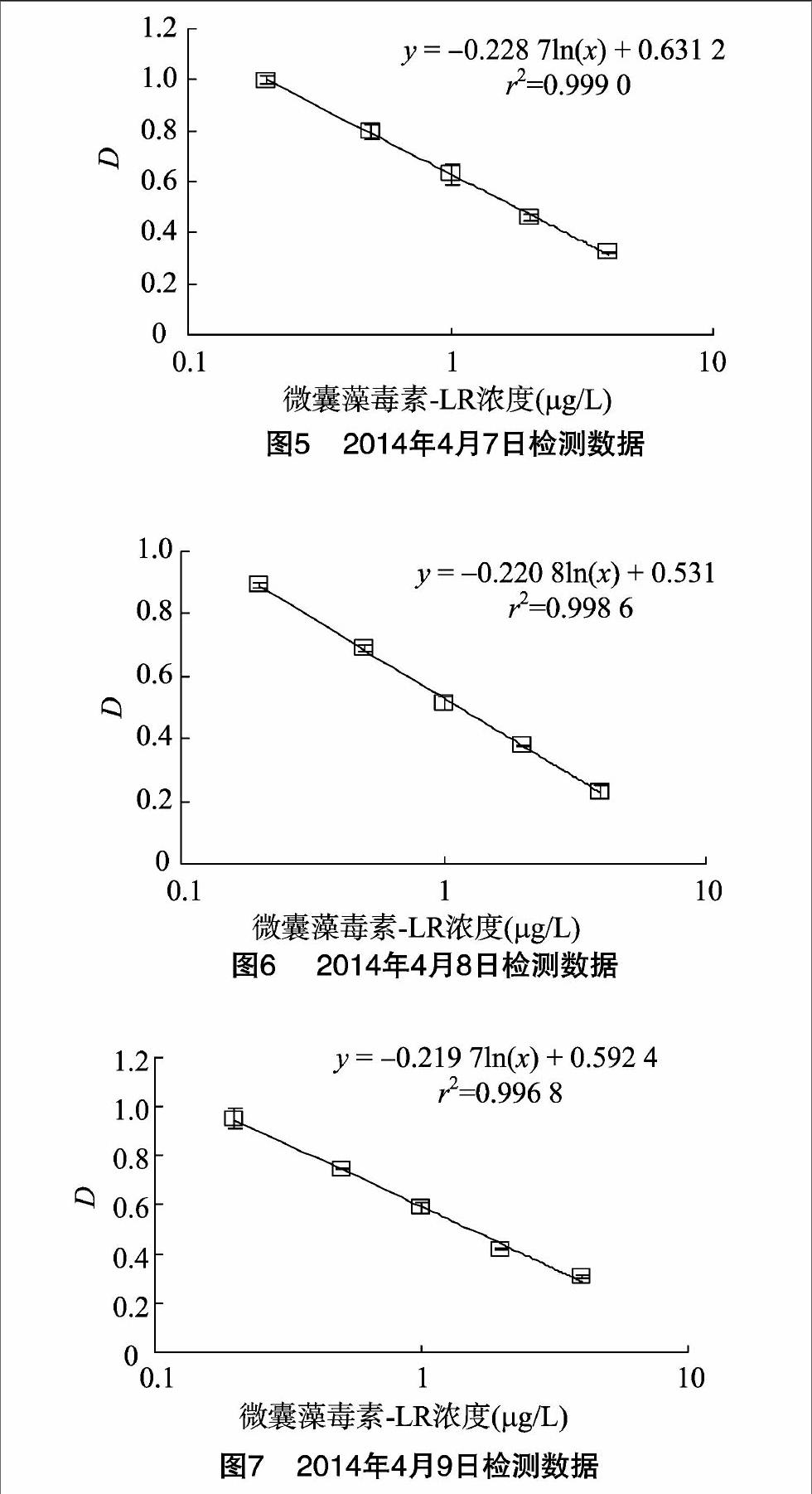
摘要:采用制备的微囊藻毒素(MC-LR)单克隆抗体制备包被抗原,建立MC-LR的ELISA检测方法。该方法定量检测区间LQD为0.20~4.00 μg/L,最低检测限LOD为0.10 μg/L,最高检测限HOD为8.00 μg/L,最佳包被抗原浓度为0.5 μg/mL,对应抗体稀释度为1 ∶20 000左右,酶标二抗工作稀释度选择为1 ∶6 000;应用该方法对加标水样进行检测,综合回收率为(98.0±10.7)%,各样品检测结果变异系数均小于10%。该ELISA方法准确度良好,精密度优良。
关键词:微囊藻毒素;单克隆抗体;间接竞争ELISA;检测
中图分类号: X17文献标志码: A文章编号:1002-1302(2015)09-0340-04
我国是世界上藻灾最为严重的国家之一,藻毒素严重威胁居民饮水安全和食品安全。我国主要的淡水藻毒素是微囊藻毒素(microcystin,MC),微囊藻毒素是淡水蓝藻产生的一类生物活性物质,能够对人体多个器官产生危害,危害最严重的靶器官是肝脏,长时间低剂量接触MCs会导致肝损伤和诱发癌症[1-2]。有研究表明,我国肝癌多发区与当地水中高含量的微囊毒素有关[3-4],MCs引发的急性肝中毒症状表现为肝细胞损伤、肝出血[5]。
预防藻毒素侵害最主要是保持水体清洁,防止藻类过量生长;同时,能够精确及时地检测毒素也是预防毒素污染的有效方法。我国淡水微囊藻毒素污染严重,但迄今为止尚没有一种较合适于现场使用的藻毒素检测方法,因此研制我国自主知识产权的检测淡水中微囊藻毒素的方法已成为当务之急。
藻毒检测方法主要有色谱检测、生物检测、细胞检测[6-8],这些检测技术或是需要昂贵的仪器、或是需要较长的检测时间、或是准确率不够。与其他检测方法相比,酶联免疫法具有灵敏度高、特异性好、重复性高和检测准确快速的优点,在现场快速检测上具有开发前景,近年来在赤潮藻毒素快速检测方面得到重视和发展。笔者所在实验室在成功制备高效价MC-LR单克隆抗体的基础上,初步建立了检测 MC-LR 的间接竞争酶免疫学检测方法,为研制具有自主知识产权的相关检测试剂盒奠定了基础。
1材料与方法
1.1材料与试剂
微囊藻毒素单克隆抗体由笔者所在课题组研制;其他试剂均为国产分析纯。
1.2包被抗原的制备
用兔血清白蛋白(rabbit serum albumin,RSA)制备包被抗原MC-LR-RSA[9],冰箱保存备用。
1.3抗原、抗体最佳稀释浓度的确定
在96孔ELISA板上,检测抗原按纵向排列,抗体按横向排列。检测抗原用包被缓冲液(pH值9.6,0.05 mol/L碳酸盐缓冲液)稀释为1 ∶1 000、1 ∶2 000、1 ∶4 000、1 ∶8 000这4个浓度,每浓度3个重复,每孔100 μL,4 ℃过夜;洗涤液后静置1 min,重复洗涤3次;用0.1% BSA(用包被液进行稀释)的封闭液进行封闭,每孔120 μL,37 ℃1 h,洗涤3次,拍干。
MC-LR抗体浓度调为7.5 mg/mL,用高纯水稀释成如下梯度浓度:0、0.025、0.05、0.1、0.2、0.5、1、2、4、8、20 μg/L共11个点;依次加入酶标板上的1号至12号孔中,抗体体积为100 μL/孔,37 ℃温育后洗涤3次;加入HRP标记的羊抗鼠IgG,酶标二抗羊抗鼠IgG浓度选择为1 ∶6 000,每孔加入100 μL,37 ℃温育1 h,洗涤4次;显色液为TMB;终止液为 2 mol/L H2SO4。在酶标仪上测定D450 nm值,确定最佳包被抗原与抗体浓度。
1.4标准曲线的测定
根据“1.3”节所得到的最佳包被抗原浓度和最佳抗体稀释倍数,以及最佳二抗浓度,用标准系列稀释的MC-LR(0、0.025、0.05、0.1、0.2、0.5、1、2、4、8、20 μg/L),按照间接竞争ELISA测定。采用n=3个平行试验,获得标准曲线。
1.5一抗最佳反应时间的确定
根据“1.3”节试验选取最佳的抗原、抗体稀释度,包被抗原浓度为0.5 μg/mL,对应的抗体稀释度为1 ∶20 000,作为ELISA的反应条件。将MC-LR标准品用高纯水配制成如下梯度浓度:0、0.2、0.5、1、2、4 μg/L,共6个点,进行标准曲线测定,每孔50 μL标准品;同时加入用PBS配制好的单抗溶液,每孔50 μL,放入37 ℃培养箱中温育,一抗反应时间设定为30、60、90 min 3个组,每组3个平行;二抗体反应时间固定为60 min。每个时间内标准曲线设置2个平行。反应结束后分别洗涤3次,拍干。
加二抗:酶标二抗采用HRP标记的羊抗鼠IgG,采用PBS稀释,每孔加入100 μL,37 ℃温育1 h,洗涤4次,拍干。
显色:加入新配制的底物液(TMB-H2O2),每孔100 μL,室温下固定反应10 min。测定D450 nm值,选择最佳一抗反应时间。
1.6实际水样的检测(准确度和精密度验证)
1.6.1水样的采集和预处理选取上海市不同来源的水样,包括饮用水、地下水、景观娱乐用水(游泳池和公园水样)以及地表水(城市河道水体)14个样品,每个水样采集体积为10 mL,对较混浊的样品采用0.45 μm的滤膜过滤。
1.6.2水样的添加-回收测定在14个水样中添加标准微囊藻毒素,每个样品毒素的最终浓度分别为0.2、0.5、1.0 μg/L ,共3个不同浓度。采用直接竞争ELISA测定样品中毒素含量,每个水样平行测定5次,根据标准曲线计算水样中MC-LR浓度。同时测定原水中的毒素含量,结果进行比较,并计算回收率。回收率的计算方法如下:每个样品平行测定5次,计算吸光度的平均值,样品添加浓度(最终浓度)用X表示,未添加标准品的样品测定平均值为x1,添加了标准品的样品测定平均值为x2,则回收率计算如式(1)。当原水样ELISA测定浓度超出本方法的检测限,即小于0.1 μg/L时,视为未检出,此时均按照x1=0计算回收率。
摘要:采用制备的微囊藻毒素(MC-LR)单克隆抗体制备包被抗原,建立MC-LR的ELISA检测方法。该方法定量检测区间LQD为0.20~4.00 μg/L,最低检测限LOD为0.10 μg/L,最高检测限HOD为8.00 μg/L,最佳包被抗原浓度为0.5 μg/mL,对应抗体稀释度为1 ∶20 000左右,酶标二抗工作稀释度选择为1 ∶6 000;应用该方法对加标水样进行检测,综合回收率为(98.0±10.7)%,各样品检测结果变异系数均小于10%。该ELISA方法准确度良好,精密度优良。
关键词:微囊藻毒素;单克隆抗体;间接竞争ELISA;检测
中图分类号: X17文献标志码: A文章编号:1002-1302(2015)09-0340-04
我国是世界上藻灾最为严重的国家之一,藻毒素严重威胁居民饮水安全和食品安全。我国主要的淡水藻毒素是微囊藻毒素(microcystin,MC),微囊藻毒素是淡水蓝藻产生的一类生物活性物质,能够对人体多个器官产生危害,危害最严重的靶器官是肝脏,长时间低剂量接触MCs会导致肝损伤和诱发癌症[1-2]。有研究表明,我国肝癌多发区与当地水中高含量的微囊毒素有关[3-4],MCs引发的急性肝中毒症状表现为肝细胞损伤、肝出血[5]。
预防藻毒素侵害最主要是保持水体清洁,防止藻类过量生长;同时,能够精确及时地检测毒素也是预防毒素污染的有效方法。我国淡水微囊藻毒素污染严重,但迄今为止尚没有一种较合适于现场使用的藻毒素检测方法,因此研制我国自主知识产权的检测淡水中微囊藻毒素的方法已成为当务之急。
藻毒检测方法主要有色谱检测、生物检测、细胞检测[6-8],这些检测技术或是需要昂贵的仪器、或是需要较长的检测时间、或是准确率不够。与其他检测方法相比,酶联免疫法具有灵敏度高、特异性好、重复性高和检测准确快速的优点,在现场快速检测上具有开发前景,近年来在赤潮藻毒素快速检测方面得到重视和发展。笔者所在实验室在成功制备高效价MC-LR单克隆抗体的基础上,初步建立了检测 MC-LR 的间接竞争酶免疫学检测方法,为研制具有自主知识产权的相关检测试剂盒奠定了基础。
1材料与方法
1.1材料与试剂
微囊藻毒素单克隆抗体由笔者所在课题组研制;其他试剂均为国产分析纯。
1.2包被抗原的制备
用兔血清白蛋白(rabbit serum albumin,RSA)制备包被抗原MC-LR-RSA[9],冰箱保存备用。
1.3抗原、抗体最佳稀释浓度的确定
在96孔ELISA板上,检测抗原按纵向排列,抗体按横向排列。检测抗原用包被缓冲液(pH值9.6,0.05 mol/L碳酸盐缓冲液)稀释为1 ∶1 000、1 ∶2 000、1 ∶4 000、1 ∶8 000这4个浓度,每浓度3个重复,每孔100 μL,4 ℃过夜;洗涤液后静置1 min,重复洗涤3次;用0.1% BSA(用包被液进行稀释)的封闭液进行封闭,每孔120 μL,37 ℃1 h,洗涤3次,拍干。
MC-LR抗体浓度调为7.5 mg/mL,用高纯水稀释成如下梯度浓度:0、0.025、0.05、0.1、0.2、0.5、1、2、4、8、20 μg/L共11个点;依次加入酶标板上的1号至12号孔中,抗体体积为100 μL/孔,37 ℃温育后洗涤3次;加入HRP标记的羊抗鼠IgG,酶标二抗羊抗鼠IgG浓度选择为1 ∶6 000,每孔加入100 μL,37 ℃温育1 h,洗涤4次;显色液为TMB;终止液为 2 mol/L H2SO4。在酶标仪上测定D450 nm值,确定最佳包被抗原与抗体浓度。
1.4标准曲线的测定
根据“1.3”节所得到的最佳包被抗原浓度和最佳抗体稀释倍数,以及最佳二抗浓度,用标准系列稀释的MC-LR(0、0.025、0.05、0.1、0.2、0.5、1、2、4、8、20 μg/L),按照间接竞争ELISA测定。采用n=3个平行试验,获得标准曲线。
1.5一抗最佳反应时间的确定
根据“1.3”节试验选取最佳的抗原、抗体稀释度,包被抗原浓度为0.5 μg/mL,对应的抗体稀释度为1 ∶20 000,作为ELISA的反应条件。将MC-LR标准品用高纯水配制成如下梯度浓度:0、0.2、0.5、1、2、4 μg/L,共6个点,进行标准曲线测定,每孔50 μL标准品;同时加入用PBS配制好的单抗溶液,每孔50 μL,放入37 ℃培养箱中温育,一抗反应时间设定为30、60、90 min 3个组,每组3个平行;二抗体反应时间固定为60 min。每个时间内标准曲线设置2个平行。反应结束后分别洗涤3次,拍干。
加二抗:酶标二抗采用HRP标记的羊抗鼠IgG,采用PBS稀释,每孔加入100 μL,37 ℃温育1 h,洗涤4次,拍干。
显色:加入新配制的底物液(TMB-H2O2),每孔100 μL,室温下固定反应10 min。测定D450 nm值,选择最佳一抗反应时间。
1.6实际水样的检测(准确度和精密度验证)
1.6.1水样的采集和预处理选取上海市不同来源的水样,包括饮用水、地下水、景观娱乐用水(游泳池和公园水样)以及地表水(城市河道水体)14个样品,每个水样采集体积为10 mL,对较混浊的样品采用0.45 μm的滤膜过滤。
1.6.2水样的添加-回收测定在14个水样中添加标准微囊藻毒素,每个样品毒素的最终浓度分别为0.2、0.5、1.0 μg/L ,共3个不同浓度。采用直接竞争ELISA测定样品中毒素含量,每个水样平行测定5次,根据标准曲线计算水样中MC-LR浓度。同时测定原水中的毒素含量,结果进行比较,并计算回收率。回收率的计算方法如下:每个样品平行测定5次,计算吸光度的平均值,样品添加浓度(最终浓度)用X表示,未添加标准品的样品测定平均值为x1,添加了标准品的样品测定平均值为x2,则回收率计算如式(1)。当原水样ELISA测定浓度超出本方法的检测限,即小于0.1 μg/L时,视为未检出,此时均按照x1=0计算回收率。
摘要:采用制备的微囊藻毒素(MC-LR)单克隆抗体制备包被抗原,建立MC-LR的ELISA检测方法。该方法定量检测区间LQD为0.20~4.00 μg/L,最低检测限LOD为0.10 μg/L,最高检测限HOD为8.00 μg/L,最佳包被抗原浓度为0.5 μg/mL,对应抗体稀释度为1 ∶20 000左右,酶标二抗工作稀释度选择为1 ∶6 000;应用该方法对加标水样进行检测,综合回收率为(98.0±10.7)%,各样品检测结果变异系数均小于10%。该ELISA方法准确度良好,精密度优良。
关键词:微囊藻毒素;单克隆抗体;间接竞争ELISA;检测
中图分类号: X17文献标志码: A文章编号:1002-1302(2015)09-0340-04
我国是世界上藻灾最为严重的国家之一,藻毒素严重威胁居民饮水安全和食品安全。我国主要的淡水藻毒素是微囊藻毒素(microcystin,MC),微囊藻毒素是淡水蓝藻产生的一类生物活性物质,能够对人体多个器官产生危害,危害最严重的靶器官是肝脏,长时间低剂量接触MCs会导致肝损伤和诱发癌症[1-2]。有研究表明,我国肝癌多发区与当地水中高含量的微囊毒素有关[3-4],MCs引发的急性肝中毒症状表现为肝细胞损伤、肝出血[5]。
预防藻毒素侵害最主要是保持水体清洁,防止藻类过量生长;同时,能够精确及时地检测毒素也是预防毒素污染的有效方法。我国淡水微囊藻毒素污染严重,但迄今为止尚没有一种较合适于现场使用的藻毒素检测方法,因此研制我国自主知识产权的检测淡水中微囊藻毒素的方法已成为当务之急。
藻毒检测方法主要有色谱检测、生物检测、细胞检测[6-8],这些检测技术或是需要昂贵的仪器、或是需要较长的检测时间、或是准确率不够。与其他检测方法相比,酶联免疫法具有灵敏度高、特异性好、重复性高和检测准确快速的优点,在现场快速检测上具有开发前景,近年来在赤潮藻毒素快速检测方面得到重视和发展。笔者所在实验室在成功制备高效价MC-LR单克隆抗体的基础上,初步建立了检测 MC-LR 的间接竞争酶免疫学检测方法,为研制具有自主知识产权的相关检测试剂盒奠定了基础。
1材料与方法
1.1材料与试剂
微囊藻毒素单克隆抗体由笔者所在课题组研制;其他试剂均为国产分析纯。
1.2包被抗原的制备
用兔血清白蛋白(rabbit serum albumin,RSA)制备包被抗原MC-LR-RSA[9],冰箱保存备用。
1.3抗原、抗体最佳稀释浓度的确定
在96孔ELISA板上,检测抗原按纵向排列,抗体按横向排列。检测抗原用包被缓冲液(pH值9.6,0.05 mol/L碳酸盐缓冲液)稀释为1 ∶1 000、1 ∶2 000、1 ∶4 000、1 ∶8 000这4个浓度,每浓度3个重复,每孔100 μL,4 ℃过夜;洗涤液后静置1 min,重复洗涤3次;用0.1% BSA(用包被液进行稀释)的封闭液进行封闭,每孔120 μL,37 ℃1 h,洗涤3次,拍干。
MC-LR抗体浓度调为7.5 mg/mL,用高纯水稀释成如下梯度浓度:0、0.025、0.05、0.1、0.2、0.5、1、2、4、8、20 μg/L共11个点;依次加入酶标板上的1号至12号孔中,抗体体积为100 μL/孔,37 ℃温育后洗涤3次;加入HRP标记的羊抗鼠IgG,酶标二抗羊抗鼠IgG浓度选择为1 ∶6 000,每孔加入100 μL,37 ℃温育1 h,洗涤4次;显色液为TMB;终止液为 2 mol/L H2SO4。在酶标仪上测定D450 nm值,确定最佳包被抗原与抗体浓度。
1.4标准曲线的测定
根据“1.3”节所得到的最佳包被抗原浓度和最佳抗体稀释倍数,以及最佳二抗浓度,用标准系列稀释的MC-LR(0、0.025、0.05、0.1、0.2、0.5、1、2、4、8、20 μg/L),按照间接竞争ELISA测定。采用n=3个平行试验,获得标准曲线。
1.5一抗最佳反应时间的确定
根据“1.3”节试验选取最佳的抗原、抗体稀释度,包被抗原浓度为0.5 μg/mL,对应的抗体稀释度为1 ∶20 000,作为ELISA的反应条件。将MC-LR标准品用高纯水配制成如下梯度浓度:0、0.2、0.5、1、2、4 μg/L,共6个点,进行标准曲线测定,每孔50 μL标准品;同时加入用PBS配制好的单抗溶液,每孔50 μL,放入37 ℃培养箱中温育,一抗反应时间设定为30、60、90 min 3个组,每组3个平行;二抗体反应时间固定为60 min。每个时间内标准曲线设置2个平行。反应结束后分别洗涤3次,拍干。
加二抗:酶标二抗采用HRP标记的羊抗鼠IgG,采用PBS稀释,每孔加入100 μL,37 ℃温育1 h,洗涤4次,拍干。
显色:加入新配制的底物液(TMB-H2O2),每孔100 μL,室温下固定反应10 min。测定D450 nm值,选择最佳一抗反应时间。
1.6实际水样的检测(准确度和精密度验证)
1.6.1水样的采集和预处理选取上海市不同来源的水样,包括饮用水、地下水、景观娱乐用水(游泳池和公园水样)以及地表水(城市河道水体)14个样品,每个水样采集体积为10 mL,对较混浊的样品采用0.45 μm的滤膜过滤。
1.6.2水样的添加-回收测定在14个水样中添加标准微囊藻毒素,每个样品毒素的最终浓度分别为0.2、0.5、1.0 μg/L ,共3个不同浓度。采用直接竞争ELISA测定样品中毒素含量,每个水样平行测定5次,根据标准曲线计算水样中MC-LR浓度。同时测定原水中的毒素含量,结果进行比较,并计算回收率。回收率的计算方法如下:每个样品平行测定5次,计算吸光度的平均值,样品添加浓度(最终浓度)用X表示,未添加标准品的样品测定平均值为x1,添加了标准品的样品测定平均值为x2,则回收率计算如式(1)。当原水样ELISA测定浓度超出本方法的检测限,即小于0.1 μg/L时,视为未检出,此时均按照x1=0计算回收率。

