传统发酵泡菜优势微生物及其代谢特性
熊 涛,彭 飞,李 啸,李军波,关倩倩
(南昌大学生命科学与食品工程学院,食品科学与技术国家重点实验室,江西 南昌 330047)
传统发酵泡菜优势微生物及其代谢特性
熊 涛,彭 飞,李 啸,李军波,关倩倩
(南昌大学生命科学与食品工程学院,食品科学与技术国家重点实验室,江西 南昌 330047)
采用平板计数法分析泡菜发酵过程中主要微生物的变化规律,并利用高效液相色谱仪、pH计等仪器分析底物、代谢产物和pH值的变化。结果表明:我国传统泡菜发酵过程中的主要微生物有乳酸菌、醋酸菌、酵母菌及霉菌;发酵7 d后,卤水的最终pH值由初始的5.7降至3.2;蔗糖作为发酵体系内的主要碳源,在整个发酵过程中被大量代谢利用,发酵7 d后,蔗糖浓度由初始的74.4 mmol/L变为18.4 mmol/L;而葡萄糖和果糖在发酵过程中没有明显被利用,其浓度分别维持在28.1 mmol/L和23.2 mmol/L;柠檬酸与苹果酸分别在24 h和12 h时达到最大浓度(3.4 mmol/L和8.9 mmol/L),然后下降,最后维持稳定,因此,发酵微生物对柠檬酸和苹果酸有一定的利用能力;乳酸是发酵过程中的主要代谢产物并且呈现稳定的增长趋势,其浓度由初始的5.6 mmol/L增长至149.6 mmol/L;乙酸和乙醇的产生则主要发生在泡菜的发酵前期。
泡菜;乳酸菌;发酵;代谢
泡菜是我国传统特色发酵食品的典型代表之一,距今已有3 000多年的历史[1]。我国传统发酵泡菜的加工方式多以自然发酵为主,即利用附着在蔬菜表面的微生物进行发酵。在盐水浸泡环境中,蔬菜本身携带的多种微生物(以乳酸菌为主)迅速繁殖,并利用以糖类为主的碳水化合物进行代谢活动,生成乳酸、乙醇、乙酸等代谢产物和多种挥发性风味物质,从而得到风味良好的成熟泡菜。对泡菜发酵过程中的优势微生物和代谢物质进行分析,是深入研究我国传统发酵泡菜的必经之路。国内外不少研究学者对自然发酵泡菜中的乳酸菌进行了分离鉴定及特性研究[2]。国内有学者对泡菜环境中的菌株进行了分离且采用分子生物学技术进行鉴定[3]:燕平梅等[4]对泡白菜卤水中乳酸菌、酵母菌、霉菌和肠杆菌等优势微生物进行了分离鉴定和抗菌特性的研究;张伟[5]研究了自然发酵泡菜过程中主要化学成分的变化以及乳酸菌、酵母菌、霉菌等微生物菌落长势变化;陈功等[6]对四川泡菜的挥发性成分和主体风味物质进行了分析研究。从已有的研究成果来看,对传统发酵泡菜的微生物动态变化的研究多见于乳酸菌,酵母菌和霉菌则较少,且未发现对泡菜中的醋酸菌进行分离计数的研究;而在代谢物分析方面,已有的研究主要集中在对自然发酵泡菜的还原糖和总酸含量的变化进行监测及对挥发性风味物质进行分析。本实验利用不同的选择性培养基及鉴定方法,对我国传统发酵泡菜发酵过程中优势微生物(乳酸菌、酵母菌、醋酸菌和霉菌)进行平板分离计数,并使用高效液相色谱技术(high performance liquid chromatography,HPLC),对发酵过程中的多种糖类及有机酸变化进行分析,从而明确泡菜在自然发酵过程中优势微生物的菌系变化、代谢底物和代谢产物的含量变化,为进一步揭示我国传统发酵泡菜发酵过程中多菌种协同发酵的机理提供科学的理论依据。
1 材料与方法
1.1材料、培养基与试剂
圆白菜、食盐、冰糖、生姜、大蒜、干辣椒、花椒等购于当地市场。
乳酸菌分离计数培养基:MRS培养基,配制方法参照GB 4789.35—2010《食品卫生微生物学检验 食品中乳酸菌检验》。酵母菌及霉菌分离计数培养基:虎红琼脂,购于北京奥博星公司。醋酸菌分离计数培养基:醋酸菌固体培养基[7]。
氯化钠、氢氧化钠、碳酸钙、无水乙醇、氯化铁、浓硫酸(均为分析纯) 上海国药集团化学试剂公司;蔗糖、葡萄糖、果糖、乙醇、柠檬酸、苹果酸、乳酸、乙酸、琥珀酸、丙酮酸(均为分析标准品) 美国Sigma公司。
1.2仪器与设备
Agilent 1260型高效液相色谱仪 美国安捷伦公司;Aminex-87H色谱柱 美国伯乐公司、TG-16W微量高速离心机 湖南湘仪实验室仪器开发有限公司;YXQ-LS-50SⅡ/75SⅡ立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;DNP-9272型生化培养箱上海精宏实验设备有限公司;Airtech生物安全柜 苏净集团安泰公司;PHS-25型pH计 上海精密科学仪器有限公司。
1.3方法
1.3.1传统泡菜的制作工艺及配方


表1 泡菜配方Table1 Formulation of Chinese sauerkraut
1.3.2取样
泡菜入坛后,0~7 d内,每隔12 h,取发酵液进行代谢产物、pH值的测定以及优势微生物的分离计数。
1.3.3优势微生物的分离计数
无菌条件下,取1 mL发酵液于装有9 mL无菌生理盐水的试管中,充分摇匀,制成1:10稀释菌悬液,然后按照每级10 倍的次序梯度稀释。选择3 个合适梯度,分别涂布于MRS培养基置于37 ℃培养48 h、虎红培养基和醋酸菌固体培养基置于30 ℃培养3~5 d后计数,每个梯度做2 个平行样。
1.3.4发酵液中糖和有机酸的分析
发酵液经离心(12 000 r/min,10 min)后,取上清液过0.22 μm滤膜,得到滤液用于高效液相色谱分析。色谱条件:进样量20 μL,流动相为6 mmol/L硫酸溶液,流速为0.5 mL/min,温度45 ℃,紫外检测器检测波长205 nm。以保留时间定性,以峰面积定量。示差折光检测器检测糖醇(蔗糖、葡萄糖、果糖、乙醇)含量,紫外检测器检测有机酸(柠檬酸、苹果酸、乳酸、乙酸)含量。
2 结果与分析
2.1发酵期内发酵液pH值的变化
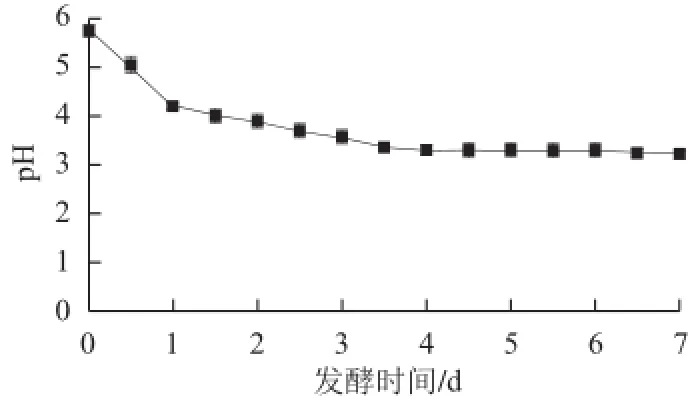
图1 发酵过程中pH值的变化Fig.1 Changes in pH during the fermentation
由图1可知,传统发酵泡菜发酵过程中pH值呈下降趋势。发酵前24 h,pH值即由5.7迅速降至4.2;发酵第2天pH值下降速率放缓,从4.2降至3.9;发酵进入第3天,pH值持续下降,并在进入第5天后趋于平稳,发酵结束时pH值降至3.2。
泡菜发酵启动后,圆白菜中的苹果酸和柠檬酸等有机酸渗出到卤水中,同时肠膜明串珠菌、粪肠球菌等乳酸球菌迅速繁殖并代谢产酸,造成了pH值在发酵初期的快速下降。乳球菌的代谢活动会因低pH值环境的影响而受到抑制[8],从而导致菌数和产酸量的减少,推测这是造成发酵第2天pH值下降速率变缓的主要原因。发酵进入第3天后,乳杆菌大量繁殖并产酸,使得泡菜发酵液pH值进一步降低。在整个发酵期内,乳酸菌代谢产生的有机酸是发酵液pH值下降的主要原因。
2.2发酵期内优势微生物的动态变化

图2 发酵过程中优势菌数的变化Fig.2 Changes in microbial counts during the fermentation
传统发酵泡菜发酵过程中乳酸菌、酵母菌、醋酸菌和霉菌的菌数变化如图2所示。随着发酵的进行,乳酸菌的数量快速增长,并保持稳定至发酵终点。醋酸菌的数量在发酵第1天持续上升至最高值5.2 (lg(CFU/mL)),之后在发酵的1~1.5 d内,缓慢下降至4.9 (lg(CFU/mL));接着在1.5~3 d内,菌数迅速下降,至检测不出。酵母菌和霉菌在泡菜发酵过程中表现出相似的变化规律:发酵第1天数量逐步升高至最大值,并在此后持续降低。不同的是,霉菌在发酵2.5 d时未能检出,酵母菌于发酵3 d后未能检出。
发酵启动后,原先附着于圆白菜上的微生物游离于发酵液中,从而造成发酵初始阶段卤水中含有不同数量的微生物。由于泡菜发酵环境中碳源充足(投入的冰糖和圆白菜本身所含糖类的浸出),4 种监测的微生物均在发酵第1天生长迅速。从数量上看,乳酸菌是主导泡菜自然发酵的优势微生物。乳酸菌具有良好的酸耐受性,在发酵终点时其数量几乎没有降低。泡菜发酵前期,坛内氧气的消耗和异型发酵乳酸菌产生的二氧化碳制造了厌氧环境;而醋酸菌是严格好氧菌,推测厌氧环境的形成是其在发酵3 d后消失的主要原因。酵母菌和霉菌同样在发酵进行3 d后完全消失,主要原因则可能是pH值的降低,另外厌氧环境不利于霉菌的生存。在泡菜发酵中,醋酸菌产生的醋酸给予泡菜一定的香气,同时醋酸与乙醇形成酯类也可以增加香气。霉菌则会消耗体系中的糖分、蛋白质等营养物质并产生臭味和亚硝酸等有害物质,故其大量繁殖会影响泡菜的品质[9-10]。
2.3发酵期内主要代谢底物含量的变化
蔗糖、葡萄糖和果糖是泡菜发酵体系中的主要碳源,主要来源于加入的冰糖和蔬菜中本身含有的少量糖类。柠檬酸和苹果酸是存在于蔬菜中的有机酸类,其中柠檬酸对泡菜中香气的产生很重要,且有文献报道柠檬酸和葡萄糖在乳酸菌的代谢中存在协同代谢作用[11];苹果酸的代谢对泡菜质量的稳定也有重要的意义[12]。

图3 发酵过程中主要代谢底物浓度的变化Fig.3 Changes in substrate concentrations during the fermentation
图3为上述5 种底物在泡菜发酵过程中的代谢变化趋势。在初始发酵过程中,蔗糖被显著代谢,呈现急剧下降趋势;此后,其下降趋势较发酵前期显得较为缓慢。蔗糖作为发酵体系中含量最多的糖,可以被多种微生物代谢利用。异型乳酸发酵的肠膜明串珠菌可能具有一种特殊的水解酶[13-14],对蔗糖有良好的代谢能力且主导着自然发酵泡菜的前期发酵过程;酵母菌和霉菌对蔗糖也有较好的代谢能力,它们在前期的迅速增长需要大量碳源,从而导致蔗糖的急剧下降。随着发酵过程中pH值的不断下降,肠膜明串珠菌、酵母菌和霉菌由于较弱的耐酸性而消亡,而耐酸性较强的同型乳酸发酵菌株主导了泡菜的中后期发酵过程,其中植物乳杆菌[8]是主导中后期发酵的主要菌株。植物乳杆菌较肠膜明串珠菌对蔗糖的利用能力差,但因发酵后期其活菌数仍较高,故在发酵后期蔗糖的利用较前期下降速率稍缓。
葡萄糖和果糖含量在发酵过程中始终表现为上升趋势。该现象与纯菌种发酵中两种单糖含量都呈现先上升后下降的趋势截然不同[15],其原因一方面可能是由于酵母菌的存在,其具有蔗糖水解酶,从而使乳酸菌对蔗糖的利用显得较容易,另一方面由于发酵过程中蔬菜组织不断软化也会导致泡菜组织的糖渗出到发酵液中而使得葡萄糖与果糖含量呈上升趋势。
柠檬酸和苹果酸在发酵过程中表现出了相似的变化趋势,均在发酵前期小幅度上升,然后缓慢下降,最终趋于平稳。柠檬酸作为风味物质的前体,其代谢产物对泡菜的风味存在重要的意义;另外,其与糖存在协同代谢作用,这样就避免了酵母[16]的二次发酵。苹果酸被代谢产生乳酸,增加了泡菜发酵初期的酸度,对泡菜的质量有一定的意义。
2.4主要代谢产物含量的变化
乳酸是泡菜发酵的主要有机酸,其含量直接影响泡菜中菌系的稳定性。乙酸作为异型乳酸发酵菌株的代谢产物之一,适量的乙酸[17]可以有效提高泡菜的感官性质。乙醇主要来源于酵母菌的代谢,乙醇的变化可以有效地反映酵母在泡菜发酵过程中的活动。

图4 发酵过程中主要代谢产物浓度的变化Fig.4 Changes in metabolic products during the fermentation
图4描述了3 种主要代谢产物在泡菜发酵过程中的变化趋势。在发酵初期,乳酸的含量缓慢升高,随后其含量迅速增加,直至后期缓慢上升。而乙酸的含量在整个发酵过程中都表现出较缓慢地增加,且发酵前期的变化要较中后期明显。乙醇的增加主要出现在前4 d,其后趋于平稳。
在发酵前期虽然有大量的蔗糖被利用,但乳酸的含量却缓慢增加,一方面,由于有真菌的存在,相当一部分的蔗糖被利用但是不产乳酸,另一方面,前期主导发酵的是异型乳酸发酵的乳酸菌,与同型乳酸发酵菌相比,其消耗等量蔗糖却只能产生更少量的乳酸[15]。发酵中期,产酸能力较强的同型乳酸发酵菌大量生长繁殖并主导泡菜的发酵,使得泡菜液中乳酸含量在发酵中期迅速增加。在发酵后期,虽然蔗糖被稳定地利用,但此时泡菜中的一些环境因素(如高浓度酸,低pH值)已经在一定程度上对乳酸菌有了抑制作用,乳酸菌需要消耗更多的三磷酸腺苷(adenosine triphosphate,ATP)来维持细胞内的pH值稳定,同时也调节自身的代谢活动产生更少的乳酸。乙酸是异型乳酸发酵菌株通过异型乳酸发酵途径的产物之一[18],其变化主要源于乳酸菌的产生和泡菜组织的渗出,前期异型乳酸菌的迅速增长使乙酸含量有了明显增加,随着酸度的升高,异型乳酸菌由于较弱的耐酸性而死亡,乙酸的变化主要由泡菜组织渗出而显得变化不大。在发酵前期,pH值较适宜酵母的生长时,酵母菌和异型乳酸发酵菌株利用蔗糖产生较多的乙醇,发酵3 d后,由于pH值较低,酵母菌和异型乳酸发酵菌株逐渐死亡,导致乙醇的量也趋于稳定。
3 结 论
通过对我国传统自然发酵泡菜的研究发现,在发酵前2 d,乳酸菌活菌数迅速升高,之后趋于稳定;酵母菌、霉菌和醋酸菌在发酵前期都有较明显的生长,但中期后逐渐消亡;泡菜液pH值在发酵的初始为5.7,随着发酵进行急剧下降,发酵末期达到3.2;蔗糖作为主要的碳源在整个发酵过程中都明显地被代谢,然而作为碳源的葡萄糖和果糖含量没有明显变化;柠檬酸和苹果酸在发酵过程中也可被代谢利用;乳酸是乳酸菌在泡菜发酵中的主要产物,其含量在发酵过程中稳定地上升;乙醇和乙酸的生成主要在泡菜发酵的前期。在自然发酵泡菜中微生物的变化及其代谢特性的研究基础上,可进一步研究单菌种发酵泡菜及多菌种发酵泡菜的控制机理,进而提升对我国泡菜的理论研究及工业生产水平。
[1] 关倩倩. 我国传统发酵泡菜菌系结构及其消长规律研究[D]. 南昌:南昌大学, 2012.
[2] 李书华, 陈封政. 泡菜的研究进展及生产中存在的问题[J]. 食品科技, 2007, 32(3): 8-11.
[3] XIONG Tao, SONG Suhua, HUANG Xuhui, et al. Screening and identification of functional lactobacillus specific for vegetable fermentation[J]. Journal of Food Science, 2013, 78(1): 84-89.
[4] 燕平梅, 谢腾云, 高继萍, 等. 泡白菜卤中优势微生物的分离鉴定及抗菌特性的研究[J]. 中国酿造, 2010, 29(5): 99-102.
[5] 张伟. 泡菜微生态的研究[D]. 成都: 四川大学, 2006.
[6] 陈功, 张其圣, 余文华. 四川泡菜挥发性成分及主体风味物质的研究(二)[J]. 中国酿造, 2010, 29(12): 19-23.
[7] 周帼萍, 汪芳安, 高冰. 醋酸菌筛选培养基的优化和优良醋酸菌分离的研究[J]. 中国酿造, 2004, 23(6): 18-19.
[8] XIONG Tao, GUAN Qianqian, SONG Suhua, et al. Dynamic changes of lactic acid bacteria flora during Chinese sauerkraut fermentation[J]. Food Control, 2012, 26(1): 178-181.
[9] 施安辉, 周波. 蔬菜传统腌制发酵工艺过程中微生物生态学的意义[J].中国调味品, 2002, 27(5): 11-15.
[10] 陈飞平. 微生物发酵对蔬菜腌制品品质的影响[J]. 中国食物与营养,2009, 15(9): 28-30.
[11] SCHMITT P, DIVI☒S C, CARDOMA R. Origin of end-products from the co-metabolism of glucose and citrate by Leuconostoc mesenteroides subsp. cremoris[J]. Applied Microbiology Biotechnology, 1922, 36(5): 679-683.
[12] JOHANNINGSMEIER S D, FLEMING H P, BREIDT F. Malolactic activity of lactic acid bacteria during sauerkraut fermentation[J]. Journal of Food Science, 2004, 69(8): 222-227.
[13] GONZALEZ C F, KUNKA B S. Evidence for plasmid linkage of raffinose utilization and associated α-galactosidase and sucrose hydrolase activity in Pediococcus pentosaceus[J]. Applied and Environmental Microbiology, 1986, 51(1): 105-109.
[14] MITAL B K, SHALLENBERGER R S, STEINKRAUS K H. α-Galactosidase activity of lactobacilli[J]. Journal of Applied Microbiology, 1973, 26(5): 783-788.
[15] XIONG Tao, LI Xiao, GUAN Qianqian, et al. Starterculture fermentation of Chinese sauerkraut: growth, acidification and metabolic analyses[J]. Food Control, 2014, 41: 122-127.
[16] FLEMING H P, MCFEETERS R F, DAESCHEL M A. The Lactobacilli, Pediococci, and Leuconostocs: vegetable products[M]// GILLIAND S E. Bacterial starter cultures of foods. Boca Raton: CRC Press, 1985: 97-118.
[17] OLIVEIRA R P S, PEREGO P, OLIVEIRA M N, et al. Growth,organic acids profile and sugar metabolism of Bifidobacterium lactis in co-culture with Streptococcus tvhermophilus: the inulin effect[J]. Food Research International, 2012, 48(1): 21-27.
[18] KANDLER O. Carbohydrate metabolism in lactic acid bacteria[J]. Antonie van Leeuwenhoek, 1983, 49(3): 209-224.
Changes and Metabolic Characteristics of Main Microorganisms during Chinese Sauerkraut Fermentation
XIONG Tao, PENG Fei, LI Xiao, LI Junbo, GUAN Qianqian
(State Key Laboratory of Food Science and Technology, College of Life Science and Food Engineering, Nanchang University,Nanchang 330047, China)
Laboratory scale fermentations of Chinese sauerkraut were performed to investigate the changes in microorganisms, the pH of the brine, the substrates and the metabolic products. The main microorganisms were monitored using selective agar medium. The substrates and the metabolic products were analyzed by high performance liquid chromatography. The results evidenced that the main microorganisms included lactic acid bacteria, acetic bacteria,saccharomycetes and mycete. The pH was reduced from 5.7 to 3.2 after 7 days of fermentation. The utilization of sucrose during the fermentation was strong, as indicated by a reduction from 74.4 to 18.4 mmol/L. However, glucose and fructose were hardly metabolized by the cells and their final concentration were 28.1 mmol/L and 23.2 mmol/L, respectively. Critic acid and malic acid were easily metabolized during the fermentation and their maximum concentrations, (3.4 and 8.9 mmol/L,respectively) were observed after 24 and 12 h of fermentation followed by a decline until reaching a plateau. As the major metabolic product, lactic acid was steadily increased from 5.6 to 149.6 mmol/L during the fermentation; moreover, the levels of ethanol and acetic acid increased in the early stage of the fermentation process.
Chinese sauerkraut; lactic acid bacteria; fermentation; metabolism
TS201.3
A
1002-6630(2015)03-0158-04
10.7506/spkx1002-6630-201503030
2014-04-09
“赣鄱英才555工程”领军人才培养计划项目(18000063);江西省教育厅高校科技落地计划项目(赣财教[2011]243号);国家重点实验室自由探索课题(SKLF-ZZB-201309);国家高技术研究发展计划(863计划)项目(2011AA100904)
熊涛(1970—),男,教授,博士,研究方向为益生菌及大宗果蔬高值化利用。E-mail:xiongtao0907@163.com

