外用药物制剂药品生产质量管理规范实施现状分析与研究
庞凤华 邓子杰 邓小群 陈珊丽
1.广州白云山制药股份有限公司白云山何济公制药厂,广东广州 510410;2.广州共禾医药科技有限公司,广东广州 510663
药品生产质量管理规范(GMP)作为药品生产全过程中必须遵循的质量监督的法定技术规范,已经在世界上大部分国家中被广泛应用,能有效地保证药品生产质量,并为安全有效用药提供可靠保障[1-2]。
外用药物制剂生产企业实施新版药品GMP的时候应当重新审视其重要性,在面临各种实施的挑战中,不断地提高自身的质量管理的水平,建立更高效的药品生产和管理体系,提高外用药物制剂的质量水平,从根本上保证药品质量,有效地促进药品生产的质量保障;在全球经济一体化的背景下,更多参与国际范围的竞争中,使药品真正达到国际水平,走向现代化、国际化。
1 我国外用药物制剂GMP的实施现状分析
自我国GMP推出后,经历十多年的实施,仍有许多制药企业在开展实施的进程中受到工艺技术、培训机制和投入产出等因素的约束[3],执行GMP不到位的现象普遍存在,特别是外用药无菌制剂[4]制药企业企依然存在一些迫切需要解决的问题:①当前国内的外用药物制剂企业素质有高有低,掌握新版GMP认证标准的尺度各异。②当前国内的外用药物制剂企业存在着注册制备工艺、注册标准与车间生产实际不相符,但申请注册工艺内容变更的相关手续比较繁琐,需要各级要政部门严格审批。③当前国内的外用药物制剂企业的真正最大风险是药品注册研发所带来的历史遗留问题,而不是洁净区级别的提升。④目前外用药物制剂企业实施新版GMP遇到的最大困难是如何实现工艺设备控制污染以及交叉污染的方式和手段,企业必须配备必要的清洗消毒区域、清洗消毒专用设备,增设公用系统管路,扩充公用系统[5]。⑤本次新版GMP的修订,针对软件方面的要求明显增强,需要不断加大高水平的专业技术人才的投入。⑥严格执行新版GMP的认证标准尺度和执行力度的问题,能直接影响新版GMP执行的效果和影响制药企业的主观能动性。
在此建议设置一个公平、公正的新版GMP认证检查管理体系,通过公平、科学的认证检查做到真正的优胜劣汰,使优秀的外用药物制剂企业能够真正脱颖而出,激发外用药物制剂企业的主观能动性,从而进一步提升药企的市场竞争力。
2 某制药集团属下25家药企实施2010版GMP的现状调查
某制药集团是华南地区最大的医药生产和流通企业,现有员工2万多名。拥有现代化的生产厂房,全部获得GMP认证,可生产片剂、注射剂、胶囊剂、颗粒剂、软胶囊、乳膏剂、贴膏剂和搽剂等20多种剂型的中西药产品。作为中国华南地区最大的药品生产基地,在我国华南地区制药企业中具有一定的代表性。笔者于2012年10月~2014年1月,对某制药集团属下25家制药企业对2010版GMP的实施情况进行了调查。
在本次调研的某制药集团属下25家制药企业中,无菌制剂企业为10家(40%)(含生物制品生产企业2家),普通制剂企业为24家(96%),中药饮片企业为8家(32%)。调查的主要方式为现场走访和交流调研分析。
2.1 本次对25家企业的调研结果
在25家药品生产企业中,生产企业含无菌制剂,其关键工序的洁净级别为C级的有21家(占84%);企业灌封工序为C+B级以上的企业有12家(占48%)。25家企业中保证了对原辅料全检工作的有16家(64%);能够对成品进行全检的有 20家(80%),2家(8%)由于没有标准品而不能完成全检工作。在对中间产品的质量监控方面,绝大多数的企业对中间产品进行了质量监控,但在控制的项目方面,缺少较全面的科学评估。25家药品生产企业中,按照注册处方要求未改变药品生产的工艺及参数的有24家(96%);企业未变更过原辅料、包材供应商稳定性较好的有17家(68%),变更1次的有 6家(24%),变更 2次有1家(4%),变更2次以上的有1家(4%)。25家企业对关键制药设备、清洁消毒程序、检测方法等进行确认和验证情况:在一些GMP实施的薄弱环节,该制药集团下属企业有18家(72%)的药企落实开展了偏差管理、变更控制、风险评估;21家(84%)企业开展了在产品种的稳定性考察工作;19家(76%)企业详细记录了对标准品、对照品及标准溶液、对照品溶液、菌种传代的使用和销毁记录;13家(52%)企业对生产全过程中的中间产品、待包装产品的有效期进行了留样考察;19家(76%)企业认真开展新版GMP的自检工作,并认真完成相配套的自检报告和自检记录工作,将工艺验证、设备验证、清洁验证、年度质量回顾以及确认的数据运用于制药生产过程控制中。
2.2 对该制药集团下属企业执行新版GMP认证检查的缺陷分布及分析
对该制药集团下属企业执行新版GMP认证检查的缺陷分布情况见表1。通过对本次现场检查以及调研数据的综合分析,企业实际执行情况与新版GMP的要求还存在一定的差距,主要表现在以下几个方面:①质量管理体系的强效型有待增强;②相关岗位操作人员的培训效果、持续性和针对性有待增强;③生产设备对清洁验证没有落实到位;④生产物料出入库管理不规范;⑤确认和验证的系统性与科学性有待完善;⑥文件管理方面的条理明晰性不强;⑦无菌条件下的灌封操作风险的预防控制措施不足。
企业应该根据各自的缺陷项,从以上几个方面加强新版GMP的执行力度,不能仅限于新版GMP的认证检查过程中,应该保证新版GMP执行的日常化和GMP管理的常态化,只有保证了日常的GMP实施,才能有效地保证药品生产的高质量、低风险,有效地促进药品生产的质量保障[6-7]。
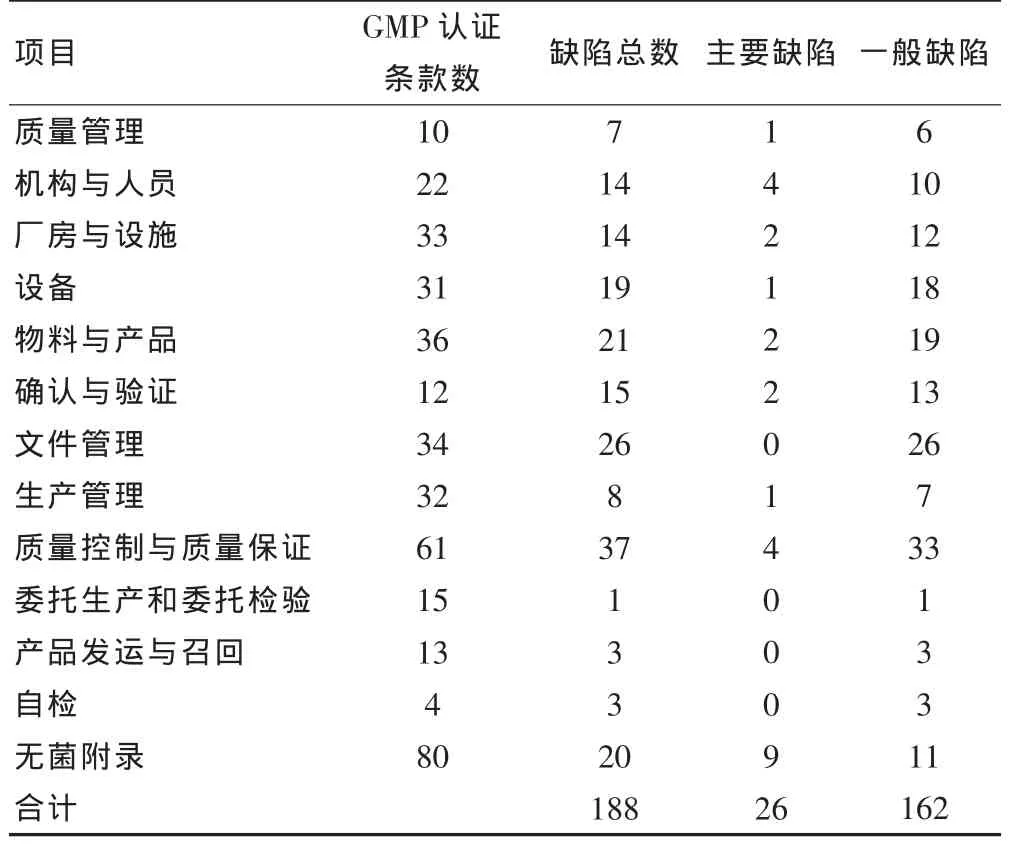
表1 本次2010版GMP认证调查检查本各类缺陷分布情况(个)
3 我国外用药物制剂生产企业实施GMP的现状分析
3.1 外用药物制剂生产企业概况
外用药物制剂是我国医药市场中不可或缺的一部分,由于外用药物制剂的本身的特点,使用方便,应用广泛,通过局部给药而达到全身治疗作用等,其种类也较多,横跨十几种剂型。检索国家食品药品监督管理总局的官方网站进行外用药物制剂的生产企业的数据,发现生产软膏剂的企业有361家、乳膏剂306家、搽剂222家、凝胶剂206家、栓剂173家、贴膏剂中橡胶膏剂94家、洗剂180家,外用药物制剂是一个广阔的医药市场。据不完全统计,外用药物制剂的销售额占医药销售收入份额的10%~15%,在未来的几年,外用药物制剂的份额有望进一步提升[8]。
皮肤病药物市场最大的特点之一就是OTC终端市场占有比例较大,因此如何做好产品的宣传,提高产品的知名度,创立品牌优势,将直接影响到产品的销售市场的扩大。
3.2 GMP在外用药物制剂生产企业的实施现状分析
由于外用药物制剂本身的特点,以皮肤科用药、外用贴膏、妇科用药以及外用涂搽方式等药用剂型,主要通过皮肤进行透皮吸收或者是通过腔道给药等,其风险相对较小,这也使外用药物制剂生产企业在实施GMP[9-10]的过程中相对较为松弛,同时也会导致外用药物制剂药品GMP实施效果较差,这与外用药物制剂生产企业的质量意识较薄弱有关,同时,也与药品监管部门对外用药物制剂的监督相对偏弱等有关,外用制剂生产企业在实施GMP中遇到的问题,主要体现在以下6个方面:①外用药物制剂企业的药品生产质量管理意识不强;②外用药物制剂的生产企业的职责分工不明确;③文件管理系统不够完善,执行性不强;④对原辅料、包装材料的供应商审核不到位;⑤验证工作不到位,人员对验证工作的不重视;⑥监管的力度不强,对外用药物制剂监管忽视。
为使我国可以与先进的药品生产质量管理体系接轨,更好地参与国际竞争,同时也是提高国内的药品生产质量的要求,实现我国从医药大国到医药强国的转变。虽然外用药物制剂的药品GMP认证周期会延续到2015年12月31日,很多生产企业还持观望的认态度,但这些都是徒劳的。因此,外用药物制剂生产企业都应该端正自己的态度,认识到自己的一些不足,抓紧有限的认证周期,全面加入新版药品GMP的认证工作中去,争取早日拿到GMP证书。
综上所述,外用药物制剂生产企业实施新版药品GMP的时候应当重新审视其重要性,在面临各种实施的挑战中,不断地提高GMP的水平[12-13]。在参与国际范围的竞争中,外用药物制剂生产企业可以积极准备药品GMP的实施认证工作,建立更高效的药品生产和管理体系,提高外用药物制剂的质量水平,从根本上可以保证药品质量,为实现我国从医药大国到医药强国的改变而不断进步[14-15]。
[1]孙忠达.GMP管理中“机构与人员”工作的探讨[J].上海医药,2002,23(1):32.
[2]申丽莎.药品生产质量管理规范(GMP)在我国的实施与展望[J].重庆中草药研究,2010,61(1):33-37.
[3]冯盛威,邓乔华.谈谈认证后GMP的实施[J].广东药学,2005,15(1):68.
[4]刘树林.无菌药品生产企业实施2010版GMP的策略研究[D].天津:天津大学,2011:5-10.
[5]陈玉龙,李婵.对陕西省药品GMP认证实践的思考[J].西北药学杂志,2006,21(1):41.
[6]谢博生.关于推进实施GMP的思考[J].中国药事,2008,22(10):847.
[7]陈广龙.药品生产实施GMP存在的问题及探讨[J].中国药事,2005,19(1):53-55.
[8]屈浩鹏,刘燕鲁.对北京市药品生产企业GMP认证工作的几点建议[J].首都医药,2000,7(5):13.
[9]李荣.GMP与我国药业现状及对策[J].中国药事,2003,17(7):447.
[10]林桂梅.谈对实施 GMP的认识[J].海峡药学,2005,17(5):193-194.
[11] 黄胜炎.国外新外用制剂[J].上海医药,2012,33(1):16-17.
[12]张星一.透皮吸收促进剂在经皮给药系统中的质控和评价方法[J].中国新药杂志,2010,19(4):273-276.
[13]庞凤华,温恺嘉,吴传斌.药品生产质量管理规范在外用药制剂生产管理中的应用[J].今日药学,2012,9(1):40-45.
[14]张睿智.河南省保健食品的现状及对策[J].中国医药导报,2012,9(36):155-158.
[15]李红艳,陈爱青.6σ管理在药品生产质量管理过程中应用的可行性分析[J].医学与社会,2008,12:31-32.

