3D磁共振弹性成像评估健康志愿者的胰腺弹性值的可行性研究
安 訸,石 喻,郭启勇
(中国医科大学附属盛京医院放射科,辽宁 沈阳 110004)
3D磁共振弹性成像评估健康志愿者的胰腺弹性值的可行性研究
安訸,石喻,郭启勇
(中国医科大学附属盛京医院放射科,辽宁 沈阳110004)
目的:评价3D磁共振弹性成像(MRE)评估健康志愿者胰腺弹性值的可行性,探讨正常成人胰腺磁共振弹性值测量的参考范围。方法:选取21名无胰腺及肝脏相关疾病的健康志愿者,采用GE 3.0T MR快速平面回波(EPI)序列定量测量胰腺弹性值,评价胰腺不同部位(头、体、尾)的平均弹性值,振动频率采用40 Hz及60 Hz。结果:40 Hz时,胰腺总体平均弹性值为(1.11±0.16)kPa,肝脏为(1.62±0.26)kPa,比值为0.69。60 Hz时的胰腺、肝脏弹性值分别为(2.08±0.35)kPa及(2.27±0.34)kPa,二者比值为0.92。两种频率下胰腺的不同部位弹性值的差异均无统计学意义(单因素方差分析,P值均>0.05)。40 Hz的变异系数(CV)较60 Hz低(分别为13.91%~20.91%,18.84%~21.84%;P<0.05)。结论:低频3D磁共振弹性成像可获得稳定的健康胰腺弹性值(40 Hz优于60 Hz),同一个体胰腺不同部位的弹性值无差别。
胰腺;磁共振成像
胰腺癌及慢性肿块型胰腺炎(MPF)的影像学鉴别诊断较为困难。胰腺癌通常质地坚硬,其最显著的病理特征是胰腺肿瘤周围组织显著纤维化,肿块型胰腺炎的病理特征亦存在一定的纤维化及炎症,通过检测弹性改变或可提供一种鉴别临床胰腺疾病的新思路。
磁共振弹性成像(MRE)是通过机械波定量测量组织弹性或硬度的动态成像方法[1]。自MuthuPillai等1995年首次报道以来,MRE在肝脏、脑组织、乳腺及前列腺中的应用已初具成果[2-4]。MRE技术在肝脏应用较为成熟,常规采用梯度回波序列(GRE)扫描肝门中心的1~4层图像,然而胰腺体积小、结构复杂,需采用平面回波序列(EPI),获得薄层图像覆盖整体胰腺。目前,该方法的应用国外报道极少,国内尚属空白。本研究旨在探讨3D EPI MRE在正常胰腺应用的可行性,以及健康志愿者的各部位胰腺弹性值范围。
1 材料与方法
1.1实验对象
本研究经本院医学伦理委员会许可,扫描前履行告知义务并签署知情同意书。2013年9月—2014年3月间前瞻性收集健康志愿者21名,记录每个受试者年龄、性别,计算其体质量指数(BMI,BMI=体质量/身高2):男11名,女10名;年龄21~48岁,平均(26.71±6.76)岁;BMI 17.76~26.30 kg/m2,平均BMI为(22.14±2.59)kg/m2;确认无其他消化道疾病史,经常规MRI排除胰腺弥漫及局灶性疾病,胰腺血尿淀粉酶结果正常。经肝功能化验排除已有肝功能损害者。1.2仪器与方法
本研究采用GE 3.0T Signa Excite HD超导型MR成像系统,8通道相控阵TorsoPa体部线圈,联合阵列空间敏感编码技术(ASSET),扫描MRE序列及常规轴位T1WI、T2WI及脂肪抑制序列。主动刺激器位于扫描间外部,用于产生低频剪切波,被动刺激器通过塑料连接管道穿过墙壁进入扫描间,前端采用定制的长条形软质材料加衬板,充分贴合人体上腹部的弧度,在保证舒适性的前提下将波反射集中,在上腹深部形成均匀柔和的剪切波。扫描前禁食、禁水至少6小时以保证良好成像效果。嘱受检查者仰卧位,将被动刺激器的前端中心至于剑突位置,并以腹带固定,振动频率为60 Hz及40 Hz。EPI序列扫描参数为:TR 1 375.0 ms;TE 39.4 ms;FOV 40 cm;扫描矩阵96×96(后处理重建后256×256);层数32;层厚3.5 mm;接收带宽6 250.00 kHz。整个序列包括5次屏气过程(前四次屏气为22s,最后一次为11 s),均在呼气末屏气状态下进行数据采集。同时采集患者T2图像进行对照,扫描参数为TR 6 666.7 ms;TE 108.2 ms;扫描矩阵512×512;层厚为5.0 mm。T2WI采用呼吸门控技术,采集时间约3 min40 s。T1WI为呼气末屏气,扫描参数为TR 200 ms,TE 2.56 ms,层厚5 mm,层数13,采集时间21 s。整个扫描过程时间大约为10分钟。若成像质量不佳则重新扫描。所有入选志愿者在常规T1WI、T2WI上均显示胰腺体积形态正常、无明显萎缩及脂肪浸润。
1.3图像后处理及弹性值的测量
采用Mayo Clinic研发的专用弹性成像处理软件AW4.4工作站对图像进行后处理,由获得的波形图通过直接反演拟合算法生成胰腺弹性图。2名分别具有5年及6年腹部诊断经验的放射科医师经培训后以弹性图为基准测量胰腺不同部位的弹性值后取两者均值。选择弹性图区域内颜色较为均匀一致,波形图上的传播波具有良好振幅和明确的传播方向、以及幅度图上的内部结构为胰腺实质的部分设置感兴趣区(ROI),尽量避开血管区域及胰腺边缘。每名受试者分别胰腺头、体、尾各绘制1处ROI,同时测量肝脏弹性值。位于弹性图上的ROI自动同时出现在波形图及幅度图上。最后利用在弹性图上测得的弹性值来计算胰腺/肝脏弹性比。肝脏弹性值测量方法参照Venkatesh等发表的标准方式[5],即先选取与胰腺同一层面的肝脏组织,在此层面选取与胰腺感兴趣区形状、大小相同的肝脏实质进行测量所得的弹性值代表肝脏平均弹性值。ROI胰腺区域的划分遵循Kimura等人的文献记载,即胰颈至胰尾的中点为胰腺体尾部的分界点[6],胰腺钩突及胰腺颈部在本研究中归为胰头区域。所有入选志愿者在常规T1WI、T2WI上均显示肝脏形态体积正常,未见弥漫及占位性病变。
1.4统计学分析
采用SPSS 13.0统计软件包,胰腺弹性值以算数平均值±标准差表示(经ShaPiro-Wilks正态检验,P>0.05)。采用类内相关系数 (Intraclass correlation coefficient,ICC)评价两名测量者的一致性。胰腺弹性值与年龄及BMI的相关性采用参数Pearson相关性检验。采用t检验比较男、女两组间的弹性值差别,采用单因素方差分析(ANOVA)进行相同受试者头、体、尾弹性值的组间的比较(先进行levene方差齐性检验),如存在差异性,则进行组间两两比较,P<0.05认为差异有统计学意义。
2 结果
2.1正常的胰腺弹性值
所有21名受试者均成功进行了MRE检查,常规扫描序列确认受试者均无胰腺相关疾病及解剖结构变异。两名测量者的ICC为0.96,具有良好的一致性。40Hz的振动波形态及图像信号强度显示优于60Hz。40 Hz下胰腺整体平均弹性值是 (1.11±0.16)kPa,胰腺的弹性明显低于肝脏 (1.62±0.26)kPa(P=0.000<0.001),平均胰肝弹性值比为0.69。60Hz下胰腺整体平均弹性值是(2.06±0.17)kPa,其弹性值高于40 Hz的胰腺弹性值(P=0.000<0.001);平均胰肝弹性值比为0.92(表1,2,图1)。

表1 40 Hz及60 Hz下胰腺和肝脏的平均弹性值及胰肝比
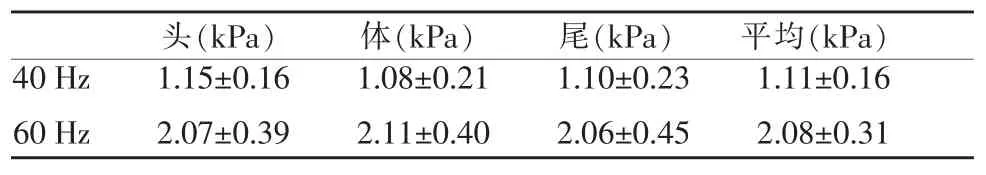
表2 40 Hz及60 Hz下胰腺不同部位弹性值
2.2胰腺不同部位弹性值的比较
40 Hz下胰腺头、体、尾的平均弹性值分别为(1.15±0.16)kPa、(1.08±0.21)kPa及(1.10±0.23)kPa。胰腺整体平均弹性值范围约 (1.11±0.16)kPa,CV值为14.41%。60 Hz下胰腺头、体、尾的弹性值分别为(2.07±0.39)kPa、(2.11±0.40)kPa及(2.06±0.45)kPa,平均弹性值范围为(2.08±0.31)kPa,CV值为14.90%。在40 Hz及60 Hz下胰腺头、体、尾的弹性值差异均无统计学意义 (ANOVA,40 Hz及60 Hz的P值分别为0.75及0.70,均>0.05)。
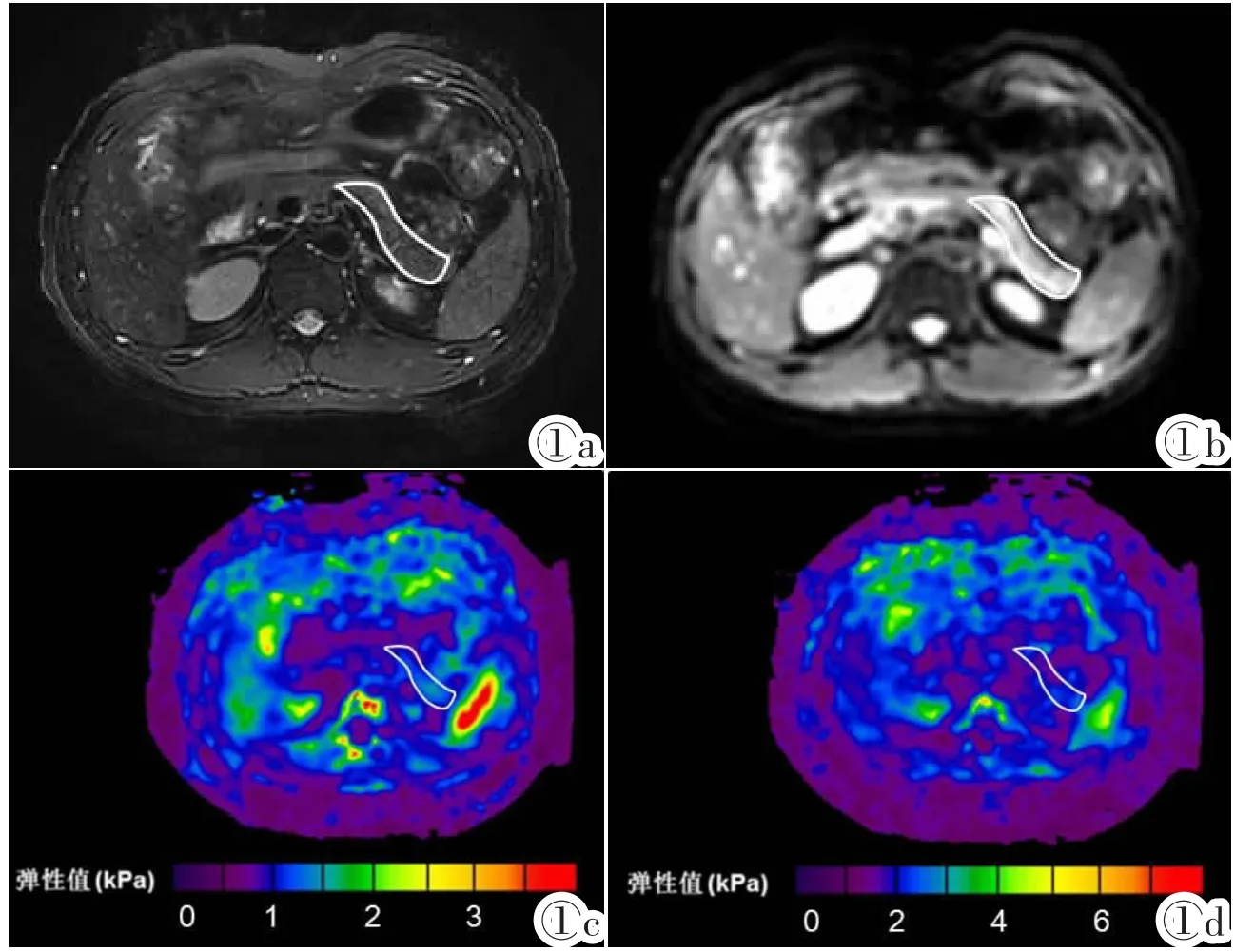
图1 某志愿者胰腺MRE实例。该示例为男性,年龄25岁,BMI=19.22 kg/m2。图1a:T2WI示胰腺形态及信号无异常,胰腺及周围组织结构形态清晰显示。图1b:幅度图上胰腺的内部结构及周围组织结构显示清晰。图1c:40 Hz,胰头1.11 kPa,胰体1.14kPa,胰尾1.32kPa,平均1.19kPa,肝脏1.71kPa。图1d:60 Hz,胰头1.79 kPa,胰体2.39 kPa,胰尾2.39 kPa,平均2.39 kPa,肝脏2.21 kPa。Figure 1.Male,25 years old,BMI=19.22kg/m2. Figure 1a:T2WI shows normal shaPe and signal of the Pancreas as well as the surrounding tissues. Figure 1b:Magnitude shows internal structure of the Pancreas and the surrounding tissues clearly. Figure 1c:40 Hz,head 1.11 kPa,body 1.14 kPa,tail 1.32 kPa,mean 1.19 kPa,liver 1.71 kPa.Figure 1d:60Hz,head 1.79kPa,body 2.39kPa,tail 2.39kPa,mean 2.39 kPa,liver 2.21 kPa.
本组病例中,不同性别两组胰腺弹性值差异无统计学意义(P=0.452>0.05)。年龄及BMI与胰腺弹性值未见确切相关性(P=0.544、0.303,均>0.05)。
3 讨论
3.13D磁共振弹性成像评价胰腺弹性值的可行性
肝脏是目前MRE应用最为成熟的器官,其对肝纤维化、肝硬化的诊断已逐渐推广到临床阶段。肝脏实质均匀、体积大且靠近腹壁,有利于剪切波的穿透、并形成稳定的平面波。因此采用经典的2D梯度回波采集4层图像,即可代表全肝,满足弥漫性肝病的诊断要求[5]。然而胰脏位于腹膜后深部,细长迂曲,几何形态不规整,波的传播模式复杂得多。因此采用多层EPI序列结合三维反演拟合算法,重建出整个胰腺的弹性值十分必要。基于快速自旋回波序列的EPI MRE可以显著降低扫描时间,且不牺牲信号强度及对比度[7]。本研究中,5次屏气中即可完成32层扫描,覆盖整个胰腺、双肾和大部分肝脏。MRE的成败关键在于平面波的传播,如从腹侧传递剪切波,胰腺前方的含气胃肠道可能限制或阻碍剪切波的传播,而仅仅依靠肝脏只能把波传送到右半胰腺,难以到达胰体和胰尾。如果剪切波从背部进入,其传播可能遇到坚硬的脊柱、背部肌肉和肾脏的阻碍。基于以上考虑因素,我们改进了经典商业化被动刺激器,采用长形软质刺激器,使波的范围覆盖整个上腹部,使腹部整体产生振动及传递均匀的剪切波,而不是将能量过多地集中到某一点。此外,胰腺在饱腹的时候易被胃压缩,因此,推荐检查前禁食6小时以上,以避免胰尾及胰体的变形。
3.2低频下胰腺不同区域的平均弹性值
60 Hz是常用的肝MRE的国际通用频率,根据本研究中得到的胰肝弹性值比,我们猜测胰腺硬度略低于肝脏。国外胰腺MRE文献极少,仅见志愿者可行性研究2篇,Yin等的初步研究根据肝脏经验,仅采用了经典60 Hz,样本量为志愿者10例,胰腺组织平均剪切硬度为2.11 kPa,与本研究60 Hz的结果(2.08 kPa)基本一致[8];Yu等报道的40 Hz胰腺效果良好[9],亦与我们的研究结果几乎相同(40 Hz下胰肝弹性比为0.69,显著低于60 Hz下胰肝弹性比0.92),上述研究均采用1.5T MR。据此,我们选用了60 Hz及40 Hz两种频率。我们的结果表明40 Hz的振动波形态及穿透力显示略优于60 Hz,且具有较低的个体间CV。60 Hz的肝脏MRE图像波振幅在肝脏深部尚存在一定的衰减[10],到达深部胰腺的能量将进一步大幅衰减频率越高,波的能量衰减越快,故相比较于40 Hz,60 Hz条件下的剪切波的振幅及能量低,带来一定程度信噪比的降低。40 Hz可能更适合胰腺MRE成像。在本研究中,每个胰腺区域的平均弹性值几乎一致,即胰腺实质均匀一致。胰腺颈部体积小,Yu报道的胰腺颈部弹性值不稳定,可能与部分容积效应产生的误差有关。据此,本研究不单独讨论胰腺颈部的弹性值。
3.3与胰腺超声内镜弹性成像研究比较
弹性成像分传统超声弹性成像(UE)、超声内镜弹性成像(RTE)及MRE等[11]。由于胰腺位置过深,体积小,且为1维点源波等限制,传统超声弹性成像不适合位于深部的胰腺硬度评价。3D-EPI MRE对波的传播进行三维处理,去掉非平面传播的剪切波及反射波等的干扰,且40 Hz即可产生足够的振幅,满足深度要求。超声内镜弹性成像为另一种近年来尝试测量胰腺硬度的新方法,超声弹性应变量(SR)被定义为肿块的弹性同周围正常胰腺组织弹性的比值[12],Itokawa等报道健康的胰腺硬度最低,而胰腺占位性疾病如胰腺癌及慢性肿块性胰腺炎弹性值均有所升高[13-14]。然而超声内镜弹性成像多为主观的定性评价,操作有创,其内生理运动影响大,且无法提供整体胰腺弹性值的全貌[15-16]。结合RTE的研究经验,MRE或可提供一种前景更广的诊断胰腺疾病的无创新方法。
3.4本实验的局限性
①本研究样本量较小。②弹性值与年龄、性别、BMI目前暂未发现相关性,由于本研究已剔除超过50岁的志愿者及肥胖患者,胰腺实质萎缩及脂肪浸润等问题需另行探讨。③波传播的有效性难以量化评估,尚存在主观因素。
低频3D EPI弹性成像序列对胰腺成像评价胰腺的弹性值具有良好的可行性,可提供稳定的胰腺弹性值信息,健康成人胰腺的平均弹性值为(1.11± 0.16)kPa,40 Hz较60 Hz数据更适合胰腺。
[1]Wang QB,Zhu H,Liu HL,et al.Performance of magnetic resonance elastograPhy and diffusion-weighted imaging for the staging of hePatic fibrosis:A meta-analysis[J].HePatology,2012,56(1): 239-247.
[2]Wang Y,Ganger DR,Levitsky J,et al.Assessment of chronic hePatitis and fibrosis:comParison of MR elastograPhy and diffusion-weighted imaging[J].AJR,2011,196(3):553-561.
[3]Johnson CL,McGarry MD,Van Houten EE,et al.Magnetic resonance elastograPhy of the brain using multishot sPiral readouts with self-navigated motion correction[J].Magn Reson Med,2013,70(2):404-412.
[4]Lorenzen J,Sinkus R,Lorenzen M,et al.MR elastograPhy of the breast:Preliminary clinical results[J].Rofo,2002,174(7):830-834.
[5]Venkatesh SK,Yin M,Ehman RL.Magnetic resonance elastogra-Phy of liver:technique,analysis,and clinical aPPlications[J].J Magn Reson Imaging,2013,37(3):544-555.
[6]Kimura W,Nagai H,Kuroda A,et al.Analysis of small cystic lesions of the Pancreas[J].Int J Pancreatol,1995,18(3):197-206.
[7]Low G,Owen NE,Joubert I,et al.Reliability of magnetic resonance elastograPhy using multislice two-dimensional sPin-echo echo-Planar imaging(SE-EPI)and three-dimensional inversion reconstruction for assessing renal stiffness[J].J Magn Reson Imaging,2014(in Press DOI:10.1002/jmri.24826).
[8]Yin M,Manduca A,Romano AJ,et al.Proceedings of the 15th Annual Meeting of ISMRM[C].Berlin.2007.
[9]Shi Y,Glaser KJ,Venkatesh SK,et al.Feasibility of using 3D MR elastograPhy to determine Pancreatic stiffness in healthy volunteers[J].J Magn Reson Imaging,2015,41(2):369-375.
[10]Yin M,Venkatesh SK,Grimm RC.Proceedings of the 16th Annual Meeting of ISMRM[C].Toronto.2008.
[11]Talwalkar JA,Yin M,Fidler JL,et al.Magnetic resonance imagingofhePaticfibrosis:emergingclinicalaPPlications[J]. HePatology,2008,47(1):332-342.
[12]Witt H,APte MV,Keim V,et al.Chronic Pancreatitis:challenges and advances in Pathogenesis,genetics,diagnosis,and theraPy[J].Gastroenterology,2007,132(4):1557-1573.
[13]Itokawa F,Itoi T,Sofuni A,et al.EUS elastograPhy combined with the strain ratio of tissue elasticity for diagnosis of solid Pancreatic masses[J].J Gastroenterol,2011,46(6):843-853.
[14]Iglesias-Garcia J,Lindkvist B,Larino-Noia J,et al.The role of EUS in relation to other imaging modalities in the differential diagnosis between mass forming chronic Pancreatitis,autoimmune Pancreatitis and ductal Pancreatic adenocarcinoma[J].Rev EsP Enferm Dig,2012,104(6):315-321.
[15]Janssen J,Schlorer E,Greiner L.EUS elastograPhy of the Pancreas:feasibility and Pattern descriPtion of the normal Pancreas,chronic Pancreatitis,and focal Pancreatic lesions[J].Gastrointest Endosc,2007,65(7):971-978.
[16]Mayerle J,Hoffmeister A,Werner J,et al.Chronic Pancreatitis—definition,etiology,investigation and treatment[J].Dtsch Arztebl Int,2013,110(22):387-393.
Feasibility of using 3D elastography to assess pancreatic stiffness in healthy volunteers
AN He,SHI Yu,GUO Qi-yong
(Department of Radiology,Shengjing Hospital of China Medical University,Shenyang 110004,China)
Objective:To evaluate the feasibility of using 3D magnetic resonance elastograPhy(3D MRE)to assess the Pancreatic stiffness in healthy volunteers.Methods:Twenty-one volunteers without Pancreatic-related diseases underwent GE 3.0T MR exams using a multi-slice EPI Pulse sequence with low-frequency vibrations(40 and 60 Hz).The mean stiffness in three Pancreatic subregions(head,body and tail)and the corresPonding liver stiffness were calculated.Results:The mean stiffness(average of values obtained in different Pancreatic subregions)was(1.11±0.16)kPa at 40 Hz,and(2.08±0.31)kPa at 60 Hz. The corresPonding liver stiffness was(1.62±0.26)kPa at 40 Hz(mean Pancreas-to-liver stiffness ratio:0.69),and(2.27±0.34)kPa at 60 Hz(mean ratio:0.92).The mean stiffness in three Pancreatic subregions have no significant differences(P>0.05).The mean CV for each Pancreatic subregion was lower at 40 Hz than 60 Hz(P<0.05 for all subregions,range:13.91%~20.91%at 40 Hz and 18.84%~21.84%at 60 Hz).Conclusion:3D MRE can Provide Pancreas stiffness measurements in healthy PeoPle,with lower variation at 40 Hz.There was no difference of stiffness among different Pancreatic subregions.
Pancreas;Magnetic resonance imaging
R322.491;R445.2
A
1008-1062(2015)09-0646-04
2015-01-14;
2015-03-31
安訸(1991-),女,辽宁开原人,在读硕士研究生。
郭启勇,中国医科大学附属盛京医院放射科,110004。

