卵巢肿瘤彩超血流指标与微血管密度及促血管生成素的相关性
王娟娟,于 冰
(山西医学科学院 山西大医院妇产科超声室,山西 太原 030032)
卵巢肿瘤彩超血流指标与微血管密度及促血管生成素的相关性
王娟娟,于冰
(山西医学科学院 山西大医院妇产科超声室,山西 太原030032)
目的:探讨卵巢肿瘤彩超血流指标阻力指数(RI)与卵巢组织中微血管密度(MVD)及促血管生成素-2(Ang-2)的相关性。方法:经手术病理证实的55例卵巢肿瘤患者,术前应用彩色多普勒超声观察卵巢肿瘤内部血流并测定RI值,术后对所切除卵巢肿瘤组织标本分别采用免疫组化法检测其组织中MVD及Ang-2表达,分析RI与MVD、Ang-2的相关性及与肿瘤性质分级之间的相关性。结果:卵巢肿瘤的良恶性与RI呈负相关(r=-0.577,P<0.05);MVD各组间呈正相关(r=0.750,P<0.01);RI与MVD呈显著负相关(r=-0.537,P<0.05);Ang-2与肿瘤分级呈显著正相关(r=0.573,P<0.05)。结论:RI、MVD及Ang-2分别从不同角度反映了卵巢肿瘤中新生血管的形成,Ang-2有望作为卵巢癌的临床诊断指标之一,三者联合应用可对术前术后卵巢肿瘤的血管形成进行综合评价,为卵巢癌的抗血管新生治疗及预后评估提供有价值信息,具有较重要的临床预测价值。
卵巢肿瘤;血管生成素2;超声检查,多普勒,彩色
卵巢肿瘤是女性生殖道常见肿瘤,其中卵巢癌死亡率最高,预后最差。恶性卵巢肿瘤的发病因素及病情进展机制复杂多样,大量研究表明,肿瘤的进行性生长代谢需要持续的血管生成,血管生成在肿瘤发病机制中的作用受到越来越多的重视[1]。微血管密度(Microvessel density,MVD)是目前评价肿瘤新生血管数量的定量指标,它不仅与肿瘤细胞的营养和供养有关,而且也反映了肿瘤的浸润和转移能力[2]。促血管生成素-2(Angiopoietin-2,Ang-2)是新近发现的与肿瘤血管生成相关的内皮生长因子,且特异表达于肿瘤边缘的血管重建区[3-4],其水平的高低与肿瘤的恶性程度密切相关。
本研究通过彩色多普勒超声血流显像(Color Doppler flow imaging,CDFI)观察肿瘤内部血管分布情况,测定血管富集区域瘤体血流阻力指数(Resistance index,RI);采用免疫组织化学方法检测卵巢肿瘤组织中Ang-2表达和MVD,结合卵巢肿瘤彩超血流指标RI与卵巢组织MVD、Ang-2表达的相关性,探讨三项参数指标与卵巢肿瘤预后的关系以及在卵巢肿瘤抗血管新生中的临床价值。
1 资料与方法
1.1研究对象
2010年3月—2011年10月在山西医科大学第二临床医学院妇产科住院手术确诊的卵巢肿瘤患者55例,术前二维超声及彩超均诊断为卵巢肿瘤。年龄17~74岁,平均49岁。所有患者均为首次就诊,术前未行干预治疗,术后经病理诊断结果为:卵巢良性肿瘤25例 (良性组),交界性肿瘤8例 (交界性组),恶性肿瘤22例(恶性组)。25例良性卵巢肿瘤中,24例为卵巢上皮来源(浆液性囊腺瘤9例,混合型囊腺瘤5例,黏液性囊腺瘤10例),另外1例为性索间质来源 (卵巢卵泡膜细胞瘤);8例交界性卵巢肿瘤均为卵巢上皮来源;22例卵巢恶性肿瘤 (卵巢颗粒细胞瘤4例,1例子宫内膜样癌,2例库肯勃格瘤,1例未成熟型畸胎瘤,14例浆液性囊腺癌)。
1.2仪器与方法
1.2.1仪器
应用GE Voluson 730彩色多普勒超声诊断仪,经腹超声探头频率3.5~5.0 MHz,经阴超声探头频率5.5~7.5 MHz。先行腹部超声检查,若肿瘤靠近后腹膜,应进一步联合经阴道超声检查。尽量对肿瘤行多切面扫查,重点观察肿瘤的大小、形态、边界是否清晰、包膜是否完整、内部回声,是否伴有分隔、分隔厚度,瘤体内部是否伴有乳头样回声、乳头大小等,尤其对肿瘤内部高度怀疑病变区域应做重点扫查。清晰显示二维声像图后进入彩色多普勒血流显像模式,重点观察肿瘤周边、内部分隔、内部乳头,以及内部高度怀疑病变区域血流分布情况,在获取稳定血流频谱图像的基础上,测量其RI值,图像应至少存在3个连续稳定的心动周期,每例患者应尽量多部位取样测量RI值,取最低RI值。
1.2.2免疫组织化学
采用免疫组织化学方法对肿瘤组织中MVD及Ang-2的表达情况进行检测。浓缩型鼠抗人CD34单克隆抗体(ZM-0046,0.1 mL),购自北京中杉金桥生物技术有限公司。浓缩型兔抗人Ang-2多克隆抗体(BA1530,0.1 mL),购自武汉博士德生物工程有限公司。免疫组织化学方法按照试剂盒说明进行相关操作。
1.3结果判断
1.3.1肿瘤内血管分型
分为3型[5]:①Ⅰ型:肿瘤内部、周边未见血流信号;②Ⅱ型:肿瘤周边及/或隔上可见点状、短线状血流信号;③Ⅲ型:肿瘤周边及内部实质区可见点状、短线状、条状或树枝状血流信号。
1.3.2MVD计数
参照Weidner计数法[6],先在低倍镜(×100倍)下选取微血管密度最大的视野,然后将光镜倍数增大至200倍,分别计数5个独立视野中被CD34标记且血管内皮细胞被染成棕黄色的微血管条数,求其平均值得出MVD,结果用±s表示。微血管的判断标准为:独立存在的与邻近血管游离的单个内皮细胞,或独立存在的内皮细胞簇可作为微血管的一个计数单位,血管腔过大即直径大于8个红细胞之和,或者带有明显肌层的血管均不在计数范围内。
1.3.3Ang-2表达
细胞浆有棕黄或棕褐色颗粒沉着的细胞计数为Ang-2阳性细胞,根据染色的程度及染色细胞的百分率进行评分(图1,2):按细胞染色强度分0~3分:0分为无染色,1分为淡黄色者,2分为棕黄色者,3分为棕褐色者;按着色细胞比例也分为0~3分:0分为着色细胞比例≤5%,1分为>5%~25%,2分为>25%~50%,3分为>50%。将每张切片着色强度得分与着色细胞比例得分相乘,结果为判定标准:0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中等阳性(++),6分以上为强阳性(+++)。
1.4统计学分析
采用SPSS 13.0统计分析软件包对数据进行统计学处理,计量资料统计结果用±s表示,多样本计量资料采用F检验,计数资料采用χ2检验,相关性分析使用Pearson等级相关分析,P<0.05为差异有统计学意义。
2 结果
2.1卵巢肿瘤彩超血流分布情况
Ⅰ型7例,术后病理证实均为良性肿瘤;Ⅱ型28例,术后病理证实为卵巢良性肿瘤18例,交界性肿瘤8例,恶性肿瘤者2例;Ⅲ型20例,术后病理证实均为恶性肿瘤,见图1~3。
2.2卵巢肿瘤各组间参数指标比较
见表1。
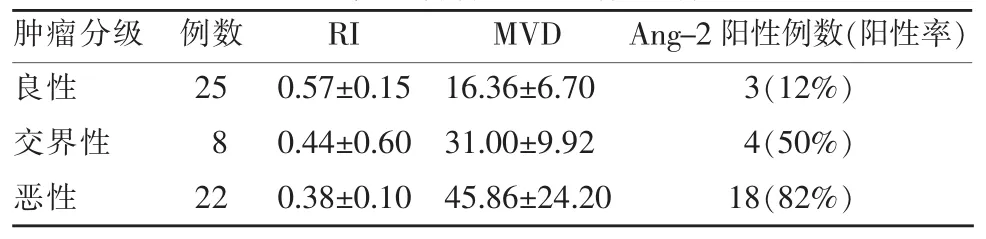
表1 卵巢肿瘤各组间参数指标比较
卵巢肿瘤彩超血流参数指标RI三组之间差异具有统计学意义(P<0.05)。恶性组(0.38±0.10)低于良性肿瘤组(0.57±0.15);交界性肿瘤组(0.44±0.06)低于良性肿瘤组,差异具有统计学意义(P<0.05),但卵巢恶性肿瘤组与卵巢交界性肿瘤组相比无显著性差异(P=0.235)。卵巢肿瘤的良恶性与RI呈负相关(r=-0.577),即RI值越低,恶性的可能性越大。
卵巢肿瘤MVD三组之间差异具有统计学意义(P<0.01)。恶性组 (45.86±24.20)显著高于良性组(16.36±6.70)和交界性组 (31.00±9.92)(P<0.05)。MVD各组间呈正相关(r=0.750),即随着肿瘤分级提高,MVD值增加。
卵巢肿瘤Ang-2阳性表达率三组比较差异有显著性(P<0.05)。卵巢恶性肿瘤组Ang-2阳性表达率(82%)显著高于良性组(12%)与交界性组(50%),且三组之间差异有明显统计学意义(P<0.05)。Ang-2表达各组间呈明显正相关(r=0.573,P<0.05)。
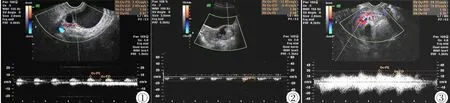
图1 卵巢良性肿瘤(黏液性囊腺瘤)。囊性伴分隔,内透声欠佳,周边仅见散在血流(Ⅱ型),RI=0.61。 图2 卵巢交界性黏液性乳头状囊腺瘤。囊壁见不规则实性区,内较丰富血流(Ⅱ型),RI=0.50。 图3 卵巢恶性肿瘤(浆液性囊腺癌)。实性为主,内丰富血流(Ⅲ型),RI= 0.35。Figure 1.Ovarian benign tumor(mucinous cystadenoma).Cystic with separate,only scattered blood flow signal(typeⅡ),RI=0.61. Figure 2.Borderline mucinous ovarian papillary cystadenoma rich blood flow signal in the irregular solid areas(typeⅡ),RI=0.50.Figure 3.Ovarian malignant tumor(serous cystadenocarcinoma).Mainly solid and rich blood flow signal in the solid area(typeⅢ),RI=0.35.
2.3卵巢肿瘤彩超血流参数指标RI与MVD的相
关性比较
RI与MVD呈负相关(r=-0.537,P<0.01),即随着MVD的增加,RI值降低,见表2。
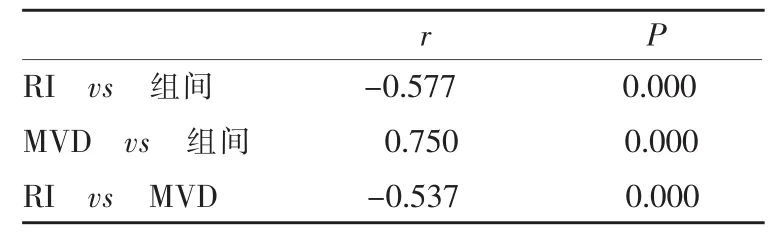
表2 卵巢肿瘤彩超血流参数指标RI与MVD的相关性比较
3 讨论
Folkman[6]提出“肿瘤血管形成”学说,肿瘤新生的滋养血管生成先于肿瘤细胞群增生。从组织学讲,新生血管不成熟,血管壁缺乏平滑肌,血管壁弹性欠佳,此外大量血管吻合导致动静脉瘘形成,使血流阻力降低。新生血管是肿瘤本身的滋养血管,数目越多,肿瘤生长越快[7]。本研究通过CDFI术前对卵巢肿瘤患者进行检测,其中7例肿瘤周边及内部均未测及明显血流信号,术后病理证实均为良性肿瘤,提示可能由于肿瘤内部形成的新生血管较少,其余肿瘤周边或内部均可见散在或者较丰富血流信号分布,并可测及动脉性血流频谱,术后病理证实为卵巢恶性肿瘤者术前RI值多低于0.4,本研究结论与Kurjak等[8]报道相似,而交界性肿瘤的RI值与与恶性肿瘤RI值存在明显交叉,差异无统计学意义(P= 0.235)。可能由于本研究数量有限所造成,应进一步行大样本研究。彩色多普勒超声测量RI值可间接反映肿瘤的良恶性,为临床预后判断提供理论依据。
近年研究表明,肿瘤的生物行为(如生长、浸润、转移等)均依赖于新生血管[9]。新生血管主要是由其上级宿主血管通过芽生方式转化而来,进而经不断生长演进,一般先沿肿瘤周边生长,包绕瘤体,而后蔓延深入瘤体内部生长,共同供应肿瘤生长代谢所需,促进肿瘤迅速生长。因而,肿瘤新生血管的形成所导致的瘤体血供增加是肿瘤侵袭或者恶性变的标志[10]。
目前MVD被认为是反映肿瘤血管生成的金标准。本研究结果显示卵巢恶性肿瘤组中MVD的表达明显高于卵巢良性肿瘤及交界性肿瘤组,与Orre等[11]报道相一致。各组之间两两比较,良性组与交界性组比较(P<0.03),良性组与恶性组比较(P<0.00),交界性组与恶性组比较(P<0.03),三组之间差异均有统计学意义(P<0.00),且随着肿瘤分级提高,MVD值增加。提示MVD参与了肿瘤的演变过程,而MVD增加更加速了肿瘤的演进。究其原因可能是:肿瘤内部新生血管的不成熟性,导致其生长的随意性,另外管壁结构不牢固,可导致肿瘤细胞扩散转移;其次肿瘤内新的血管形成为肿瘤提供了充分的营养支持,营养成分越充足,新生血管形成越多,肿瘤生长越快。
本研究对RI与MVD的相关性研究中发现,RI各组间呈负相关(r=-0.577),即随着肿瘤分级提高,RI值降低;MVD各组间呈正相关(r=0.750),即随着肿瘤分级提高,MVD值增高,RI与MVD相关性分析两者间存在显著负相关(r=-0.537,P=0.000),提示卵巢肿瘤血流越丰富,RI越低,肿瘤生长越快,其形成新生血管越丰富。这两个指标均从不同角度反映着肿瘤内部血管的丰富程度,与其他学者研究结果一致。
国内外诸多研究报道Ang-2在良恶性肿瘤的表达存在差异,恶性肿瘤显著高于良性肿瘤,血管形成可能是卵巢良、恶性肿瘤鉴别及肿瘤侵袭转移的一个标志。新生血管增多反映了卵巢肿瘤的生长与浸润,具有更高的转移和恶化进展趋势。本研究发现卵巢肿瘤中Ang-2的表达主要位于肿瘤基质细胞和血管内皮细胞的胞浆中,恶性肿瘤中阳性表达率为82%,明显高于良性组(12%)与交界性组(50%),三组之间差异有明显统计学意义,且与分级之间存在明显正相关,提示Ang-2促进卵巢肿瘤中新生血管的形成,并与肿瘤的发生发展有着密切关系。
综上所述,卵巢肿瘤彩超血流指标RI可间接反映卵巢肿瘤的良恶性,多用于术前检测肿瘤内部及周边血流动力学情况,结合声像图形态学特征来综合判断肿瘤的良恶性以及预后情况,可为术前评估肿瘤良恶性提供帮助;MVD、Ang-2可用于术后对肿瘤组织进行评估,Ang-2有望作为卵巢癌的临床诊断指标之一。RI、MVD及Ang-2分别从不同角度反映了卵巢肿瘤中新生血管的形成,三者联合应用可对术前术后卵巢肿瘤的血管形成进行综合评价,为卵巢癌的抗血管新生治疗及预后评估提供有价值信息,具有较重要的临床预测价值。
[1]Tang HS,Feng YJ,Yao LQ.Angiogenesis,vasculogenesis and vasculogenic mimicry in ovarian cancer[J].Int J Gynecol Cancer,2009,19(4):605-610.
[2]Dvork HF,Nagy JA,Dvork JT,et al.Identification and characterization of the blood vessels of solid tumors that are leaky to circulating macromolecules[J].Am J Pathol,1988,133(1):95-109.
[3]Taylor AP,Osorio L,Craing R,et al.Tumor-specific regulation of angiongenic growth factors and their receptors during recovery from cytotoxic therapy[J].Clin Cancer Res,2002,8(4):1213-1222.
[4]Zhang L,Yang N,Park JW,et al.Tumor-derived vascular endothelial growth factor up regulates angiopoietin-2 in host endothelium and destabilizes host vasculature,supporting angiogenesis in ovarian cancer[J].Cancer Res,2003,63(12):3403-3412.
[5]唐丽娜,任永富,阎若元,等.经阴道超声诊断卵巢肿瘤的价值[J].临床超声医学杂志,2007,9(1):34-37.
[6]Folkman J.What is the evidence that tumors are anogenesis dependent?[J].J Natl Cancer Inst,1990,82(1):4-6.
[7]郑红雨,沈桂新,康利克,等.卵巢肿瘤三维能量多普勒血管指数与病理微血管密度的相关性研究 [J].中国临床新医学,2012,5(2):98-101.
[8]Kurjak A,Kupesic S,Shalan H,et al.Uterine sarcoma:a report of 10 cases studied by transvaginal color and pulsed Doppler sonography[J].Gynecol Oncol,1995,59(3):342-346.
[9]张蕾.彩色多普勒超声对卵巢肿瘤的诊断价值[J].中国肿瘤临床,2012,39(2):110-113.
[10]Orre M,Rogers PA.Macrophages and microvessel density in tumors of the ovary[J].Gynecol Oncol,1999,73(l):47-50.
Correlation between intratumoral flow assessed by color Doppler and microvascular density, together with expression of Ang-2 in ovarian tumor
WANG Juan-juan,YU Bing
(Department of Obstetrics and Gynecology,Shanxi Academy of Medical Sciences,Shanxi Dayi Hospital,Taiyuan 030032,China)
Objective:To evaluate the correlation between intratumoral blood flow index of resistance index(RI),assessed by color Doppler and microvascular density(MVD),together with expression of angiopoietin-2(Ang-2)in ovarian tumor.Methods:For 55 patients with ovarian tumor proved by pathologic histology examination,CDFI was performed preoperatively to detect the arterial blood flow signals,and the lowest RI values were recorded.MVD and the expression of Ang-2 were examined by immunohistochemical assay.Results:There was a significant negative correlation with RI for benign and malignant ovarian tumors(r=-0.577,P<0.05).With the increase of tumor grade,MVD showed a significantly positive correlation(r=0.750,P<0.01).There was a negative correlation between RI value and MVD(r=-0.537,P<0.05).Ang-2 and tumor grade were significantly positively correlated(r=0.573,P<0.05).Conclusions:Ang-2 is expected to be one of the indicators of clinical diagnosis of ovarian cancer.Combined application of RI,MVD and Ang-2 can comprehensively evaluate the angiogenesis of ovarian tumors before and after operation,which could be helpful in forecasting prognosis and therapy of ovarian cancer.
Ovarian neoplasms;Angiopoietin-2;Ultrasonography,Doppler,color
R737.31;R445.1
A
1008-1062(2015)10-0728-04
2015-03-30;
2015-04-23
王娟娟(1984-),女,山西运城人,硕士研究生。现工作单位为山西医科大学第二临床医学院妇产科超声室。
于冰,山西医学科学院 山西大医院妇产科超声室,030032。
山西省太原市科技项目(12016906)。

