染料探针分子对水中铜离子的可视化识别及试纸化应用
杨洪宝,杜健军,邹立,朱浩,姜娜,彭孝军
染料探针分子对水中铜离子的可视化识别及试纸化应用
杨洪宝,杜健军,邹立,朱浩,姜娜,彭孝军
(大连理工大学精细化工国家重点实验室,辽宁大连 116024)
设计合成了以罗丹明为母体的探针分子RCu,可实现对Cu2+的选择性识别。在HEPES缓冲溶液(2×10-5mol·L-1, pH7.4)的测试体系中RCu本身无颜色,加入Cu2+后溶液变为粉红色,而且加入其他常见金属阳离子无颜色变化。探针分子可识别较低浓度的Cu2+,检出限可达6.37×10-8mol·L-1。同时探针分子可用于试纸化检测,对水样中的Cu2+可实现低浓度的检测,具有一定的实用价值。
染料;探针;成像;分子工程;化学分析;有机化合物;合成;生物医学工程;产品工程
引 言
在人体中,铜是除铁和锌之外含量最丰富的过渡金属元素[1],在许多生理过程中都扮演着至关重要的角色。然而,当体内铜元素含量过高时,它会扰乱细胞的稳态,进而导致神经退行性疾病的发生,例如阿尔茨海默病、门克斯病、威尔逊病等[2-4]。随着工农业发展中对Cu2+的使用,环境中的铜污染依然是人们面临的巨大挑战[5]。世界卫生组织(WHO)规定饮用水中Cu2+的最大允许水平为2 mg·L-1[6],美国环保局(EPA)规定饮用水中Cu2+的最大允许水平为1.3 mg·L-1[7]。因此,发展一种能够实时监测环境中Cu2+水平的高灵敏度、高特异性的检测方法具有极大的意义[8]。
许多针对Cu2+的检测技术已经开发,如原子吸收光谱法、紫外-可见吸收光谱法、电化学分析法、电感耦合等离子质谱法(ICP-MS)等[9],但是这些方法都存在着不同程度的操作繁琐、设备昂贵、灵敏度差等缺点,而基于染料分子探针的分析方法因具有花费少、易操作、灵敏度和特异性高等优点得到了科学工作者们的广泛关注[10-12]。比色法检测因具有识别前后体系颜色发生明显变化的突出特点,可实现对目标物的裸眼识别,因此具有更强的实用性[13]。
基于特异性检测Cu2+的探针分子已有诸多报道[14-18],但是可将其应用于试纸中实现裸眼检测水中Cu2+的探针较少。本研究基于罗丹明母体设计合成了一例吡嗪功能化的探针分子RCu,利用Cu2+可以与含有N、O、S、P的配体络合的性质[19-20],探针分子可以实现对Cu2+的特异性识别。同时 RCu可应用于试纸,对水中Cu2+实现低浓度的裸眼检测。
1 实验部分
1.1 仪器与试剂
Varian INOVA 400 (400 MHz)核磁共振仪(美国Varian公司,TMS作为内标);HP1100LC/MSD质谱仪(美国HP公司);HP-8453型紫外-可见分光光度计(美国HP公司);RF5000型荧光分光光度计(日本岛津公司);PHS-3C型精密pH计(上海雷磁仪器厂)。
实验合成用原料未加特殊说明均为市场售分析纯,化学纯试剂,柱色谱的填料为硅胶或中性氧化铝。
1.2 中间体及染料的合成
中间体A的合成:称取2.4 g(5 mmol)罗丹明B于100 ml圆底烧瓶中,加入40 ml无水乙醇,在室温且剧烈搅拌情况下滴加6 ml 80%水合肼,滴加完毕后回流2.5 h。加入50 ml 2 mol·L-1盐酸搅拌,再加入70 ml 2 mol·L-1氢氧化钠溶液,调节溶液的pH在9~10之间,得到大量的淡粉色沉淀。布氏漏斗减压抽滤,用15 ml去离子水洗涤滤饼,如此3次。放入真空干燥箱干燥,用色谱柱分离,得到中间体A(1.26g,收率55%)。
探针分子RCu的合成:将0.92 g(2.0 mmol)中间体A加到100 ml单口圆底烧瓶中,再加入30 ml无水乙醇和0.45 g(4.0 mmol) 2-乙酰基吡嗪,在氮气保护下室温搅拌4 h,用减压蒸馏装置蒸去溶剂无水乙醇,最后重结晶得到纯的分子探针产品RCu(0.41 g,收率37%)。
合成路线如图1所示。
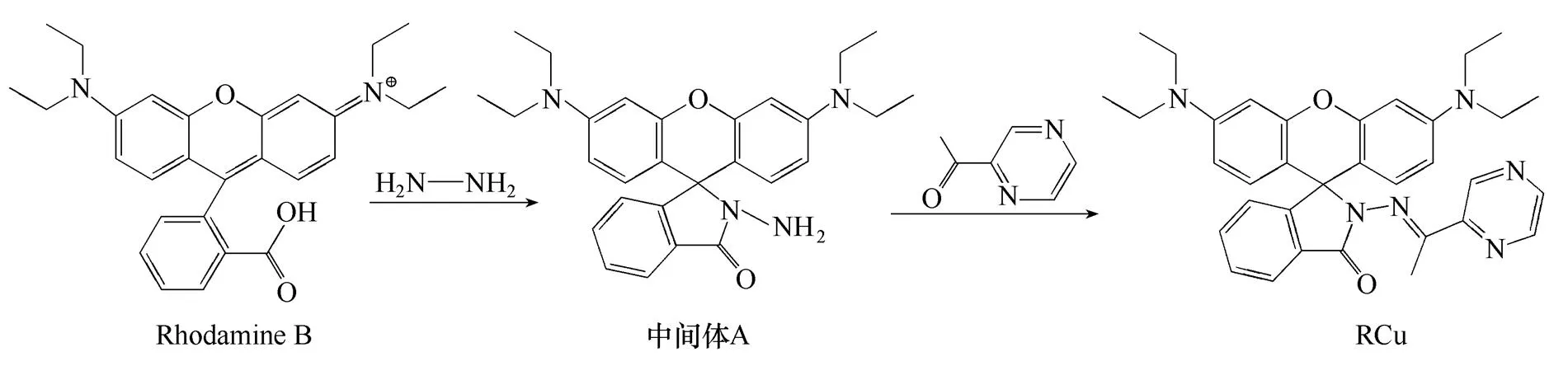
图1 探针分子RCu合成路线
RCu的1H NMR(400 MHz,CDCl3):9.03(s,1H),8.57~8.39(m,2H),8.05~7.90(m,1H), 7.67~7.41(m,2H),7.23(dt,4.0、2.9 Hz,1H),6.61(d,8.6 Hz,2H),6.40(s,2H),6.31(d,8.4 Hz,2H),3.35(q,6.9 Hz,8H),2.38(s,3H),1.53~0.60(m,12H);13C NMR(100 MHz,CDCl3):167.11,160.65,153.60,151.75,150.58,148.73,144.36,142.68,142.09,132.74,130.51,128.36,128.18,124.17,123.25,107.78,106.43,97.78,67.30,44.32,17.18,12.65;HR-MS: [M+Na]+583.2797,found 583.2787。
1.3 实验方法
用DMSO配制浓度为1.0×10-3mol·L-1的探针分子RCu母液,用去离子水配制相同浓度的各种阳离子溶液。测试体系选定为HEPES缓冲溶液 (2×10-5mol·L-1, pH7.4)。用微量进样器移取25 μl探针母液于2.5 ml测试体系中,得到探针分子浓度为1.0×10-5mol·L-1的测试溶液,进而测定探针的基本光谱数据。对于饱和滴定实验,保证加入的阳离子溶液总体积不超过测试溶液体积的3%。对于最低检出限的测定,在乙腈的测试体系中配制浓度为5.0×10-6mol·L-1的探针分子溶液,测定加入不同浓度Cu2+后的吸收光谱变化。
2 结果与讨论
2.1 探针分子RCu对Cu2+的选择性识别
配制Ag+、Ba2+、Co2+、Cr3+、Fe3+、Hg2+、Mn2+、Ni2+和Zn2+等常见金属离子的水溶液,选定测试体系为HEPES缓冲溶液(2×10-5mol·L-1,pH7.4),在探针分子RCu浓度为10 μmol·L-1的情况下分别加入50 μmol·L-1的上述离子与20 μmol·L-1的Cu2+,测定其紫外-可见吸收光谱,考察探针分子对Cu2+的选择性。
当探针处于闭环状态时,在可见光区无明显的吸收峰。加入Cu2+后,Cu2+与探针分子的络合作用导致分子内部螺环打开,使得探针溶液从无色变成粉红色,在560 nm处产生一个新的吸收峰,而加入其他离子的测试体系无明显的颜色和光谱变化(图2),表明探针分子可以选择性识别Cu2+,而对其他常见金属阳离子无响应。
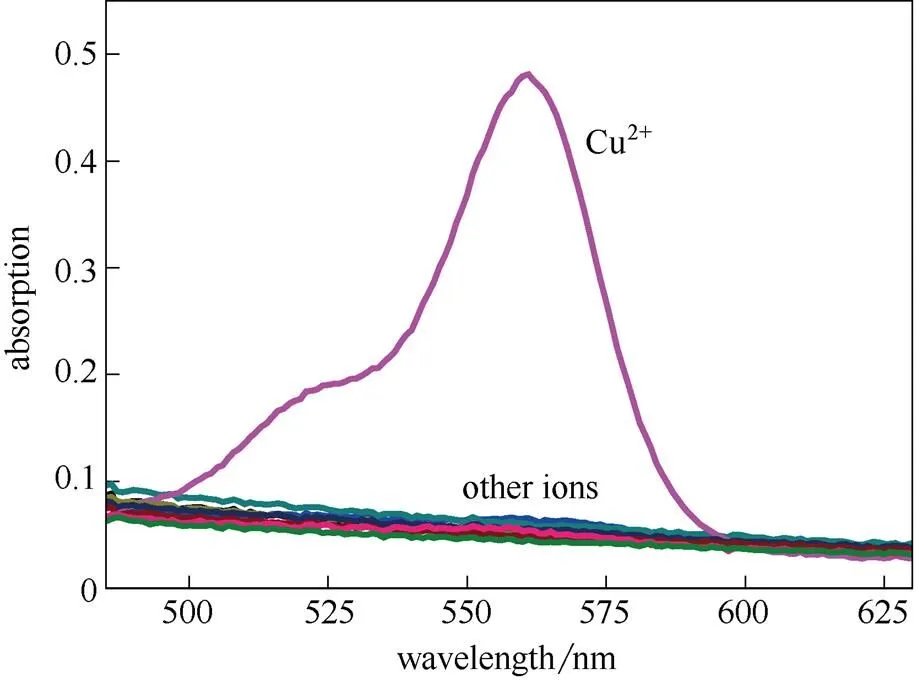
图2 探针分子RCu浓度为10 μmol·L-1时,分别加入Cu2+(20 μmol·L-1)及Ag+、Ba2+、Co2+、Cr3+、Fe3+、Hg2+、Mn2+、Ni2+、Zn2+(50 μmol·L-1),达到平衡后的吸收光谱
2.2 探针分子RCu对Cu2+的检测
在HEPES缓冲溶液(2×10-5mol·L-1,pH7.4)的测试体系下加入不同浓度的铜离子,探针分子RCu(10 µmol·L-1)的吸收光谱发生明显变化。从图3可以看出,在加入铜离子之前探针分子RCu无吸收,随着Cu2+的加入在560 nm处出现吸收,并且随Cu2+浓度增加吸收逐渐增强直到饱和。同时加入Cu2+之前测试体系的颜色为无色,在加入1 µmol·L-1Cu2+之后肉眼可以明显观察到溶液的颜色从无色变成浅红色,而且随Cu2+浓度增加溶液颜色逐渐加深。
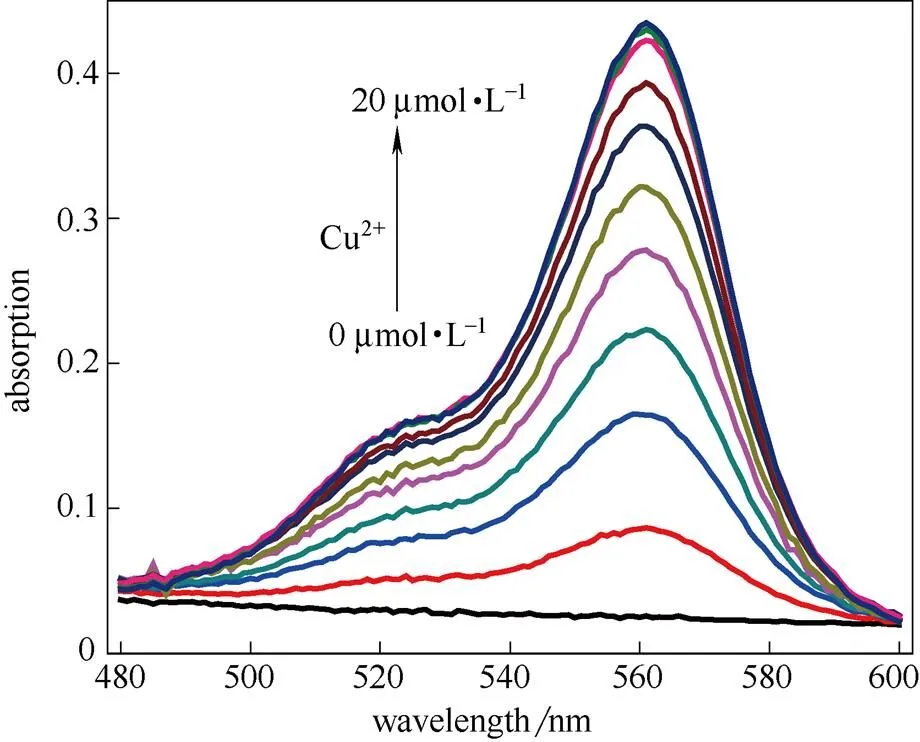
图3 当探针分子RCu的浓度为10 μmol·L-1时逐渐加入0~2倍当量Cu2+的吸收光谱
2.3 pH值对探针分子RCu光谱的影响
在HEPES缓冲溶液(2×10-5mol·L-1,pH7.4)的测试体系下用盐酸(1 mol·L-1)和NaOH溶液(1 mol·L-1)调节测试体系的pH,得到探针分子RCu的pH滴定曲线。通过Sigmoidal拟合得到探针分子RCu的pa为3.90。从图4可以看出,在pH为5.0~13.0的范围内探针分子RCu的吸收不受pH变化的影响,此时探针分子RCu螺环是闭环的状态,当pH小于5.0时开环,吸收发生明显变化。这说明探针RCu能在较宽的pH范围对Cu2+进行检测。
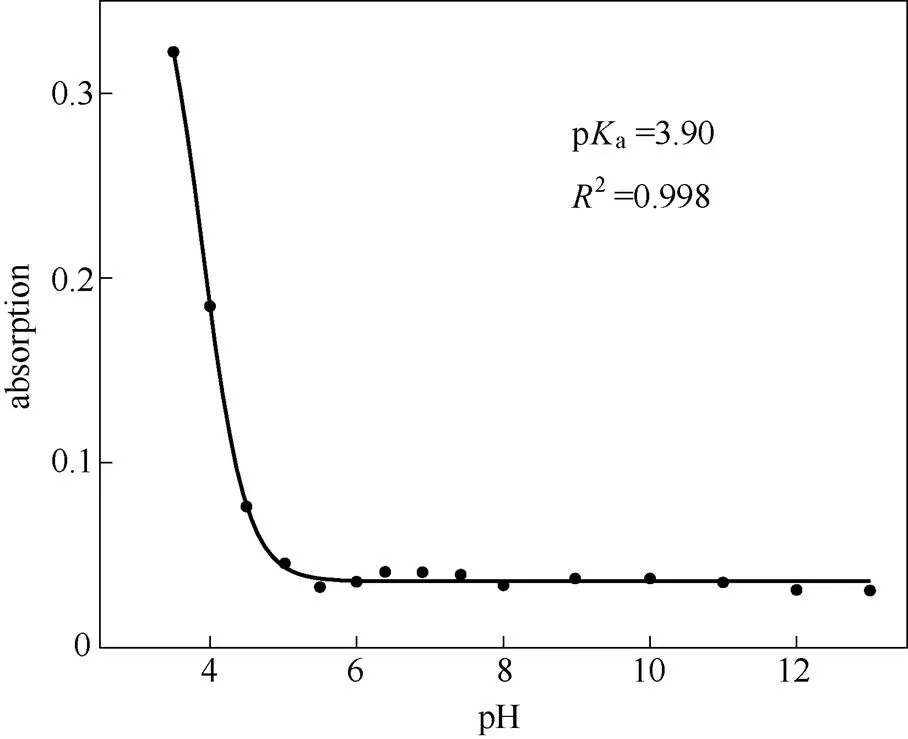
图4 探针RCu(10 μmol·L-1)在560 nm处的吸收强度随pH的变化
2.4 探针分子RCu对Cu2+响应的时间函数
在测试体系为HEPES缓冲溶液(2×10-5mol·L-1,pH7.4)的情况下,探针分子RCu的浓度为10 µmol·L-1,加入2倍当量的Cu2+,测试其吸收随时间的变化。从图5可以看出,起初560 nm处吸收值随时间增加而增强,在6 min以后吸收强度保持不变。这说明在测试体系为HEPES缓冲溶液(2×10-5mol·L-1,pH7.4)的情况下探针分子RCu对Cu2+有较快的响应速度。
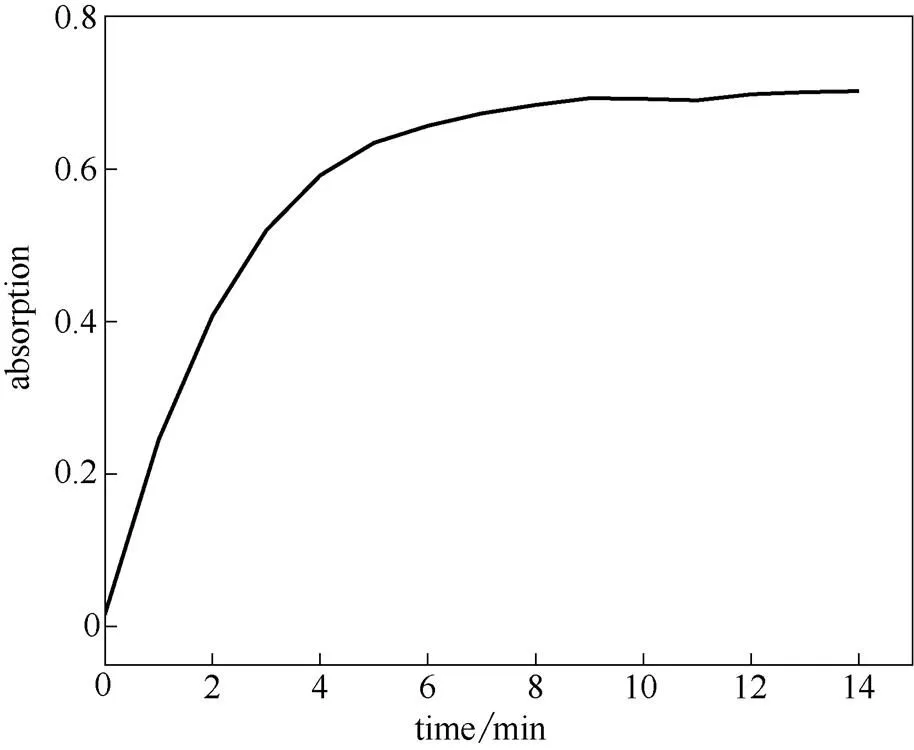
图5 探针RCu(10 μmol·L-1)加入铜离子(20 μmol·L-1)之后560 nm处吸收强度随时间的变化
2.5 探针分子RCu检测Cu2+时与其他离子的竞争性实验
选择常见的金属阳离子Ag+、Ba2+、Co2+、Cr3+、Fe3+、Hg2+、Mn2+、Ni2+、Zn2+作为干扰性离子。测试体系为HEPES缓冲溶液(2×10-5mol·L-1,pH7.4),在测试体系中分别加入50 μmol·L-1上述离子,再加入20 μmol·L-1Cu2+形成金属离子竞争体系,最后加入10 μmol·L-1探针分子RCu,在响应达到平衡后记录相应的吸收变化。从图6可以看出,在与其他阳离子共同存在的情况下探针分子对Cu2+的识别过程不受影响,对常见的阳离子具有较好的抗干扰能力。
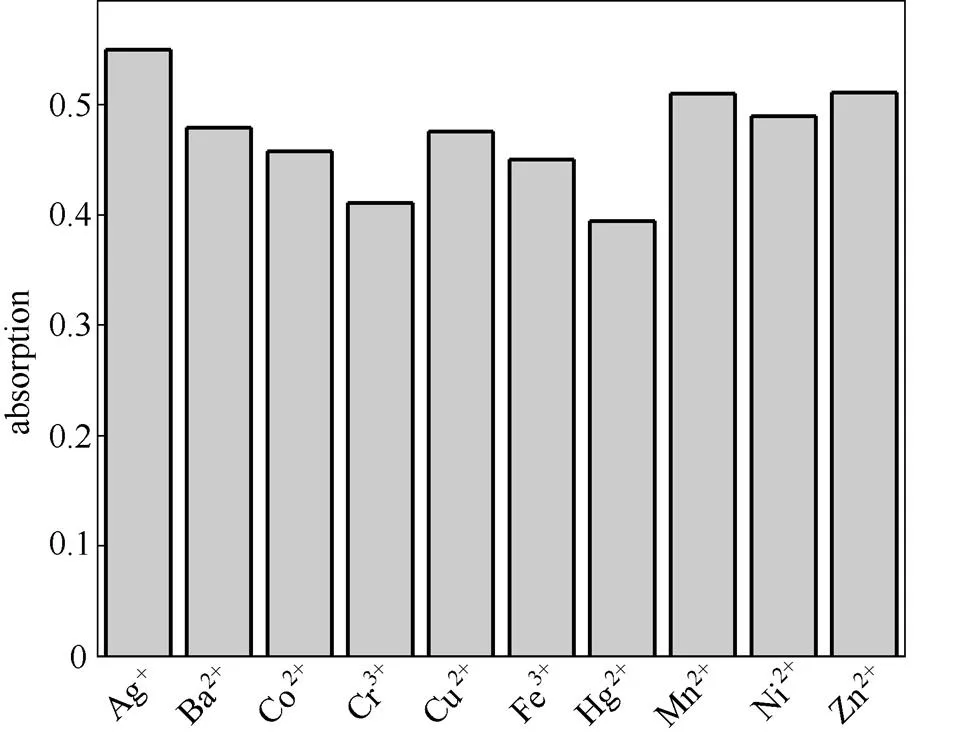
图6 探针RCu浓度为10 μmol·L-1时,Cu2+(20 μmol·L-1)及其他金属离子(50 μmol·L-1)共同存在时λ560 nm处的吸收强度
2.6 探针分子对Cu2+最低检出限的测量和计算
在低浓度范围内进行Cu2+的滴定实验。在纯乙腈测试体系中,探针分子RCu的浓度为5 µmol·L-1,然后逐步增加Cu2+的浓度(0,1,2,3,4,5 µmol·L-1),测定其相应吸收光谱的变化。结果如图7所示,在Cu2+浓度0~5 µmol·L-1范围内探针分子RCu在560 nm处的吸收强度与Cu2+浓度有非常好的线性关系。通过测试的3个空白样吸收强度计算得标准偏差0.0021,拟合线性关系斜率0.0988,进一步根据公式计算得到RCu对铜离子检测限为6.37×10-8mol·L-1。
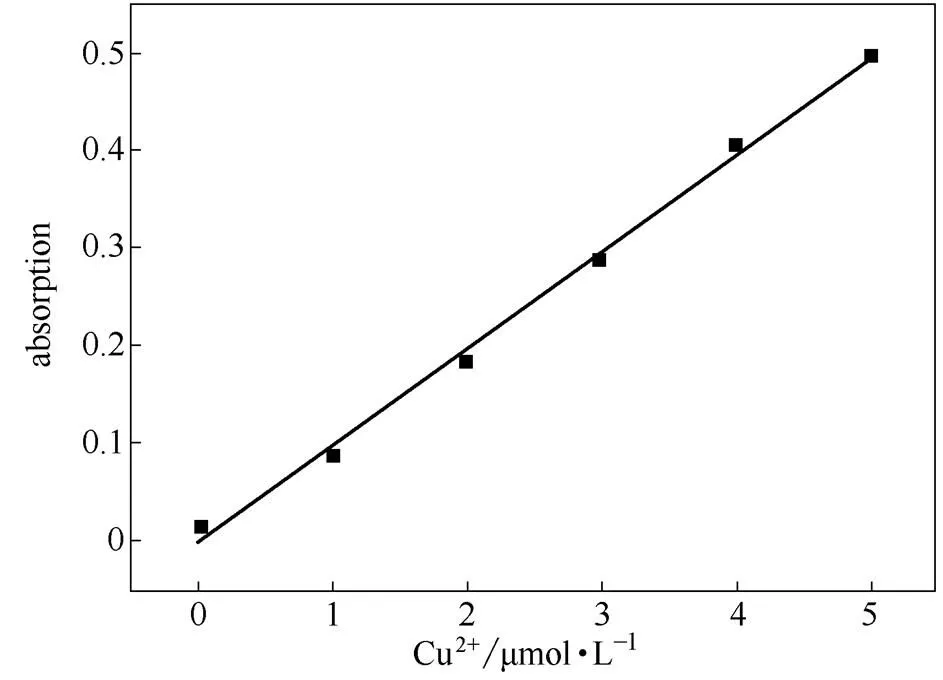
图7 探针RCu浓度为10 μmol·L-1时对Cu2+最低检测限
2.7 探针分子对Cu2+识别机理的研究
利用Job’s plot实验确定RCu与Cu2+络合配比,然后通过RCu对Cu2+络合后进一步验证,最后用EDTA确定反应的可逆性。将探针分子RCu与Cu2+按浓度比1:9、2:8、3:7、4:6、5:5、6:4、7:3、8:2、9:1的比例加到HEPES缓冲溶液中,测定它们在560 nm处的吸收值,得到Job’s plot曲线图。从图8可以看出,探针分子RCu与Cu2+离子的络合比为1:1。
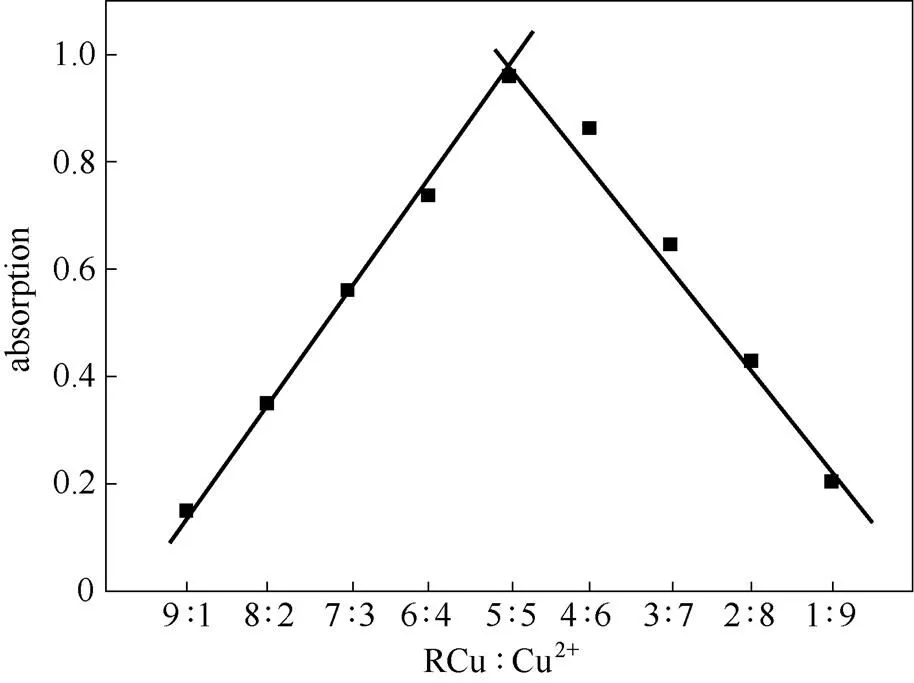
图8 探针分子RCu的Job’ s plot图
随后移取一定量的探针母液,再加入等当量的CuCl2·2H2O溶液,做质谱检测。从络合后的质谱(图9)中可以发现相对分子质量658.74的峰归属应该是C34H36N6O2ClCu+,从而也可以知道探针分子RCu只络合了一个Cu2+,即RCu与Cu2+络合比为1:1。
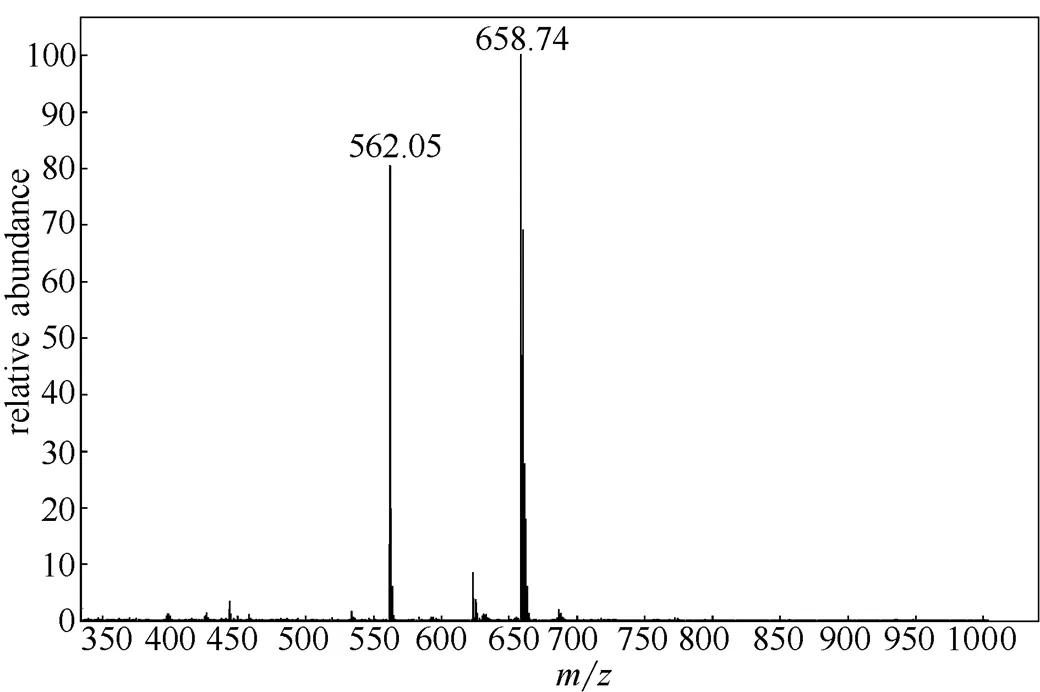
图9 探针分子RCu与Cu2+络合后的质谱图
研究了探针分子RCu与Cu2+结合的可逆性。在测试体系中加入等当量探针分子RCu与Cu2+,溶液的颜色由无色变为粉紫色,达到平衡后测试溶液吸收强度。随后加入等量的EDTA,使溶液的颜色从淡粉色变为无色,说明探针RCu和Cu2+之间是存在配位关系的。Cu2+的加入使罗丹明的内酯环打开,溶液颜色发生改变,而加入等量EDTA后Cu2+与EDTA络合,将Cu2+从探针分子体系中消除,使得探针分子重新闭环,溶液颜色消失。测量加入EDTA且达到平衡后溶液的吸收强度,重复几次,发现这种变化依然是存在的,由此说明探针分子RCu对Cu2+离子的识别过程是可逆的,如图10所示。

图10 在加入探针RCu的测试体系中反复加入等当量的Cu2+与EDTA,测试560 nm处的吸收变化
从上述的Job’s plot实验、络合后的质谱图以及探针分子RCu与Cu2+络合滴定实验可以得知探针分子RCu与Cu2+的结合方式是1:1进行络合的,而且络合是可逆的,由此推测探针分子RCu与Cu2+可能的识别机理,如图11所示。此外,在结合Cu2+后罗丹明会开环,从而发出荧光。但是在检测过程中并没有观察到荧光的变化,推测可能是铜离子的存在导致了荧光的猝灭。
纳入标准[6]:按Denis分型[7]均为爆裂性骨折,上终板损伤型;椎管占位率>30%,椎体前缘高度丢失>30%;受伤至手术时间≤2周;骨折合并脊髓神经损伤。排除标准:胸腰椎多段骨折;需行椎板减压;合并病理性骨折者或严重骨质疏松症。2014年5月—2016年1月,按以上标准共纳入患者73例,其中前期35例采用椎弓根钉内固定系统进行治疗(A组),后期38例采用经伤椎椎弓根植骨联合椎弓根钉内固定系统治疗(B组)。2组患者的性别、年龄、受伤至手术时间、骨折位置以及术前美国脊髓损伤协会(AISA)分级[8]等一般资料相比,差异均无统计学意义(P > 0.05,表1),具有可比性。
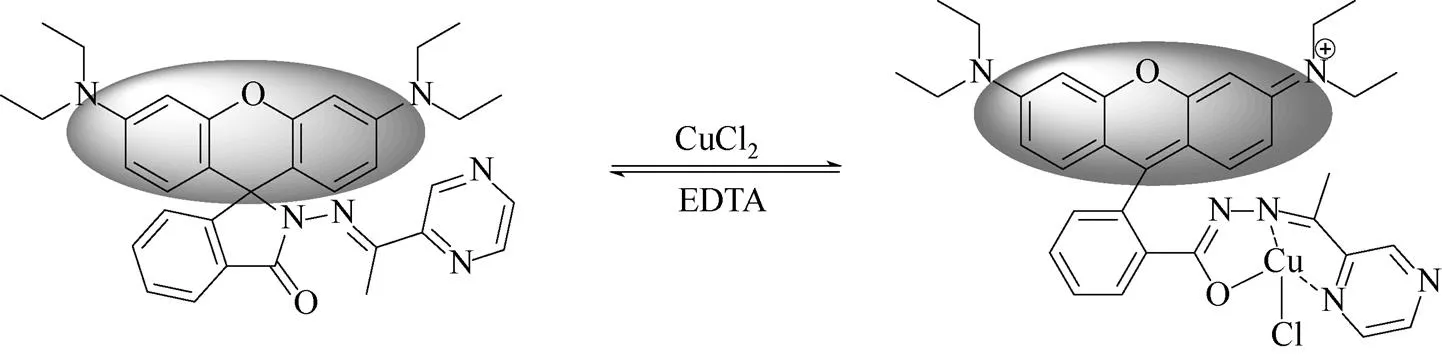
图11 探针分子RCu与Cu2+可能的识别机理
2.8 探针分子RCu的试纸化应用
将定性试纸裁剪为0.5 cm×2.5 cm(宽×高)的长方形小片,将其放入1 mmol·L-1探针分子的母液中,浸泡1 min后取出。将RCu试纸分别用于检测不同浓度的铜离子。从图12可以看出,当纯水溶液中铜离子的浓度达到1 mg·L-1时,就可以看到试纸的颜色由无色变成了淡紫色,而且随铜离子浓度增加试纸的颜色逐渐变深。因此,合成的探针分子RCu是可以用于方便快速检测环境中的铜离子的,而且能实现浓度在1 mg·L-1时的识别,说明该探针具有潜在的应用价值。
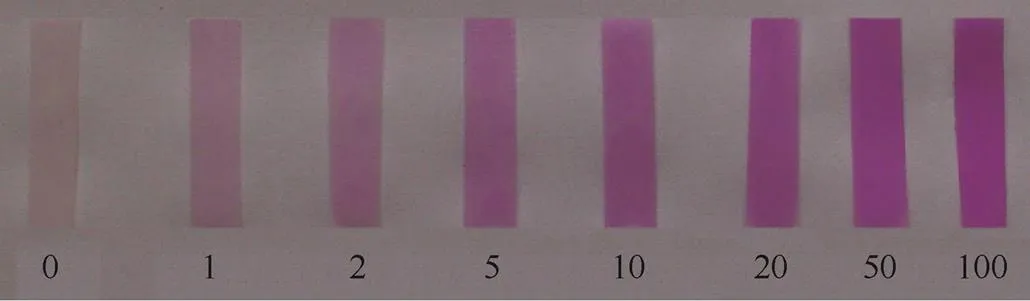
图12 探针分子RCu负载到定性滤纸上检测水环境中的铜离子
3 结 论
(1)设计合成了一例基于罗丹明母体的对Cu2+具有高灵敏度且特异性识别的探针分子RCu。
(2)在含有探针分子的测试体系中加入Cu2+,溶液由无色变为红色,可实现对Cu2+的裸眼可视化检测。
(3)探针分子的pa值较低,可在较宽的pH范围内进行检测。
(4)探针分子可负载于试纸,对Cu2+实现10-6(ppm)级检测,具有潜在的应用价值。
Reference
[1] Gaggelli E, Kozlowski H, Valensin D, Valensin G. Copper homeostasis and neurodegenerative disorders (Alzheimer’s, prion, and Parkinson’s diseases and amyotrophic lateral sclerosis) [J]., 2006, 106 (6): 1995-2044
[2] Barnham K J, Masters C L, Bush A I. Neurodegenerative diseases and oxidative stress [J]., 2004, 3 (3): 205-214
[3] Kim Y R, Kim H J, Kim J S, Kim H. Rhodamine-based “Turn-On” fluorescent chemodosimeter for Cu (Ⅱ) on ultrathin platinum films as molecular switches [J]., 2008, 20 (23): 4428-4432
[4] Zhang P, Chen J, Huang F, Zeng Z, Hu J, Yi P, Zeng F, Wu S. One-pot fabrication of polymer nanoparticle-based chemosensors for Cu2+detection in aqueous media [J]., 2013, 4 (7): 2325
[5] Wang Sisi (王思思), Ying Xiaoguang (英晓光), Zhang Weiying (张卫英), Li Xiao (李晓). Preparation and properties of spherical chitosan hydrogel crosslinked with L-cystine for Cu2+adsorption [J].(化工学报), 2013, 64 (9): 3437-3445
[6] WHO. Guidelines for Drinking-water Quality: First Addendum to Volume 1, Recommendations [M]. World Health Organization, 2006
[7] Liu J, Lu Y. A DNAzyme catalytic beacon sensor for paramagnetic Cu2+ions in aqueous solution with high sensitivity and selectivity [J]., 2007, 129 (32): 9838-9839
[8] Zheng Zhi (郑直), Li Shan (李姗), Wang Ying (王影), Zhang Changzhuang (张昌壮), Zhang Hanqi (张寒琦), Wang Yinghua (王英华). Determination of copper and ironby ionic liquid extraction coupled with spectrophotometric detection [J].(分析化学), 2010, 38 (12): 161
[9] Tong A, Akama Y, Tanaka S. Pre-concentration of copper, cobalt and nickel with 3-methyl-1-phenyl-4-stearoyl-5-pyrazolone loaded on silica gel [J]., 1990, 115 (7): 947-949
[10] Wu Zhihao (吴志皓), Tang Yaoji (唐尧基), Li Guimin (李桂敏), Li Deliang (李德亮), Wang Jinzhong (王金中), Liu Xiuhua (刘绣华), Fan Shunli (范顺利). Applications of fluorescence analysis methods in the analysis of environmental organic pollutants [J].(分析仪器), 2005 (3): 13-19
[11] Su Fengyi (苏凤宜), Xing Xinhui (邢新会). Concentration characterization of quaternary ammonium surfactants by FITC [J].() (化工学报), 2008, 59 (10): 2589-2595
[12] Xu Chunxuan (许春萱), Huang Kejing (黄克靖), Xie Wanzhen (谢宛珍). Sensitive determination of nitrate and nitrite in food products by spectrofluorimetry with a fluorescent probe: 8-(3′,4′-diaminophenyl)- difluoroboradiaza--indacence [J].(化学学报), 2009, 67 (10): 1075-1080
[13] Niu H, Su D, Jiang X, Yang W, Yin Z, He J, Cheng J. A simple yet highly selective colorimetric sensor for cyanide anion in an aqueous environment [J]., 2008, 6 (17): 3038
[14] HeeáKim M, HyeáJang H, SuáHan M. Coumarin-derivative-based off-on catalytic chemodosimeter for Cu2+ions [J]., 2009, 41 (32): 4838-4840
[15] Li Zifan (李紫凡), Mei Ling (梅岭), Xiang Yu (向宇), Tong Aijun (童爱军). Novel colorogenic probe of rhodamine B derivative [J].(分析化学), 2008, 36 (7): 915-919
[16] Zhang D, Wang M, Chai M, Chen X, Ye Y, Zhao Y. Three highly sensitive and selective colorimetric and off-on fluorescent chemosensors for Cu2+in aqueous solution [J].:, 2012, 168: 200-206
[17] Xiang Y, Tong A, Jin P, Ju Y. New fluorescent rhodamine hydrazone chemosensor for Cu(Ⅱ) with high selectivity and sensitivity [J]., 2006, 8 (13): 2863-2866
[18] Yuan Yuehua (袁跃华), Feng Feng (冯锋), Tian Maozhong (田茂忠), Meng Shuangming (孟双明), Bai Yunfeng (白云峰). Synthesis of fluorescent probe based on rhodamine and its appalication in the determination for Cu2+[J].(高等学校化学学报), 2011, 32 (1): 62-66
[19] Schwarze T, Müller H, Dosche C, Klamroth T, Mickler W, Kelling A, Löhmannsröben H G, Saalfrank P, Holdt H J. Luminescence detection of open-shell transition-metal ions by photoinduced electron transfer controlled by internal charge transfer of a receptor [J]., 2007, 46 (10): 1671-1674
[20] Tamayo A, Escriche L, Casabó J, Covelo B, Lodeiro C. Synthesis, complexation and spectrofluorometric studies of a new NS3 anthracene-containing macrocyclic ligand [J]., 2006 (15): 2997-3004
Specific colorimetric probe for Cu(Ⅱ) in aqueous solutionand its application in indicator paper
YANG Hongbao, DU Jianjun, ZOU Li, ZHU Hao, JIANG Na, PENG Xiaojun
(State Key Laboratory of Fine Chemicals, Dalian University of Technology, Dalian 116024, Liaoning, China)
A new Rhodamine derivative RCu was designed and synthesized as a colorimetric probe for Cu(Ⅱ) with high selectivity. RCu itself has no color in HEPES buffer solution (2×10-5mol·L-1, pH7.4). With Cu2+added, the solution turns into pink color, but without change in color with other common metal cations. The probe can recognize Cu2+at low concentrations and the detection limit is 6.37×10-8mol·L-1. Meanwhile, the probe can detect Cu2+in water samples at lower concentrations by indicator paper, indicative of its great potential applications.
dye; probe; image; molecular engineering; chemical analysis; organic compound; synthesis; biomedical engineering; product engineering
2014-07-11.
Prof.PENG Xiaojun, pengxj@dlut.edu.cn
10.11949/j.issn.0438-1157.20141041
TQ 618.5
A
0438—1157(2015)02—0591—06
国家自然科学基金项目(21136002);国家重点基础研究发展计划项目(2013CB733702)。
2014-07-11收到初稿,2014-08-28收到修改稿。
联系人:彭孝军。第一作者:杨洪宝(1990—),男,硕士研究生。
supported by the National Natural Science Foundation of China (21136002) and the National Basic Research Program of China (2013CB733702).

