微波协同纤维素酶法提取薯蓣多糖工艺研究
龙菊++黄元射+何映霞
摘要:采用微波协同纤维素酶法提取薯蓣(Dioscorea opposita)多糖,并利用苯酚-硫酸法测定多糖的含量,在单因素试验的基础上,通过正交试验选出优化的组合因素。结果表明,最佳提取工艺条件为纤维素酶添加量0.20%、酶解时间70 min、酶解温度45 ℃、pH 5.0、微波功率600 W、微波时间50 s,在此条件下,薯蓣多糖提取含量为30.25 mg/g,明显高于其他提取方法。
关键词:薯蓣(Dioscorea opposita)多糖;提取工艺;微波;纤维素酶;正交试验
中图分类号:Q539 文献标识码:A 文章编号:0439-8114(2015)17-4266-04
DOI:10.14088/j.cnki.issn0439-8114.2015.17.041
薯蓣(Dioscorea opposita)又名山药,产量高,营养成分全面,含有丰富的碳水化合物和蛋白质。薯蓣多糖是薯蓣中一种高效的活性成分,主要由甘露糖、木糖、阿拉伯糖、葡萄糖和半乳糖组成[1-3],具有增强免疫功能,降血糖、降血脂、抗氧化、抗衰老等多种生理活性[4,5]。目前,薯蓣多糖的提取方法有微波辅助法、超声波辅助法、水提取法、索氏提取法和纤维素酶解法等,但均存在提取时间较长、提取率较低等缺点[6-8]。为了进一步提高薯蓣多糖的提取率,缩短提取时间,本研究在单因素分析法的基础上,采用多因素正交分析法,用微波技术协同纤维素酶法提取多糖,并对薯蓣多糖提取工艺进行优化,旨在为薯蓣多糖的提取提供一套快速、高效的方法。
1 材料与方法
1.1 材料
薯蓣:新鲜薯蓣购于贵州省安顺市农贸市场。
主要试剂:纤维素酶、无水乙醇、浓硫酸、苯酚(分析纯);去离子水。
主要仪器:752型紫外-可见分光光度计、AB204-N型电子天平、DHG-9305AD型电热恒温干燥箱、EPP系列微量移液器、粉碎机、微波炉、旋转蒸发器、离心机、HH-S型恒温水浴锅。
1.2 方法
1.2.1 薯蓣多糖提取工艺流程 精确称取薯蓣粉1.0 g,加入去离子水10 mL,用600 W微波功率处理60 s,再加入0.2%纤维素酶,在50 ℃条件下酶解2 h,提取结束后抽滤提取液,浓缩到适当体积。具体工艺流程:薯蓣→干燥粉碎→称量→去离子水溶解→微波水浴加热→纤维素酶→灭活酶→水浴提取→离心取上清液→浓缩。
1.2.2 薯蓣多糖测定
1)采用苯酚-硫酸法测定吸光度。
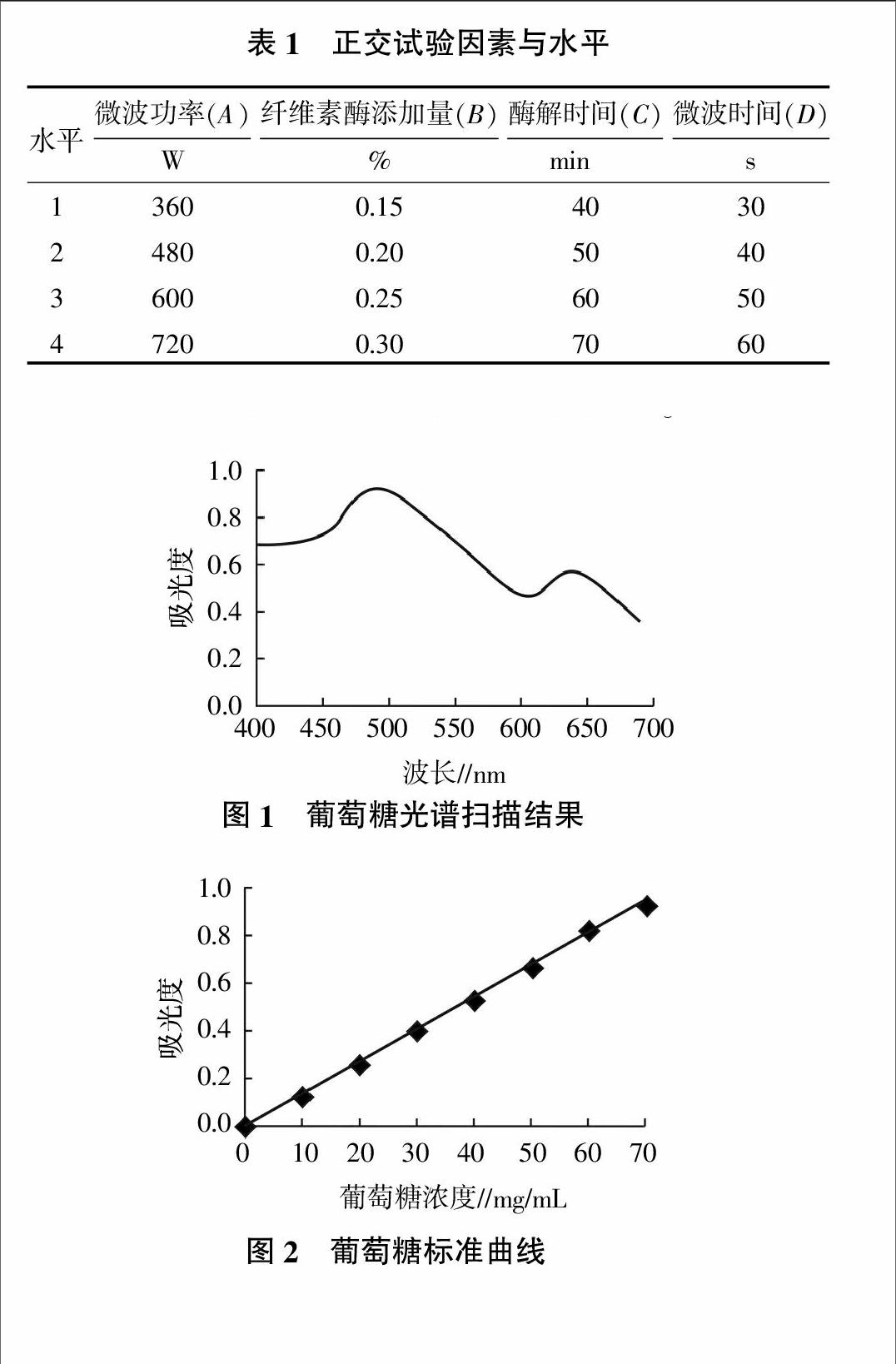
2)检测最大吸收波长。精确吸取0.5 mL葡萄糖标准品溶液,加去离子水至2.0 mL,加入6%苯酚溶液1.0 mL,迅速加入5.0 mL浓硫酸,静置10 min,充分摇匀后室温放置20 min。在波长400~700 nm范围内扫描,用紫外分光光度计扫描光谱图。
3)葡萄糖标准曲线绘制。精确称取105 ℃下干燥至恒重的葡萄糖0.10 g,加入去离子水溶解,定容到100 mL,即得100 mg/mL葡萄糖标准溶液。取8支具塞试管,分别加入0、0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL葡萄糖标准溶液,5.0 mL浓硫酸,1.0 mL 6%苯酚溶液,用去离子水定容至8.0 mL,静置10 min,充分摇匀后室温放置20 min,在最大波长处测定吸光度。以葡萄糖浓度为横坐标,吸光度为纵坐标,绘制标准曲线。薯蓣多糖含量的计算公式:多糖含量(mg/g)=[标准曲线计算样品浓度值(mg)×样品总体积(mL)]/[样品的质量(g)×取样体积(mL)]。
1.2.3 微波纤维素酶法提取薯蓣多糖的显著作用试验 分别精确称取1.0 g薯蓣粉20份,每5份为一组,共分4组对薯蓣多糖进行提取,分别为:①水浸提法处理组。分别加入10 mL去离子水,60 ℃水浴提取2 h,提取结束后抽滤提取液,浓缩到适当体积。按照苯酚-硫酸法测定其吸光度,计算薯蓣多糖含量。②微波提取法处理组。分别加入10 mL去离子水,用600 W微波功率处理60 s,再按水浸提法处理组的方法进行操作。③纤维素酶法处理组。分别加入10 mL去离子水,加入0.2%纤维素酶,在温度50 ℃条件下酶解1 h,再按水浸提法处理组的方法进行操作。④微波协同纤维素酶法处理组。分别加入10 mL去离子水,用600 W微波功率处理60 s,后再加入0.20%纤维素酶,在温度50 ℃条件下酶解1 h,再按水浸提法处理组的方法进行操作。
1.2.4 纤维素酶法提取薯蓣多糖单因素试验 在“1.2.3”中“③”的条件下,通过改变纤维素酶添加量(0.05%、0.10%、0.15%、0.20%、0.25%、0.30%)、酶解时间(20、30、40、50、60、70、80、90 min)、酶解温度(30、35、40、45、50、55、60、65 ℃)、pH(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5),考察各因素对薯蓣多糖提取率的影响。
1.2.5 微波法提取薯蓣多糖单因素试验 在“1.2.3”中“②”的条件下,通过改变微波功率(160、320、480、600、720、840 W)和微波时间(10、20、30、40、50、60、70 s),考察2因素对薯蓣多糖提取率的影响。
1.2.6 薯蓣多糖提取率的正交优化试验 在单因素试验的基础上,采用正交试验以纤维素酶添加量、酶解温度、微波功率和微波时间,按照L16(44)设计4水平4因素试验,试验因素与水平见表1,共16个组合,3次重复,确定薯蓣多糖的最佳提取方法。
2 结果与分析
2.1 葡萄糖最大吸收波长
采用苯酚-硫酸法,通过紫外分光光度计在400~700 nm波长范围内扫描,由图1可以看出,葡萄糖标准品在490 nm处有最大吸收波长,因此490 nm为葡萄糖吸光度的最佳检测波长。
2.2 标准曲线的绘制
采用苯酚-硫酸法,通过在最大吸收波长490 nm处测定葡萄糖吸光度,以葡萄糖浓度(x)为横坐标,吸光度(y)为纵坐标,绘制标准曲线,结果见图2,得到标准曲线方程:y=0.013 5x-0.258 3,R2=0.999 6。当测定多糖含量时,将吸光度代入标准曲线,即可求出所测溶液的多糖含量。
2.3 微波纤维素酶法提取薯蓣多糖的显著作用试验结果
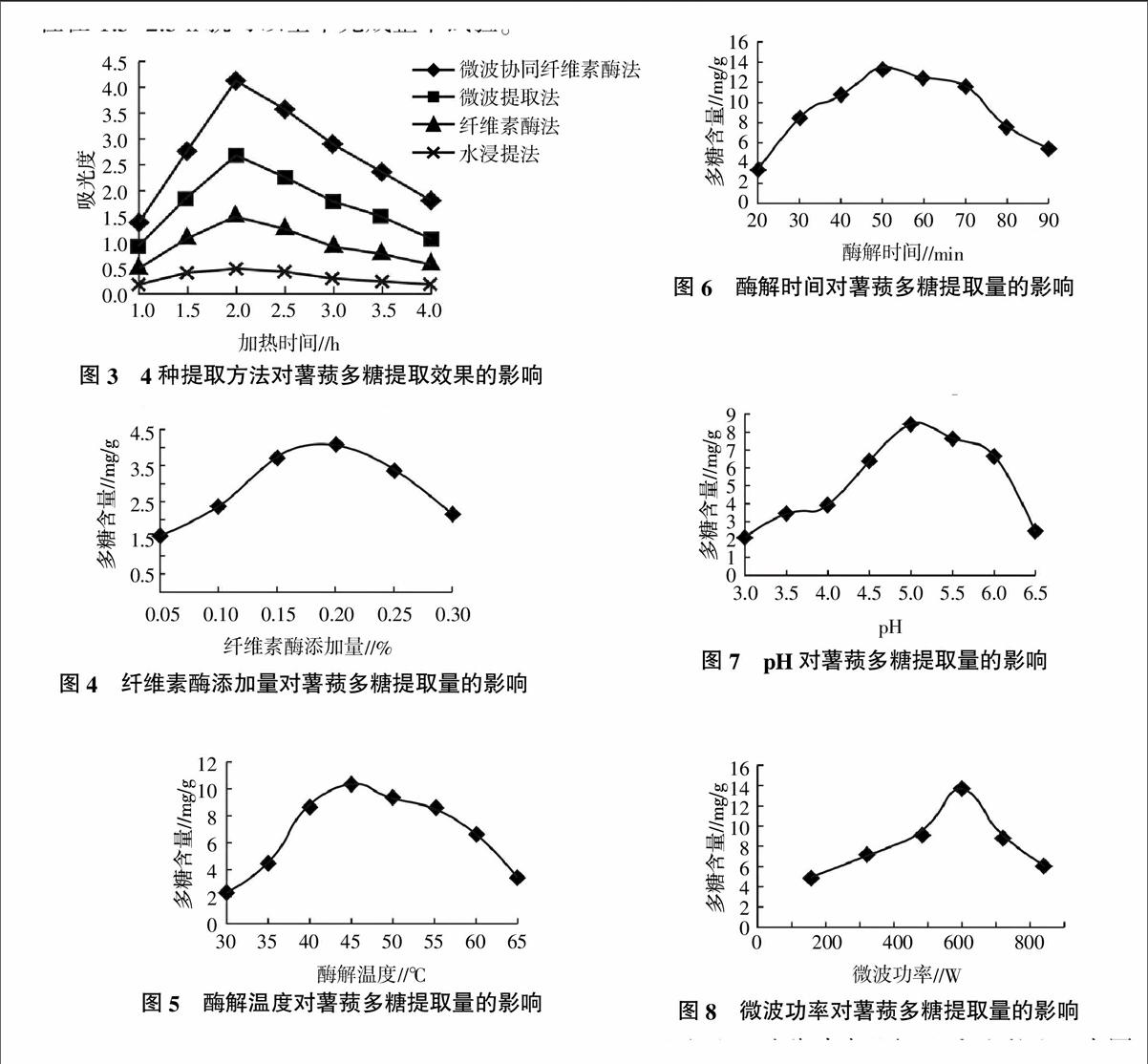
由图3可知,在薯蓣多糖的提取过程中,提取效率最高的是微波协同纤维素酶法处理组;其次为微波提取法处理组和纤维素酶法处理组;水浸提法处理组最低。说明与其他3种方法相比,微波协同纤维素酶法可提高薯蓣多糖的提取效率,且提取过程在1.5~2.5 h就可以基本完成整个试验。
2.4 纤维素酶法提取薯蓣多糖单因素试验结果
2.4.1 纤维素酶添加量对薯蓣多糖提取量的影响 由图4可知,当纤维素酶添加量在0.15%~0.20%时,薯蓣多糖含量快速增加;当纤维素酶添加量为0.25%时,多糖含量变化比较平缓,变化不大;当纤维素酶添加量达0.30%时,多糖含量开始减少,其主要原因是多糖与纤维素酶分子达到饱和状态,多糖提取量达到最大,因此纤维素酶添加量为0.20%时即可。
2.4.2 酶解温度对薯蓣多糖提取量的影响 由图5可知,随着温度升高,薯蓣多糖含量升高,其原因是温度升高,多糖在水中的溶解度升高。当温度超过45 ℃时,薯蓣多糖含量反而下降,主要原因是超过了纤维素酶的最适温度。因此纤维素酶法提取薯蓣多糖最佳提取温度为45 ℃。
2.4.3 酶解时间对薯蓣多糖提取量的影响 由图6可知,纤维素酶在加热后随着时间延长,薯蓣多糖含量不断提高;在50~70 min时,多糖含量变化不大。当提取时间超过70 min后,多糖含量逐渐减少。因此纤维素酶法提取薯蓣多糖的最佳提取时间在50~70 min。
2.4.4 pH对薯蓣多糖提取量的影响 由图7可知,随着pH增加,薯蓣多糖含量随之增加, pH 5.0时,多糖含量达到最大值。当pH低于或高于5.0时,影响纤维素酶的活性,从而使多糖提取量降低,因此纤维素酶法提取薯蓣多糖的最适pH为5.0。
2.5 微波法提取薯蓣多糖单因素试验结果
2.5.1 微波功率对薯蓣多糖提取量的影响 由图8可知,随着微波功率的升高,薯蓣多糖含量逐渐增加,当功率达600 W时,多糖含量达到最大值。这是由于功率的升高,加速多糖与水分子之间的运动,有利于多糖的提取,当微波功率超过600 W时,分子间的运动已达到极值,致使多糖提取量下降。因此选取微波功率600 W。
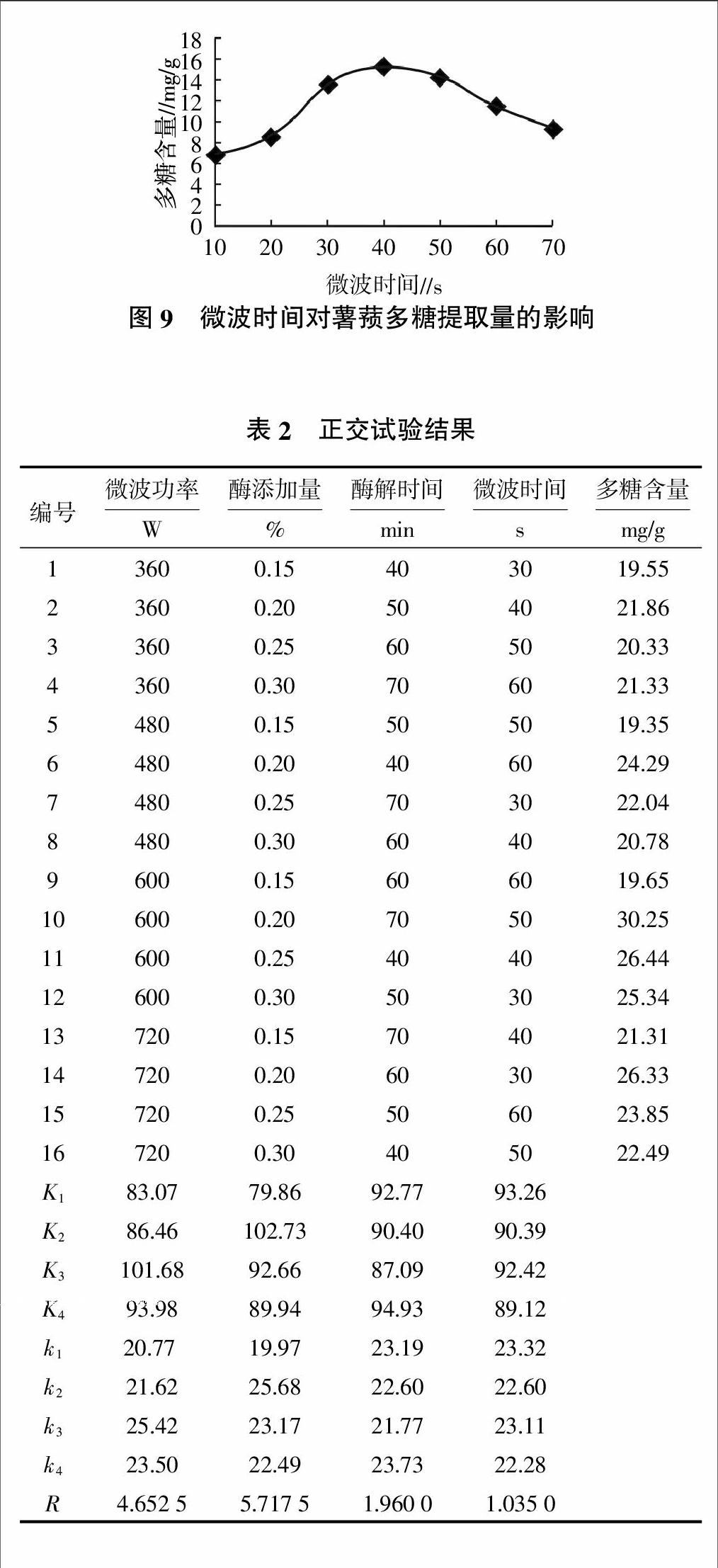
2.5.2 微波时间对薯蓣多糖提取量的影响 由图9可知,随着微波时间的延长,薯蓣多糖含量开始上升,当微波时间为30~60 s时,薯蓣多糖含量趋于平稳,变化不大。因此,微波提取时间应控制在30~60 s较好。
2.6 薯蓣多糖提取工艺的正交试验结果
由表2可知,各因素对薯蓣多糖提取效果影响从大到小依次为纤维素酶添加量、微波功率、酶解时间、微波时间。由表3和图10可知,微波功率和纤维素酶添加量对多糖提取影响极显著,酶解时间有一定影响,微波时间对多糖提取的影响最小,因此最优工艺组合选取A3B2C4D3,即微波功率为600 W、纤维素酶添加量为0.20%、酶解时间70 min、微波时间50 s。在此条件下,薯蓣多糖含量为30.25 mg/g。
3 讨论
本研究以薯蓣为研究对象,探讨水浸提法、纤维素酶法、微波提取法、微波协同纤维素酶法4种方法提取薯蓣多糖的效果,结果表明微波协同纤维素酶法为最佳提取方法。利用单因素试验和正交试验确定微波协同纤维素酶法最佳提取条件为纤维素酶添加量0.20%、酶解时间70 min、酶解温度45 ℃、pH 5.0、微波功率600 W、微波时间50 s,在此条件下,薯蓣多糖提取含量为30.25 mg/g。微波提取法和纤维素酶法所用微波功率、纤维素酶添加量过大或酶解时间过长均可能造成多糖有效成分分解,从而造成损失。本研究将微波提取法和纤维素酶法2种方法有机地结合起来,并利用正交试验确定了最佳提取条件,其提取工艺具有操作简单、速度快、效率高、质量好等特点,是一种有发展潜力的技术,为今后工业化提取多糖提供了很好的思路。
参考文献:
[1] 葛立军,朱振洪,沙 跃,等.正交实验优化复合酶法提取山药多糖工艺研究[J].时珍国医国药,2010,21(12):3187-3188.
[2] 曾凡梅,张 恒,孔明航.超声波协同纤维素酶提取山药多糖的工艺及组分测定研究[J].江西食品工业,2010(2):32-34.
[3] 秦 婷,郭金甲,刘井利,等.山药多糖的研究进展[J].中国当代医药,2013,20(13):20-21,25.
[4] HEINECKE J W. The role of myeloperoxidase in HDL oxidation and atherogenesis[J]. Current Atherosclerosis Reports,2007, 9(4):249-251.
[5] 赵 希,张黎明,王玲玲.酶法提取山药中多种水溶性成分的工艺研究[J].精细化工,2009(1):28-32.
[6] 陈少青,蒋旭钢,汪财生,等.紫山药多糖超声波辅助提取工艺优化及抗氧化性能研究[J].江苏农业科学,2009(5):231-234.
[7] 国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2010.27.
[8] 宋永刚,胡晓波,王震宙.山药的活性成分研究概况[J].江西食品工业,2007(4):45-48.

