烟草黑胫病菌侵染叶片的动态
姚恒++方敦煌++肖炳光


摘要:对抗烟草黑胫病菌(Phytophthora parasitica var. nicotianae)的烟草品种RBST与红花大金元(红大)叶片进行黑胫菌接种,采用细胞生物学的方法,在不同时间取样、染色、显微观察,揭示黑胫病菌在抗感叶片时的侵染动态。结果表明,接种感病红大叶片16~20 h,黑胫病菌通过气孔侵入红大叶表皮组织,接种48 h后,黑胫病菌长满整个接种小叶盘;而接种抗病RBST叶片24 h后,抗病的RBST叶片才出现极少的坏死斑,随着接种时间的延长,坏死斑区域有少量的扩大,但在接种72 h后,坏死面积只占接种小叶盘面积的很小部分。
关键词:烟草黑胫病菌(Phytophthora parasitica var. nicotianae); 侵染; 动态
中图分类号:S432.4 文献标识码:A 文章编号:0439-8114(2015)17-4184-04
DOI:10.14088/j.cnki.issn0439-8114.2015.17.019
烟草黑胫病的病原为卵菌门疫霉属烟草疫霉(Phytophthora nicotianae Breda de Haan),严重危害世界各烟区的烟草生产[1-3],其不仅侵染烟草成株的茎基部和根部,也侵染叶片和茎中、上部[4-6]。中国主要烟区的烟草黑胫病菌为0号和1号小种[7]。
烟草黑胫病的防治目前主要采用选育抗病品种、轮作和药剂防治等措施,选育抗病品种是最直接最有效的方法。目前,我国也已选育并且从国外引进抗黑胫病的烤烟品种[8-10]。除此之外,改进某些栽培措施[11,12]和利用拮抗菌[13-15]的生物防治也能对烟草黑胫病的发生取得一定的效果。
烟草黑胫病的研究文献虽然很多,但是对黑胫病菌是如何侵染烟草叶片的文献很少。本研究以感病和抗病的2个品种进行试验,研究了烟草黑胫病菌侵染叶片的动态过程,揭示了病菌是何时侵染感病烟草叶片、何时在叶表皮组织中扩展,比较了黑胫病菌对感病、抗病烟草叶片侵染的不同。旨在探讨烟草黑胫病侵染叶片的规律,为烟草黑胫病的防治提供理论依据。
1 材料与方法
1.1 材料
供试烟草品种:感烟草黑胫病品种红花大金元,抗烟草黑胫病品种RBST。烟草黑胫病菌为烟草疫霉菌株119#。培养基为燕麦培养基(OA):燕麦30 g、琼脂15 g、去离子水1 L。称取新鲜燕麦片30 g,用沙布包起燕麦片扎口加入到1 L去离子水中煮沸2 h,取出沙布将液体补足1 L,加入琼脂15 g,121.3 ℃高压15 min分装待用。
1.2 方法
1.2.1 烟草幼苗的培养 采用二段式育苗方法:将供试烟草品种的种子播种在595孔的漂浮盘上,在12 h光照与12 h黑暗交替、温度28±1 ℃、湿度70%以上的人工培养室中培养至烟苗可以连同基质一起拔出时,转移到162孔漂浮盘中在上述人工培养室继续培养至6~7叶期(苗龄40~50 d)。
1.2.2 烟苗接种疫霉病菌 离体叶片接种:分别剪取烟株自上而下的第3片,放置于垫有3层滤纸的培养皿中,利用直径0.5 cm打孔器将培养基上的黑胫病的菌丝块打成圆柱块状,用小镊子取菌丝块黏附在叶片上进行侵染。
1.2.3 取样 按照表1时间间隔取样,临近每个时间点,利用直径0.5 cm打孔器将菌丝块侵染部位的小叶盘取下。
1.2.4 染色 台盼蓝/苯胺蓝染色 菌丝结构和植物死亡组织细胞被染成蓝色。储存液:10 g苯酚、10 mL甘油、10 mL乳酸、10 mL ddH2O、0.02 g台盼蓝/苯胺蓝。工作液∶储存液∶96%乙醇(1∶2,V/V)。透明液∶1 kg 水合氯醛溶解于400 mL去离子水,盖好盖子溶解12 h。染色步骤:取下菌丝块侵染的叶片组织浸没到台盼蓝/苯胺蓝工作液中,沸水水浴1 min,工作液染色过夜。第2天取出染色叶片放入水合氯醛中透明,根据需要可换几次透明液,直到样品变成透明后就可以进行镜检。
2 结果与分析
2.1 烟草黑胫病菌从气孔侵入感病烟草叶表皮
如图1-a所示,可以清晰的看到烟草黑胫病疫霉菌侵染红大叶表皮是通过气孔侵入的。查询样本取样时间,确定图1-a为疫霉菌接种16 h的样品,这说明通过病菌块接种烟草叶片,疫霉病菌需要经过16 h才能开始从烟草气孔侵入叶表皮中;图1-b为菌丝块接种20 h后的样品图像,在低倍物镜下,可以清晰的观察到大量疫霉病菌从叶表皮细胞气孔中侵入叶表皮组织。
通过细胞学染色观察,可以清楚地知道,烟草黑胫病疫霉病菌开始侵入叶片大约需要16~20 h。
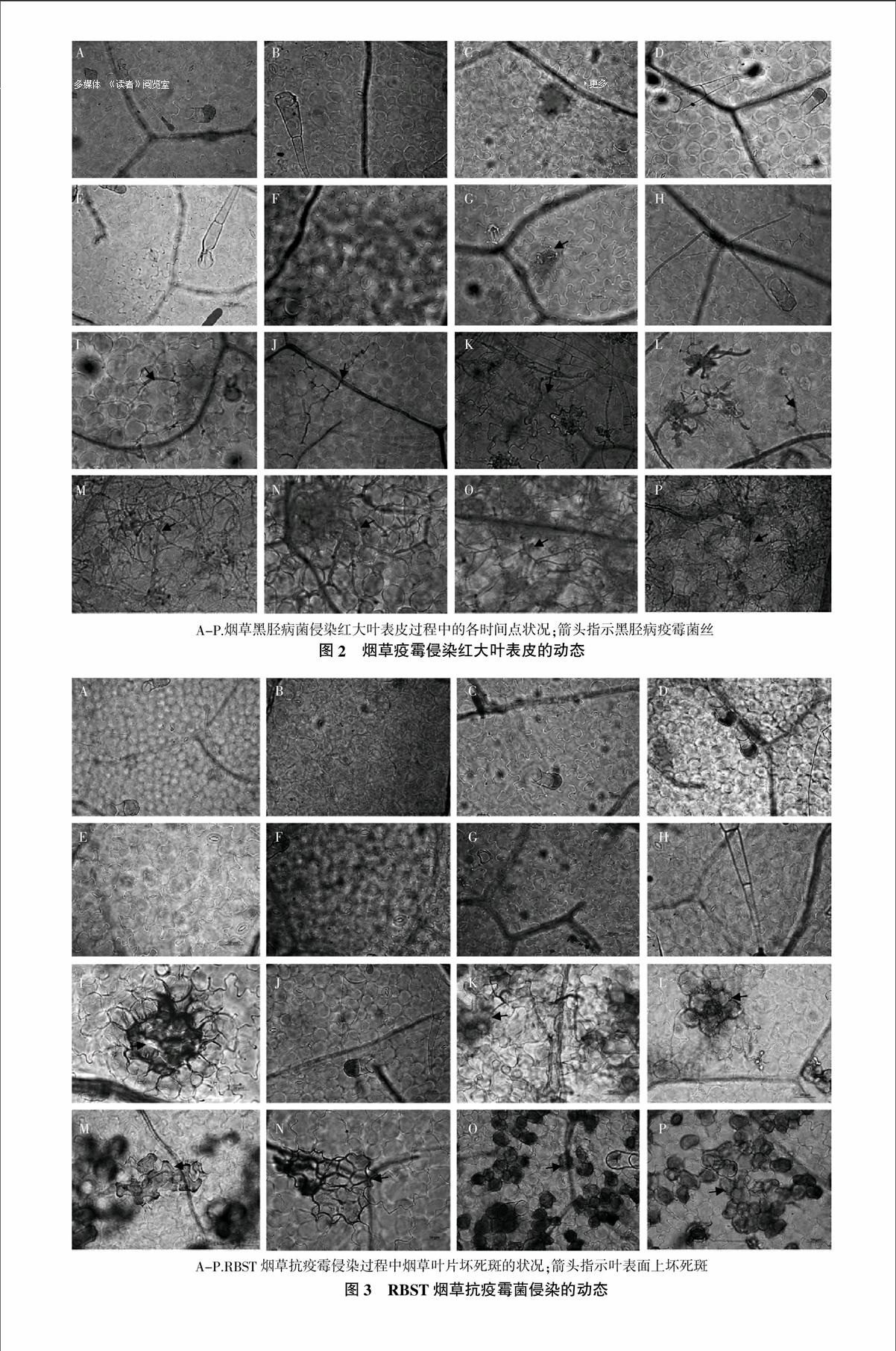
2.2 烟草疫霉菌侵染红大烟草叶表皮的动态
如图2所示,在接种疫霉菌16 h后,黑胫病疫霉菌开始侵染红大叶表皮;20~24 h疫霉病菌丝就能够长入叶片叶肉组织;30~48 h菌丝数量逐渐增多,48 h就能长满整个样品小叶盘;56~72 h菌丝生长密度进一步增大,对烟叶危害加剧。
比较黑胫病疫霉菌侵染感病烟草红大叶片的样品细胞学图片,可以将黑胫病疫霉病菌侵染叶表皮组织分为4个阶段:首先为黑胫病预备侵染阶段,这个阶段为0~16 h。这个阶段黑胫病的菌丝还不能侵入烟草叶表皮,如果要预防黑胫病菌对烟叶的危害,在这个时期效果最佳。其次是开始侵染阶段,这个阶段大约是在接种后16~24 h,这个阶段黑胫病菌已经开始从叶表皮的气孔侵入到叶肉组织内,但是疫霉菌丝侵染的程度还比较轻,这个时期进行喷药控制应该还有效果。再次就是24~48 h,这个时期,黑胫病菌丝已经在烟叶内部进行生长,危害进一步加剧。最后一个时期48~72 h为重度感染时期,黑胫病菌丝已经长满整个接种小叶盘,这时期再进行防治已经失去了意义。
2.3 RBST烟草抗疫霉菌侵染的动态
如图3所示,在接种疫霉菌24 h后,RBST叶片表面出现极个别坏死小点;接种36~48 h,RBST叶片表面会出现个别的侵染部位,但是区域很小;接种56~72 h,RBST叶面出现少量坏死斑,但是在低倍视野下进一步观察,这部分坏死区域只占接种叶盘面积的很少量的部分。总之,在接种72 h后,坏死的叶盘面积仍然是占很小的部分。结果表明,RBST烟草品种的叶片对黑胫病疫霉菌是高度拮抗的。
3 小结与讨论
不同烟草品种叶片对黑胫病疫霉菌的抗性有着显著的差异,烟叶拮抗黑胫病疫霉菌侵染能力与烟草品种自身黑胫病的抗性强弱呈正相关。常规鉴定烟草品种黑胫病菌抗性的方法是通过茎部注射接种的方法进行的,然后统计烟草茎部病情指数及发病率来评定烟草品种的抗性级别。这种鉴定方法的人工操作成本太高,并且受到烟草生长状况的限制。从烟叶表皮细胞图片可以看出,不同品种烟叶在接种黑胫病菌后,烟叶表皮对黑胫病菌的侵染呈现相应的抗感状况,并且抗感病情的发展情况和接种时间呈现一定程度的正相关性。如感病的红大随着接种黑胫病菌时间的延长,黑胫病菌在烟叶叶肉组织中的生长数量增加,病情加剧,而抗病的RBST烟草表皮坏死程度也在缓慢增加,表明这种接种黑胫病菌的方法是能够真实、有效地反映烟草黑胫病抗性的。接种黑胫病菌为烟草黑胫病的抗性鉴定提供一个便利且高效的方法,客观上也将促进烟草抗黑胫病品种的选育。
烟草黑胫病的抗性机理有待于深入的研究。本试验清楚地表明,黑胫病菌是通过气孔侵入红大烟草叶表皮组织的。而黑胫病菌却很少能够通过RBST的气孔进入到叶表皮组织中;即使黑胫病菌侵染了RBST的叶表皮,RBST又是通过何种机制来拮抗黑胫病菌在其中的繁殖和生长的。虽然大量的生理学证据表明在寄主植物和病原物非亲和性互作(抗病反应)和亲和性互作(感病反应)中酶与植物抗性密切相关[16-18]。植物体内SOD、POD、CAT、PPO、PAL和丙二醛可以作为植物抗病性的生理指标,但是这些指标并不能从根本上揭示烟草黑胫病的抗性机理。只有从基因水平上克隆黑胫病菌抗性相关的基因,并深入的研究抗性基因的功能才能深刻地阐明黑胫病的抗性机理,进而推动烟草抗黑胫病品种的选育。
参考文献:
[1] WOLF F A. Tobacco diseases and dDecays[M].North Carolina:Duke University Press,1957.268-280.
[2] 赖传雅.农业植物病理学(南方本)[M].北京:科学出版社,2003.157-161.
[3] 陈瑞泰,朱贤朝,王智发,等.全国16个主产烟省(区)烟草侵染性病害调研报告[J].中国烟草科学,1997(4):1-7.
[4] 中国农业科学院烟草研究所.中国烟草栽培学[M].上海:上海科学技术出版社,1987.281-284.
[5] 华南农业大学,河北农业大学.植物病理学[M].第二版.北京:中国农业出版社,2000.244-247.
[6] 杨建卿,江 彤,承河元.烟草病理学[M].合肥:中国科学技术大学出版社,2003.164-167.
[7] 朱贤朝,郭振业,刘保安.我国烟草黑胫病菌生理小种研究初报[J].中国烟草,1987(4):1-3.
[8] 梁元存,刘延荣,王玉军,等.烟草黑胫病菌致病性分化和烟草品种的抗病性差异[J].植物保护学报,2003,30(2):143-147.
[9] 高正良,周本国,雷艳丽.黑胫病菌在烟草品种间的侵染差异及I-S关系研究[J].中国烟草学报,2004,10(4):31-35.
[10] 许美玲,张绍芬,段玉琪,等.烤烟品种资源抗黑胫病综合评价[J].云南农业大学学报,2003,18(1):42-47.
[11] 朱贤朝.烟草黑胫病菌生理小种研究概况和鉴定技术[J].中国烟草,1982(1):23-26.
[12] 王家和.烤烟根部真菌区系及其致病性研究[J].云南农业大学学报,1994,9(2):95-100.
[13] ENGLISH J T,MITCHELL D J. Influence of an introduced composite of microorganism on infection of tobacco by Phytophthora parasitica var.nicotianae[J].Phytopathology,1988,78:1484-1490.
[14] ENGLISH J T,MITCHELL D J. Relationship between the development of root systems of tobacco and infection by Phytophthora parasitica var.nicotianae[J].Phytopathology,1988,78:1478-1483.
[15] 李梅云,李天飞,刘开启,等.烟草黑胫病木霉生防菌株的筛选[J].中国烟草科学,2001(2):43-46.
[16] 马春红,郑秋玲,张凤莲,等.玉米新改良群体多酚氧化酶活性变化[J].玉米科学,2011,19(2):70-72.
[17] 王桥美,范静华,果志华,等.烟草黑胫病菌毒素对烟草防御性相关酶的诱导作用[J].云南农业大学学报,2011,26(1):20-25.
[18] 房保海,张广民,迟长凤,等.烟草低头黑病菌毒素对烟草丙二醛含量和某些防御酶的动态影响[J].植物病理学报,2004, 34(1):27-31.

