电针对脑缺血再灌注大鼠纹状体D1R和DAT表达的影响
徐鸣曙,陈春艳,李昌植,葛林宝,张淑静,赵丹,李明哲,韩清,张英杰
(1.上海市针灸经络研究所,上海 200030;2.上海市气功研究所,上海 200030;3.上海中医药大学,上海 201203)
自Globus首先证实多巴胺(dopamine,DA)在缺血性脑损伤中的作用以来,人们便对DA在缺血性脑损伤中的作用机制进行了广泛而深入的研究。脑内微透析发现,脑缺血时可引起纹状体、海马等部位DA和兴奋性氨基酸(exicted amine acid,EAA)的大量堆积[1]。在脑缺血再灌注过程中DA自身的神经毒性、代谢产物的神经毒性、增强EAA的毒性以及诱导凋亡等作用[2-4]在脑缺血再灌注损伤中具有重要作用。多巴胺转运体(dopamine transport,DAT)在维持突触间DA适当浓度中发挥重要作用,而多巴胺D1受体(D1R)和D2R是其发挥作用的重要环节之一。本实验采用大脑中动脉缺血(middle cerebral artery occlusion,MCAO)再灌注模型,观察电针、D1R工具药及针药结合对脑缺血再灌注大鼠纹状体内D1R和DAT表达的影响,以期探讨电针干预对缺血性脑损伤的可能作用机制。
1 材料与方法
1.1 动物
清洁级健康雄性Sprague Dawley大鼠47只,体重(300±20)g,实验大鼠均购自中科院上海实验动物中心。动物饲养环境为清洁级实验室饲养,温度 20~25℃,湿度 40%~70%,噪声<60 dB,换气次数 10~20次/h,工作照度12 h明12 h暗,实验前适应性饲养3 d。
1.2 主要试剂
多巴胺D1受体激动剂(SKF38393,Sigma公司,批号065K4615);多巴胺D1受体拮抗剂(SCH23390,Sigma公司,批号015K4630);D1R多克隆抗体(兔抗鼠)(Santa Cruz公司,批号SC-14001);DAT多克隆抗体(兔抗鼠)(Santa Cruz公司,批号SC-14002);EnVision kit(DAKO公司,批号GK500705)。
1.3 主要仪器
环球牌针灸针(苏州针灸用品厂),0.30 mm×13 mm;G6805-ⅠA型电针仪(上海华谊医用仪器厂)。
1.4 模型制作
参照Longa EZ[5]的方法制备大鼠大脑中动脉缺血再灌注模型。
1.5 动物分组
按随机分组原则将SD雄性大鼠分为空白组、模型组、电针组、激动剂组、电针+激动剂组、拮抗剂组、电针+拮抗剂组。空白组5只,其余各组均7只。
1.6 动物处理
空白组:正常对照组。
模型组:成功制备线栓法大鼠大脑中动脉缺血(MCAO)再灌注模型。
电针组:制备脑缺血再灌注模型,再灌即刻予电针治疗,取双侧风池穴,选连续波,频率2 Hz,强度以大鼠耳廓轻度抖动为度(约 3 mA,示波器检测),共2次,每次25 min,间隔10 min。
激动剂组:制备脑缺血再灌注模型,再灌即刻予1 mg/kg的剂量予腹腔注射SKF38393。
电针+激动剂组:制备脑缺血再灌注模型,再灌即刻予电针治疗+腹腔注射SKF38393。
拮抗剂组:制备脑缺血再灌注模型,再灌即刻予1 mg/kg的剂量予腹腔注射SCH23390。
电针+拮抗剂组:制备脑缺血再灌注模型,再灌即刻予电针治疗+腹腔注射SCH23390。
1.7 神经功能缺损评分
各组处死前(再灌225 min)进行神经功能评分[6]。
1.8 指标检测
1.8.1 取材
实验结束时用10%水合氯醛4 mL/kg腹腔注射麻醉动物,经心脏灌注,先用 36℃的生理盐水(大约250 mL),再用室温的4%多聚甲醛400~500 mL,至大鼠四肢僵硬皮肤苍白为度。断头取脑,脑组织置于 4%多聚甲醛后固定6~8 h,然后浸于20%蔗糖中至沉底,4℃保存7 d后剥离纹状体(主要是尾状核)备用。
1.8.2 免疫组化检测
参照试剂盒说明书进行免疫组化实验。
1.8.3 观察方法
用已知阳性标本作阳性对照,阴性对照用PBS代替一抗,阳性产物为棕黄色或棕褐色,图像分析用MOTIC数码医学细胞图像分析系统。选取5个染色明显的视野(×400)计数检测指标的阳性表达面积光密度,组间进行比较。
1.9 数据处理
采用SPSS13.0统计软件,所有结果以均数±标准差表示,各组用单因素方差分析,组间两两比较用N-S-K法进行检验。
2 结果
2.1 各组神经功能缺损评分比较
由表1可见,电针组与模型组比较,神经功能缺损评分均显著降低(P<0.05);激动剂组、电针+激动剂组分别与电针组比较,神经功能缺损评分均显著升高(P<0.05);激动剂组、电针+激动剂组分别与电针+拮抗剂组比较,神经功能缺损评分均显著升高(P<0.05);其余各组间比较有差异,但无统计学意义(P>0.05)。
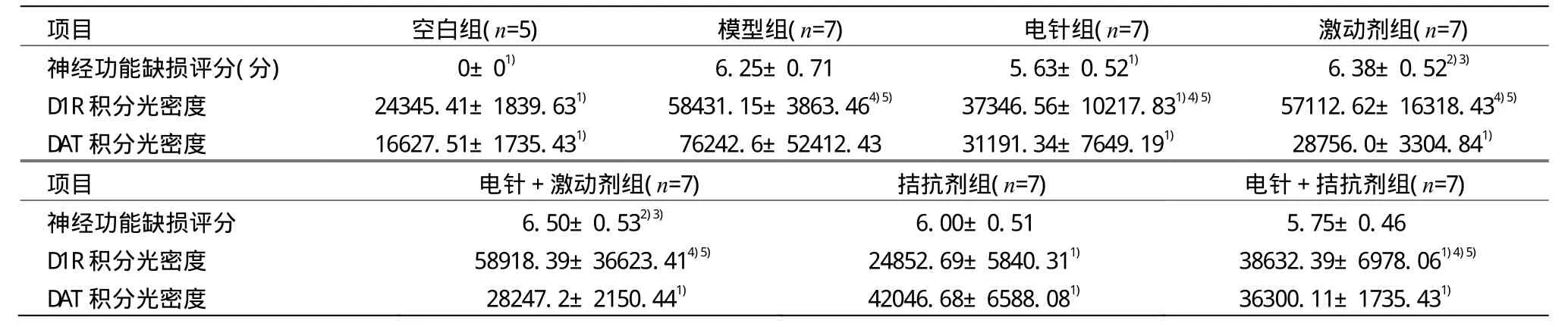
表1 各组神经功能缺损评分、D1R积分光密度、DAT积分光密度比较 (x±s)
2.2 各组D1R积分光密度比较
由表1可见,拮抗剂组与空白组比较差异无统计学意义(P>0.05),而其他各组与空白组比较差异均有统计学意义(P<0.05)。电针组、拮抗剂组、电针+拮抗剂组与模型组比较,D1R积分光密度有所下降,差异有统计学意义(P<0.05)。激动剂组与电针+激动剂组比较差异无统计学意义(P>0.05),且这两组D1R积分光密度与模型组相比,差异无统计学意义(P>0.05)。电针组D1R积分光密度与电针+拮抗剂组比较差异无统计学意义(P>0.05),但这两组与拮抗剂组比较差异有统计学意义(P<0.05)。
2.3 各组DAT积分光密度比较
由表1可见,各组DAT表达与模型组比较差异有统计学意义(P<0.05);但除模型组外各组间比较有差异,但无统计学意义(P>0.05)。
3 讨论
脑血管疾病是危害人类生命与健康的主要疾病之一,其中80%以上系由脑部缺血造成。针刺治疗中风有效,但具体作用机制尚未阐明。多巴胺是脑内重要的神经递质,与缺血性脑损伤关系密切[7-8]。DR和DAT是分别位于突触后膜和突触前膜上的DA特异性受体和转运体,二者共同作用保持了DA胞内外相对平衡,及其功能发挥。此外,D1R通过AC/cAMP/PKA通路、MAPK通路等信号途径,调控细胞内Ca2﹢水平、K﹢通道和Na﹢/K﹢-ATP酶活性,参与调节细胞内外Na﹢、K﹢、Ca2﹢等离子平衡[9-10]。
本研究主要集中于D1R和DAT,研究显示造模后大鼠神经功能缺损评分明显增高,并伴随 D1R表达的显著升高,与空白组比较差异均有统计学意义。电针处理可明显下调 D1R的表达,同时减轻神经功能缺损的评分。提示电针可能通过调节D1R的表达而间接调节脑缺血再灌注过程中细胞内Ca2﹢水平、K﹢通道、Na﹢/K﹢-ATP酶的活性、突触后膜KA/NMDA受体对Glu敏感性等,并最终使脑组织得到保护。
在电针基础上加用激动剂可使电针效应完全消除,显示激动剂可阻断电针的脑保护作用。单纯使用激动剂,不予电针,其结果与模型组相似,之间差异无统计学意义。该结果提示,该D1R激动剂无明显脑保护作用;缺血 90 min所造成的损伤已接近相对最严重的程度,D1R激动剂很难进一步加重损伤;若缺血损伤较轻时,加用D1R激动剂,就可能表现出加重损伤的效应。
综合神经功能缺损评分的结果进行分析,显示电针组恢复作用明显,D1R表达也明显下调;加用拮抗剂,未使神经保护的效应进一步增强;而单独使用拮抗剂,对神经功能缺损有明显保护作用,但与电针组尚略有差距,然而其D1R下调至正常水平。该结果从侧面反映,即使D1R恢复至正常水平,神经功能缺损依然存在。电针+拮抗剂组虽然D1R明显恢复,但未至正常水平,然而其神经功能恢复与电针组相当。该结果提示,电针与D1R的效应不重合,D1R不是电针效应的唯一途径;D1R在脑损伤修复中并非越少越好,应维持一定量。
综合行为学观察及D1R激动剂、拮抗剂的结果,分析后可以得知,在缺血再灌注脑损伤及保护中,除D1R外尚有其他因素的参与,故D1R的作用虽较重要,但也较有限;电针发挥的调节作用不能等同于D1R的作用,电针和D1R的效应不能做简单的叠加,调节D1R通路只是电针发挥其作用的途径之一。
从本实验DAT表达结果来看,虽然模型组与各组间比较差异有统计学意义,但除模型组外各组间差异无统计学意义,说明电针、工具药等干预方法可能对脑缺血再灌注条件下DAT的表达无影响,即DAT的表达与D1R介导和电针调节关系甚微,但此假设尚待进一步验证。
[1] Ishige K, Chen Q, Sagara Y, et al. The activation of dopamine D4 receptors inhibits oxidative stress-induced nerve cell death[J]. J Neurosci, 2001,21(16):6069-6076.
[2] Yurko-Mauro KA, Friedman E. Dopamine-stimulated changes in activated calpain I in rat hippocampal slices[J]. J Neurosci Res, 1996,43(4):476-481.
[3] Werling LL, Jacocks HM 3rd, Rosenthal RE, et al. Dopamine release from canine striatum following global cerebral ischemia/reperfusion[J]. Brain Res, 1993,606(1):99-105.
[4] Hattori A, Luo Y, Umegaki H, et al. Intrastriatal injection of dopamine results in DNA damage and apoptosis in rats[J]. Neuroreport, 1998,9(11):2569-2572.
[5] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989,20(1):84-91.
[6] Zhang YG, Liu TP, Qian ZY, et al. Influence of total saponins of Panax ginseng on infarct size and polyamine contents in rat brain after middle cerebral artery occlusion[J]. Chinese J Pharmacol Toxicol,1994,8(4):250-255.
[7] Xu MS, Fang C, Xu J, et al. Dynamic changes of dopamine and its metabolite levels in the rat striatum after cerebral ischemiareperfusion and electroacupuncture[J]. Zhen Ci Yan Jiu, 2009,34(4):230-235.
[8] Richards DA, Obrenovitch TP, Symon L, et al. Extracellular dopamine and serotonin in the rats triatum during transient ischemia of differents eveities: a microdialysis study[J]. J Neurochem, 1993,60(1):128-136.
[9] Lee MY, Heo JS, Han HJ. Dopamine regulates cell cycle regulatory proteins via cAMP, Ca(2﹢)/PKC, MAPKs, and NF-kappaB in mouse embryonic stem cells[J]. J Cell Physiol, 2006,208(2):399-406.
[10] Yagishita S, Hayashi-Takagi A, Ellis-Davies GC, et al. A critical time window for dopamine actions on the structural plasticity of dendritic spines[J]. Science, 2014,345(6204):1616-1620.

