香樟茎段组培快繁技术
张椿芳,王建军,何月秋
(1.宁波城市职业技术学院,浙江 宁波 315100; 2.宁波林业局林特种苗繁育中心,浙江 宁波 315012)
香樟茎段组培快繁技术
张椿芳1,王建军2,何月秋1
(1.宁波城市职业技术学院,浙江 宁波 315100; 2.宁波林业局林特种苗繁育中心,浙江 宁波 315012)
以多年生香樟茎段为外植体,进行丛生芽的诱导和快速繁殖试验。结果表明:无菌茎段接种至MS+6-BA 0.5 mg·L-1+IBA 0.07 mg·L-1的诱导培养基中,腋芽明显萌动并伸长展叶,且萌发率为100%;在MS+6-BA 0.5 mg·L-1+NAA 0.05 mg·L-1可形成大量丛生芽,平均有效芽数可达5.2个;在1/2 MS+IBA 0.05 mg·L-1生根培养基中培养20 d后,丛生芽全部生根,移栽成活率可达90%。
香樟;茎段;组织培养;再生体系
樟树(Cinnamomumcaphora)又名香樟,为樟科樟属的亚热带常绿阔叶乔木,广泛分布于中国、日本,同时作为园林树种和资源树种被引种到多个国家种植。其生长迅速,枝繁叶茂,四季常绿,叶形秀丽而又散发浓香,既是珍贵的芳香油类树种又是城市重要的景观和绿化树种。同时香樟种子遗传物质不稳定,后代可分化出多种基因型,经过选育可形成多种新品种。目前获得国家授权的品种‘涌金’[1]、‘霞光’系种子变异后代,具有较高的观赏价值,但是‘涌金’、‘霞光’母株仅有1株,需要通过无性繁殖方法保持其遗传特性并扩大其数量。然而,扦插和嫁接繁殖方式的成活率低。普通香樟资源丰富,开展其组培研究可为变异品种的组培技术开发提供借鉴。目前国内外对香樟组培研究取得了一定的成果,国内一些学者分别利用香樟伐根萌条[2-3]、不同龄期的茎段[4-12]、茎尖[13]、种子[14]、离体胚[15]、幼叶[16]、嫩芽[17-20]等作为外植体进行了组织培养研究工作并诱导出完整植株;K.Nirmal Babu等[21]也报道香樟茎段组织培养技术的研究成果,目前虽然有不少香樟组织培养获得成功的报道,但不同学者间的观点还存在一定的分歧,对香樟的组培体系的建立对成年香樟组培再生体系中增殖环节出现落叶[3,8]、生根率不高等问题,尚需加强其高效组培再生体系建立的研究,为进一步规模化生产提供技术支持。
1 材料与方法
1.1 试验材料
2014年8月于宁波市林业局种苗中心邱隘基地采集腋芽尚未萌发的多年生的香樟新梢,带回试验室备用。
1.2 试验方法
1.2.1 外植体的处理 取香樟发育充实、半木质化的侧梢和顶梢部分,去除叶片,剪成带有1~2个腋芽的茎段,用洗洁精清洗4~5 min,流水冲洗30 min 以上。在超净工作台上用75%的酒精消毒3 min,无菌水冲洗3次,再用 0.1%升汞根据茎段直径大小消毒 8~12 min,无菌水冲洗4~5次。滤纸吸干水分,切去茎段褐化部分,接种至MS培养基中,选择无菌材料进行腋芽诱导试验。
1.2.2 外植体诱导试验 以MS作为基本培养基添加不同类型的植物生长调节剂6-BA 0.5、1.0、2.0 mg·L-1;IBA 0.05、0.07,0.1 mg·L-1。采用不同浓度的正交组合形式,以筛选出适宜的腋芽诱导培养基,每个试验号接种30 个茎段,重复3 次,30 d以后观察腋芽生长情况。
1.2.3 增殖试验 以MS为基本培养,添加6-BA 0.5、1.0、3.0 mg·L-1;NAA 0.02、0.05,0.10 mg·L-1。采用不同浓度正交组合形式,以筛选出适宜的腋芽继代与增殖的培养基,每个试验号接种30个芽茎段,重复3次,30 d统计腋芽增殖与增殖形成的丛生芽的生长情况。
1.2.4 生根试验 选择培养瓶中生长一致、茎芽高2.0 cm的幼苗进行生根试验。以1/2 MS为基本培养基添加IBA 0.05、0.07、0.1 mg·L-1,每处理接种30株试管苗,重复3次,30 d统计丛生芽的生根及生长情况。
1.3 培养条件
经过灭菌处理后的离体材料培养于10 mL的试管中,得到无菌材料后接种至诱导培养基中进行培养。诱导、增殖的基本培养基为MS,白糖为30 g·L-1;生根基本培养基为1/2 MS,白糖为15 g·L-1。所有培养基pH值均为5.8,培养温度(25±1)℃,光照强度为40 μmol·m-2·s-1,光照时间为12 h·d-1。
1.4 数据分析
萌发率=腋芽生长外植体数/接种外植体数×100%;平均有效芽数=30 d统计总芽数/接种芽数(高度为1 cm以上为有效芽);生根率=生根苗数/接种苗数×100%。数据采用平均值±标准误 (SE)表示,采用SPSS 17.0统计软件对数据进行统计,均值比较采用单因子方差分析,不同处理方式显著差异性采用Duncan′s新复极差测验方法(SSR,P<0.05)。
2 结果与分析
2.1 腋芽萌发
多数学者[4-12]认为6-BA与NAA组合有利于香樟腋芽诱导,然而前期研究表明茎段在添加NAA的培养基中极易产生愈伤组织、腋芽断裂。在添加有适宜浓度的6-BA与IBA培养基中,无菌化后的茎段15 d后腋芽开始萌动、抽长并长出新叶。由表1可知,低浓度的6-BA、IBA有利于香樟腋芽的诱导,这与彭东辉[5]、龚峥等[19]报道的结果一致。当6-BA>1 mg·L-1、IBA>0.1 mg·L-1时香樟茎段腋芽的诱导率降低、茎段切口形成愈伤组织,进而褐化、死亡。当6-BA为0.5 mg·L-1、IBA为0.05~0.1 mg·L-1时,香樟茎段腋芽均可全部萌发,与其他组合相比,萌芽率达到显著水平(P<0.05)。然而IBA浓度较低则出现腋芽生长缓慢,而IBA>0.07 mg·L-1时萌发的腋芽出现新叶脱落,不利于进一步发育。综合分析表明,培养基MS+6-BA 0.5 mg·L-1+IBA 0.07 mg·L-1较为适合香樟腋芽的启动培养。
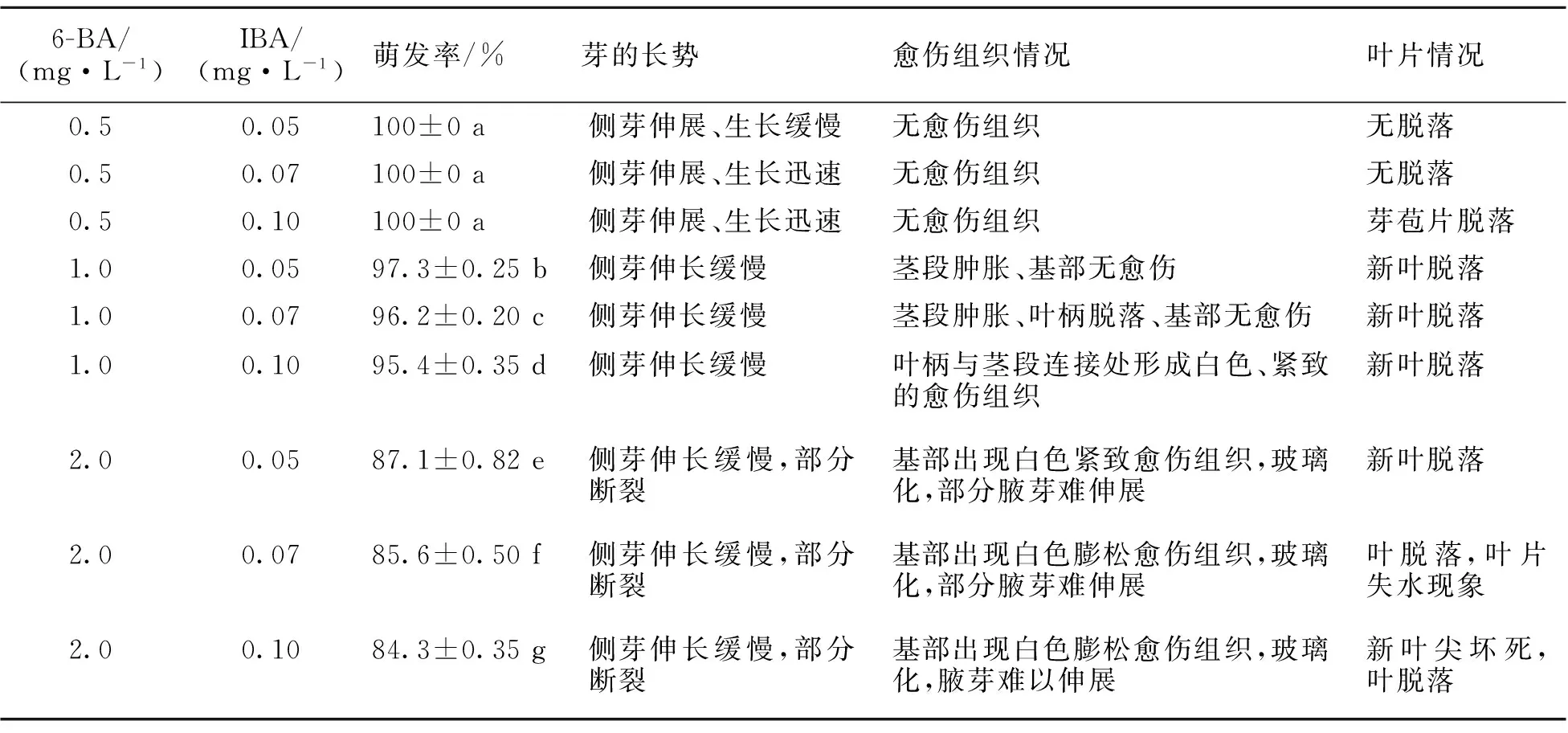
表1 不同植物生长调节剂组合对茎段腋芽诱导的影响
*:不同字母为差异显著(P<0.05,Duncan′s新复极差检验)。下同。
2.2 腋芽增殖
由表2可知,香樟腋芽在诱导培养基中继代时丛生芽难以增殖,同时容易出现叶片死亡、生长势逐渐衰弱进而出现死亡的现象。而在添加不同浓度的6-BA和NAA的培养基中,腋芽增殖形成的丛生芽可正常生长。当NAA为0.02~0.10 mg·L-1,6-BA为0.5 mg·L-1时腋芽可大量增殖,平均有效芽数最高可达到5.2;6-BA增加到1 mg·L-1时,虽然平均有效芽数有所提高,最高可达到5.4,显著高于6-BA为0.5 mg·L-1、3 mg·L-1时的平均有效芽数(P<0.05),但切口基部愈伤组织增加,分化的丛芽变得细小,严重的出现叶片脱落和褐化;当6-BA增加到3 mg·L-1时,平均有效芽数急剧下降,愈伤化严重,丛芽发育不良夹杂死苗,表明高外源植物生长调节剂不利于香樟丛生芽的继代与增殖。不同培养基配方对腋芽增殖效果进行分析表明,在培养基MS+6-BA 0.5 mg·L-1+NAA 0.05 mg·L-1中腋芽增殖达到的平均有效芽数可达到5.2以上,且形成的丛生芽生长状态好。因此,该培养基是香樟腋芽适宜的继代与增殖培养基。试验发现,香樟丛生芽在增殖培养基中反复继代6次以上,切口处容易形成大量白色膨松的愈伤组织,同时出现畸形苗和死苗,需要与无NAA的培养基隔代交替使用,以分化出更多生长正常的丛生芽,以保证增殖体系。
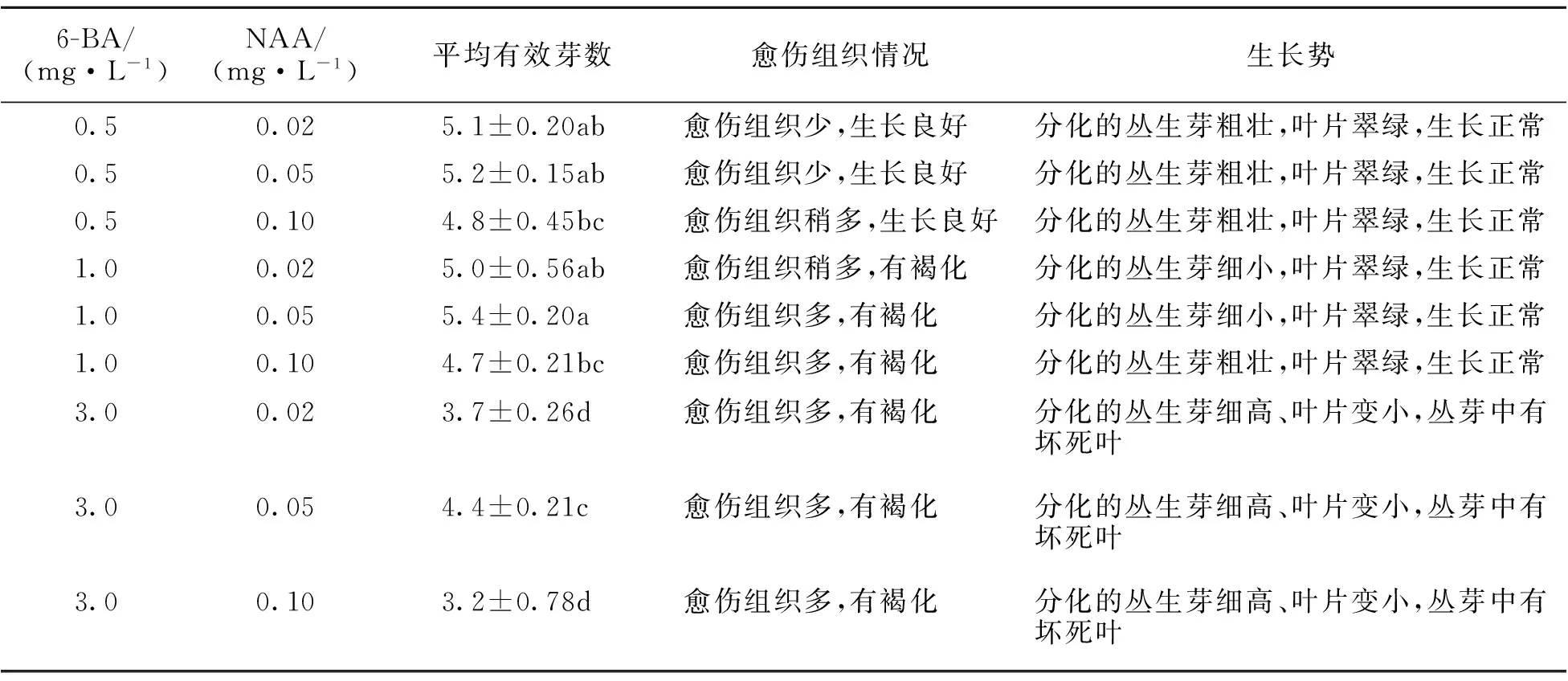
表2 不同植物生长调节剂组合对丛生芽增殖的影响
2.3 植株再生
将生长至2 cm高的香樟丛生芽转移至大量元素减半、添加不同浓度植物生长调节剂的生根培养基中。由表3可知,培养基无任何植物生长调节剂时丛生芽没有生根,生根率极低;随着IBA浓度的增加丛生芽的生根率逐渐增加。然而当IBA为0.1 mg·L-1及以上时,丛生芽的切口愈伤组织增多,根从愈伤组织长出,根的维管束组织与茎的维管束组织不相连,不利于生根苗的成活。同时形成的不定根大多数为5~6条,较少有侧根形成(图3、图4)。丛生芽在1/2 MS+IBA 0.05 mg·L-1培养基中生根率、平均根数、苗高显著高于其它生根培养基(P<0.05),因此该培养基是香樟组培苗生根的适宜培养基。30 d后选择健壮的再生植株进行移栽。移栽前逐渐打开瓶盖炼苗5~7 d,然后将小苗取出后,用水洗去根部残留的琼脂培养基,移栽于装有蛭石与泥碳土等比例混合的基质的容器内,60 d后移栽成活率为90%左右。
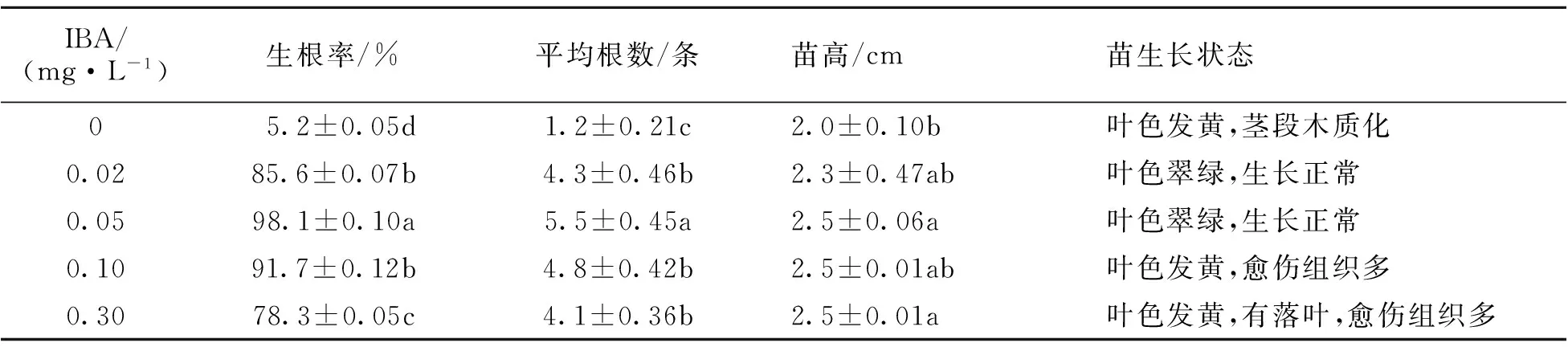
表3 香樟组培苗的生根培养

图3 樟树组培苗生根培养图4 樟树再生植株
3 结论与讨论
目前有不少香樟组织培养获得成功,多数研究者在香樟组培过程中选用的基本培养基为MS、改良MS、1/2 MS并按照不同的培养阶段进行相应的调整,在腋芽诱导和增殖阶段所使用的植物生长调节剂及浓度范围为6-BA(1~2 mg·L-1)和NAA(0.05~0.5 mg·L-1);继代与增殖阶段6-BA(3~5 mg·L-1)和IBA(0.2~0.1 mg·L-1),对于最佳浓度组合不同学者的观点存在一定的分歧[23],这可能与外植体采集的时间、树龄、基因型等诸多因素有关。本研究中香樟在再生体系建立过程中使用的基本培养基与其他学者基本一致,而使用的植物生长调节剂种类和浓度则表现出差异。本研究结果显示,香樟腋芽对NAA非常敏感,低浓度即可使得切口处、叶柄与茎段连接处产生大量愈伤组织并且茎段过于膨大,而MS+6-BA 0.5 mg·L-1+IBA 0.07 mg·L-1有利于香樟腋芽诱导与生长;在腋芽继代与增殖阶段6-BA与IBA的组合容易导致腋芽的生长势衰弱,而MS+6-BA 0.5 mg·L-1+NAA 0.05 mg·L-1则有利于腋芽的继代与增殖。同时在腋芽生长与增殖过程中最常见的问题是新生嫩芽褐化且嫩叶从上到下发生坏死现象,这与李乾振等[3]和索长江等[13]报道的一致。李乾振等[3]和索长江等[13]在研究普通香樟组培时认为添加NaH2PO450 mg·L-1可降低此现象的发生,本研究则通过调整植物生长调节剂的种类及浓度可以避免。整个培养过程表明,高浓度的植物生长调节剂容易导致腋芽的愈伤化并明显抑制其发育,但本试验中香樟丛生芽生长较慢,如何改善这一现状并提高香樟组培体系的高效性尚需进一步研究。在生根阶段,丛生芽在添加有IBA 0.05 mg·L-1的培养基中组培苗的生根率可达到100%。
[1]王建军.香樟新品种“涌金”[J].林业科学,2010,46(8):181.
[2]连芳青,熊伟,张露.樟树茎段离体培养和植株再生[J].江西林业科技,1992(3):20-21.
[3]李乾振,吴丽君,陈碧华,等.芳樟工厂化育苗技术研究[J].福建林业科技,2001,28(4):21-24.
[4]张梅坤,刘荣忠,曾陆三.纯种芳樟的组织培养技术[J].中国花卉园艺,2003(10):25.
[5]彭东辉.脑樟组织培养技术研究[J].福建林学院学报,2005,25(4):313-317.
[6]王长宪,刘静,黄艳艳,等.山东抗寒香樟组培快繁体系的建立[J].山东农业大学学报:自然科学版,2006,37(4):513-516.
[7]吴幼媚,王以红,蔡铃,等.香樟优良无性系快繁技术的研究[J].广西农业生物科学,2006,25(1):60-64.
[8]辜夕容,黄建国,杨庆.香樟离体培养体系的构建初探[J].中国农学通报,2005,21(5):97-100.
[9]武芸.香樟愈伤组织的诱导和改良[J].湖北民族学院学报:自然科学版,2010,28(2):216-218.
[10]辛全伟.香樟优良无性系的繁殖技术研究[D].福州:福建农林大学,2010.
[11]郑红建.香樟组培快繁技术研究[J].林业科技开发,2012,26(1):103-105.
[12]唐国涛,张汉永,朱昔娇.樟树组织培养试验[J].福建林业科技,2013,40(6):70-72.
[13]索长江,蔡斌华.香樟丛生芽的诱导和快速繁殖研究[J].林业科技开发,1997(3):29-30.
[14]田华英.香樟组培快繁和再生体系的建立及植物表达载体pCAMB1A2300-ACA的构建[D].曲阜:曲阜师范大学,2011.
[15]杜丽.香樟体胚发生途径的植株再生体系的建立以及农杆菌介导遗传转化的初步研究[D].武汉:华中农业大学,2005.
[16]周立刚,程必强,喻学俭.细毛樟愈伤组织培养[J].广西植物,1998,18(4):347-350.
[17]Chunhua-Li,Ban-liang huang,Toshio murashige.A micropropagation protocol for cinnamomum camphpra[J].In vitro Cellular & Developmental Biology-Plant,1998(34):141-146.
[18]吴金寿,胡又厘,林顺权,等.芳樟离体快繁与离体保存试管苗再生植株培养[J].福建农林大学学报:自然科学版,2005,34(1):46-50.
[19]龚峥,周丽华,张卫华.樟树组织培养快繁育苗技术研究[J].广东林业科技,2007,23(5):35-39.
[20]欧景华.香樟组织培养快繁技术研究[J].内蒙古林业调查,2012,35(5):44-45.
[21]K.Nirmal Babu,A.Sajina,D.Minoo,et al.Micropropagation of camphor tree (Cinnamomum camphora)[J].Plant Cell,Tissue and Organ Culture,2003(74):179-183.
[22]邹辉,陈永快,王伟英.香樟组培快繁技术研究进展[J].福建农业科技,2009(1):71-72.
Study on Tissue Culture and Plant Regeneration ofCinnamomumcaphora
ZHANG Chun-fang1,WANG Jian-jun2,HE Yue-qiu1
(1.NingboCityCollegeofVocationalTechnology,Ningbo315100,Zhejiang,China; 2.BreedingCenterofSpecialtyForestSeedlings,NingboForestryBureau,Ningbo315012,Zhejiang,China)
A micropropagation protocol was developed forCinnamomumcaphorausing as initial explant nodal segments from newly emerged laterals of trees.The results showed that bud inducement was initiated on a MS medium containing 0.5 mg·L-16-BA and 0.07 mg·L-1IBA.The inducement rate of valid buds reached to 100%.The shoots were subcultured and multiplied on an improved MS medium containing 0.5 mg·L-16-BA and 0.05 mg·L-1NAA and the effective bud per shoot was 5.2.Harvested shoots were rooted in vitro in 1/2 MS supplemented with 0.05 mg·L-1IBA for 30 days and the rooting rate was 100%.The survival rate was 90% when the rooting shoots were moved to the greenhouse.
Cinnamomumcaphora;nodal segments;tissue culture;plant regeneration
2014-12-11;
2015-02-25
宁波市林业科技项目(2011L05);浙江省宁波市科技局农业攻关项目(2007C10009)
张椿芳(1977—),女,贵州石阡人,宁波城市职业技术学院讲师,从事植物组织培养研究。E-mail:zhangchunfang@nbcc.cn。
何月秋。E-mail:heyueqiu@nbcc.cn。
10.13428/j.cnki.fjlk.2015.04.028
S723.1+32.6
A
1002-7351(2015)04-0128-05

