双层SiO2包覆Fe3O4复合材料的制备及其染料吸附性能
刘云芳 任 森 吴日良 李阳阳 石向辉 迟伟东,2 黄启谷
(1北京化工大学化工资源有效利用国家重点实验室,北京 100029)
(2北京化工大学碳纤维及功能高分子教育部重点实验室,北京 100029)
随着纳米材料的快速发展,磁性纳米复合材料作为一类重要纳米材料由于具有许多优异的性能,得到了广泛的关注,已成为相关领域的研究热点[1]。纳米Fe3O4作为典型的磁性纳米材料由于具有价格低、容易生产、毒性低、磁性可控、超顺磁等特点而备受关注,并常作为磁核来制备磁性复合材料,应用于众多领域[2-3]。
纳米Fe3O4及其复合材料具有超顺磁性特性,能够在外加磁场作用下快速的从液体中分离出来,因此它们在许多领域的应用研究得到广泛的开展[4-7]。Fe3O4表面包覆的复合材料[9-10]在水处理方面的应用研究引起了研究者的兴趣,特别是SiO2包覆Fe3O4复合材料。
本文通过改进的Stober法制备了双层SiO2包覆Fe3O4复合材料,内部SiO2层的致密结构起到稳定和保护Fe3O4纳米颗粒的作用,可以拓宽复合材料的应用范围,而且有利于第二层多孔结构SiO2层的形成;外部SiO2层的多孔结构带来丰富的孔隙和大的比表面积,可以赋予复合材料良好的吸附性能。本文研究了所制备材料的结构和性质,探究其对染料罗丹明B和亚甲基蓝的吸附性能。
1 实验部分
1.1 实验试剂
Fe3O4(wFe: 62.0%~70.0%)、 正 硅 酸 乙 酯 (TEOS,AR)、氨水(28.0%)和罗丹明 B(RhB,AR)购于天津光复精细化工研究所;无水乙醇(AR)、NaOH(AR)、十六烷基三甲基溴化铵(CTAB,CR)和亚甲基蓝(MB,AR)购于天津市福晨化学试剂厂;去离子水自制。
1.2 材料合成
采用改进的Stober法制备SiO2包覆Fe3O4复合材料,具体过程如下:首先,在 Fe3O4(0.5 g)中加入200 mL乙醇,并超声处理15 min。然后,加入100 mL水和0.2 mL氨水,搅拌均匀。接着,在30℃搅拌条件下,以1 mL·min-1的速度将溶有0.3 mL TEOS的乙醇溶液(25 mL)加入上述溶液,反应6 h,得到单层SiO2包覆Fe3O4复合材料(Fe3O4@n SiO2),所得产物用水和乙醇清洗数次,直到溶液呈中性,将所得Fe3O4@n SiO2超声分散于200 mL乙醇中,并加入溶有0.3 g CTAB的乙醇/水混合液(30 mL)中。在30℃条件下,加入0.3 mL氨水和70 mL水,然后以0.5 mL·min-1的速率滴加混有 1.5mL TEOS 的乙醇溶液(20 mL),在搅拌的条件下反应4 h,所得产物用水和无水乙醇清洗数次,在45℃下真空干燥24 h。最后,在N2气氛、550℃条件下煅烧5 h,制得双层SiO2包覆 Fe3O4复合材料(Fe3O4@n SiO2@m SiO2)。合成路线如图1所示。
1.3 吸附实验
为了研究材料的吸附性能,我们选用了罗丹明B(RhB)和亚甲基蓝(MB)作为模型吸附质。实验过程具体如下:首先,量取100 mL特定浓度的染料水溶液;然后,在搅拌条件下加入50 mg吸附剂进行吸附,一定时间后,通过外加磁场将吸附剂从溶液中分离开来;接着,通过紫外可见分光光度计(北京普析通用仪器有限公司TU-1810)分别测定剩余溶液中的 MB(λ=664 nm)以及 RhB(λ=552 nm)的吸光度,计算吸附剂的吸附量q,计算公式如下:

式中:C0和Ct分别为染料(RhB或MB)初始浓度和吸附一定时间后的浓度(mg·L-1);V为染料溶液的体积(L);m为吸附剂的质量(g)。
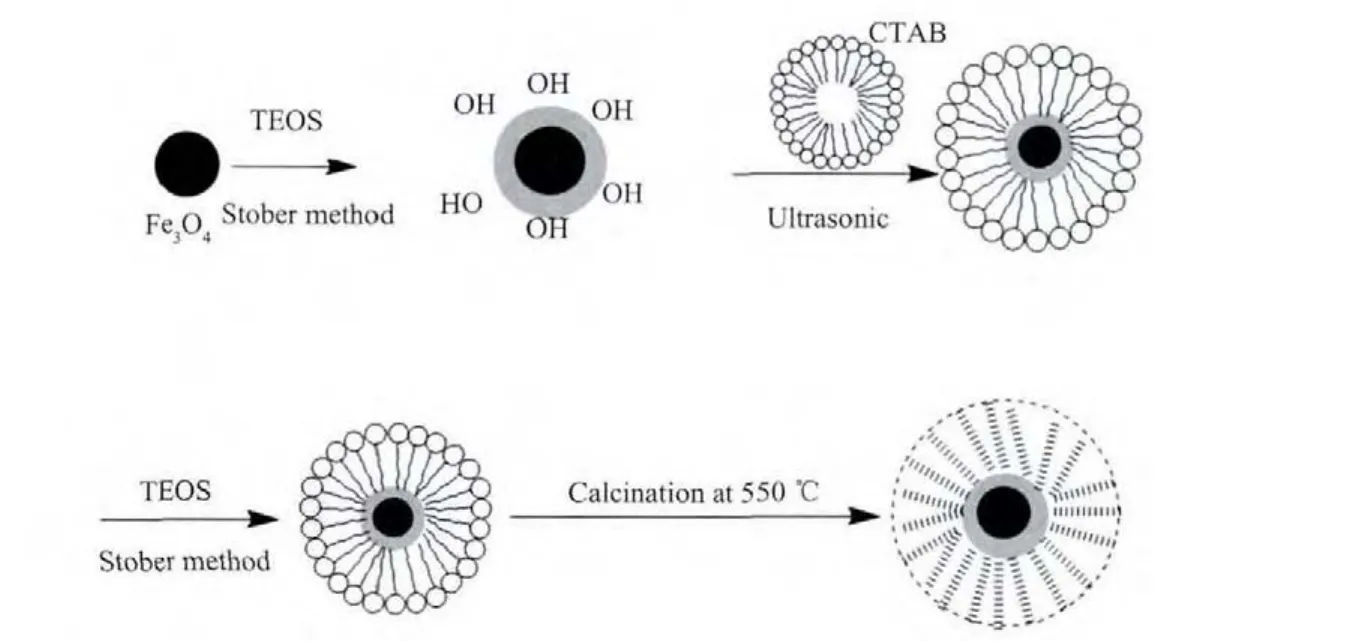
图1 SiO2包覆Fe3O4复合材料的制备流程Fig.1 Preparation diagram of SiO2 encapsulated Fe3O4 composite
1.4 回收实验
为了判断吸附剂从水中分离出来的能力,我们进行了回收率实验,具体如下:首先,将称取好的50 mg吸附剂加入到100 mL的去离子水,并进行分散处理;然后,用磁铁将吸附剂从水中分离出来,放入真空干燥箱(110℃)干燥12 h;最后,称取回收后的吸附剂质量,计算其回收率η,计算公式如 下:

式中:m0和m分别为吸附剂的初始质量和回收后的质量(mg)。
1.5 材料表征
采用日本理学X射线衍射仪(Riguka D/max-2400 型,激发源为 Cu Kα 靶,λ=0.154 18 nm,40 kV,200 mA,石墨单色器,X-射线计数为闪烁计数器)对材料进行物相分析;采用透射电子显微镜(TEM,日立H-800型)分析材料的微观结构和形貌;采用NOVA4200e型比表面及孔隙度分析仪进行N2吸附-脱附实验,通过BET(Brunauer-Emmet-Teller)模型计算样品的比表面积,通过DFT(density functional theory)理论来计算孔径分布;采用振动样品磁强计(美国LakeshOre 7307vsM)测量样品的室温磁滞回线。
2 结果与讨论
2.1 材料的结构分析
图 2 为样品的 XRD 图。 Fe3O4在 18.27°,30.1°,35.4°,43.05°,56.95°,62.51°和 73.95°的衍射峰,与反尖晶石结构的Fe3O4(JCPDS卡片序号03-0863)的数据相一致,没有杂峰,峰强而尖锐。结果表明样品的纯度和结晶度均很高。SiO2样品在2θ为22.96°处有一个宽的衍射峰,其数据与SiO2(JCPDS卡片序号29-0085)的数据相一致,属于无定形结构。Fe3O4@n SiO2和 Fe3O4@n SiO2@m SiO2的图中没有出现明显的SiO2衍射峰。这可能是由于Fe3O4的结晶度高,其衍射峰强度远强于无定形SiO2的衍射峰。图3为样品的TEM照片。所购Fe3O4纳米颗粒的粒径在 10~30 nm 范围内。 图 3(b)和(c)表明,Fe3O4颗粒被SiO2包覆。
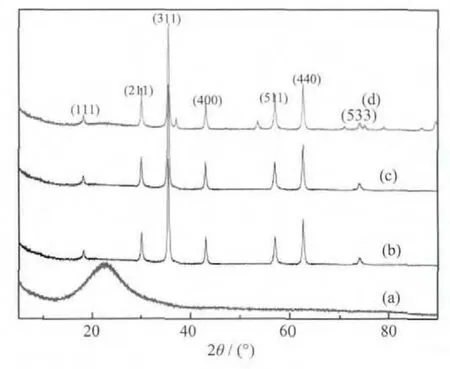
图2 样品的XRD图Fig.2 XRD patterns of SiO2(a),Fe3O4(b),Fe3O4@nSiO2(c),and Fe3O4@n SiO2@m SiO2(d)
图4 所示的复合材料的N2吸附-脱附曲线,出现明显的滞后环[12],这表明材料具有中孔结构。图5的复合材料的孔径分布图显示,Fe3O4@n SiO2孔少,主要为中孔和大孔结构;Fe3O4@n SiO2@m SiO2孔容大,孔结构丰富,主要为微孔和中孔结构。表1列出了两种复合材料的孔结构参数。Fe3O4@n SiO2@m SiO2的比表面积和总孔容分别为 308 m2·g-1和 0.508 cm3·g-1,远大于 Fe3O4@n SiO2的对应值(30 m2·g-1和0.103 cm3·g-1)。 Fe3O4@n SiO2@m SiO2的 微 孔 容 量(0.116 cm3·g-1) 也远远超过 Fe3O4@n SiO2的相应值(0.001 cm3·g-1)。复合材料大孔结构可能是颗粒间的堆积孔隙。图6是样品的磁滞曲线。工业Fe3O4的磁饱和强度 Ms为 67.3 emu·g-1,具有超顺磁性性质,单层 SiO2包覆后 Ms降为 57.2 emu·g-1,双层 SiO2包覆后 Ms为 45.5 emu·g-1。SiO2包覆导致材料中有磁性的Fe3O4含量降低,从而造成Ms有所下降[12]。
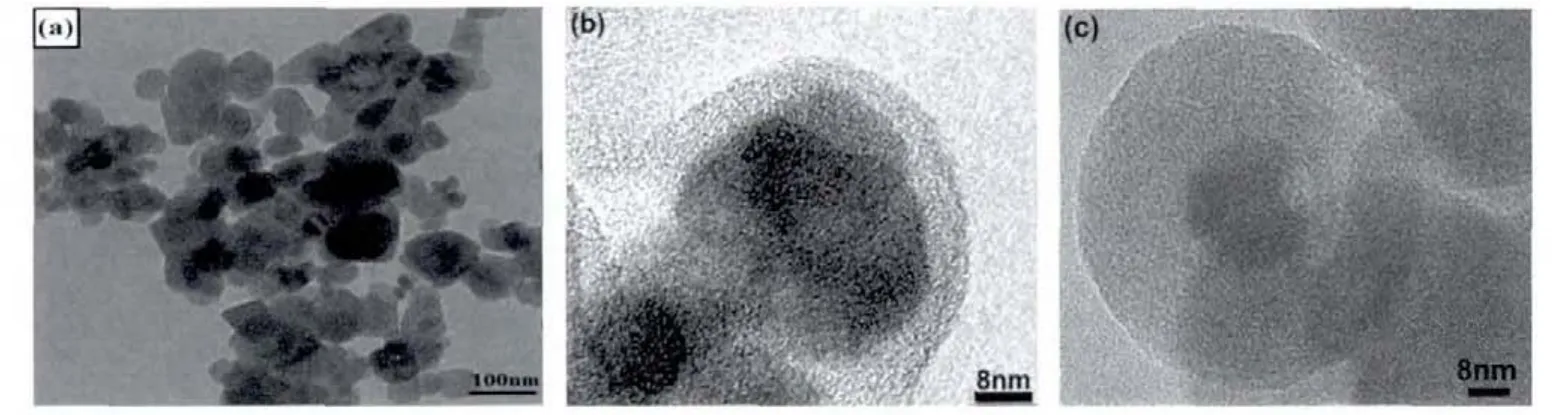
图3 样品的TEM图Fig.3 TEM images of Fe3O4(a),Fe3O4@n SiO2(b),and Fe3O4@n SiO2@m SiO2(c)
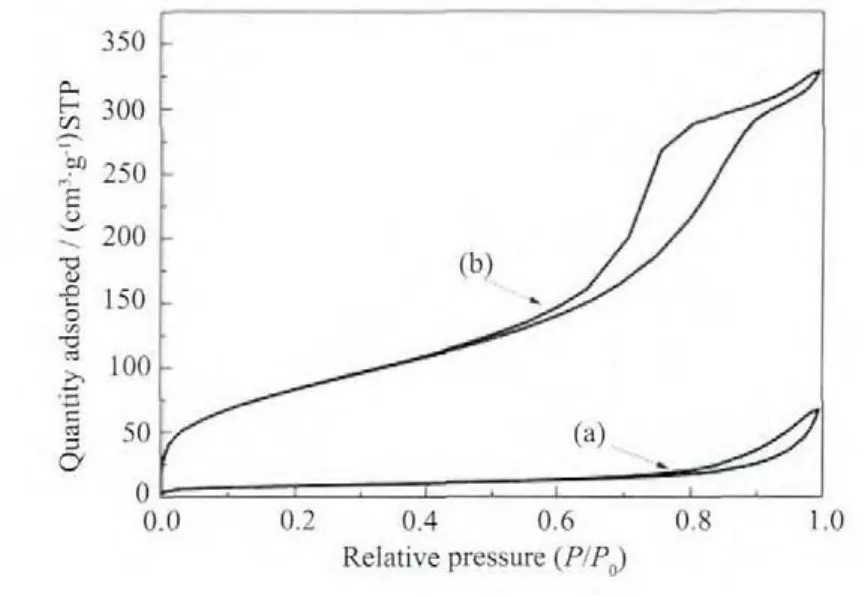
图4 样品的氮气等温吸附曲线Fig.4 Nitrogen sorption isotherm of Fe3O4@n SiO2(a)and Fe3O4@n SiO2@m SiO2(b)
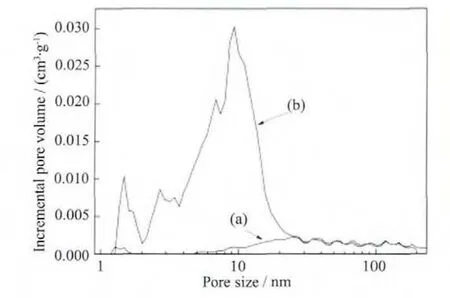
图5 样品的孔径分布图Fig.5 Pore size distributions of Fe3O4@n SiO2(a)and Fe3O4@n SiO2@m SiO2(b)
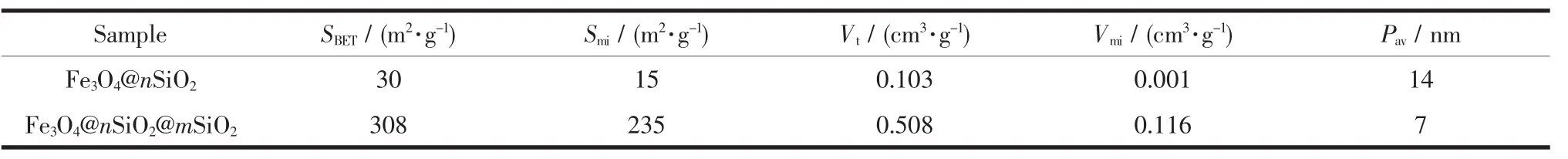
表1 样品的孔结构参数Table 1 Textural properties of Fe3O4@n SiO2 and Fe3O4@n SiO2@m SiO2
图6中的插图清楚地显示,所制备的磁性吸附材料在外磁场作用下很容易从水中分离出来。回收实验结果也清楚地表明,吸附剂基本没有损失,6次结果的平均回收率超过98.7%。
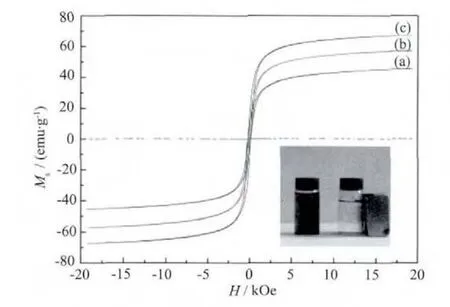
图6 样品的磁滞曲线Fig.6 Magnetization curves of Fe3O4(a),Fe3O4@n SiO2(b),and Fe3O4@n SiO2@m SiO2(c)
2.2 吸附试验
2.2.1 两种材料的吸附性能对比
图7为两种复合材料对染料的等温吸附曲线。吸附量在前期迅速增大,在30 min后,吸附速率减慢,吸附量增加比较缓慢,在120 min后基本达到饱和吸附状态。在前期,复合材料的吸附空位多,因此吸附速率快,随着空位数减少,吸附速率也逐渐降低。此外,随着染料分子浓度的降低,其与吸附剂的接触概率降低,从而也导致吸附速率变慢[13]。Fe3O4@n SiO2@m SiO2对RhB和MB的最大饱和吸附量分别约为 112.4 mg·g-1和 235.1 mg·g-1,远远大于Fe3O4@n SiO2对应的饱和吸附量 (58.1 mg·g-1和105.8 mg·g-1)。 Fe3O4@n SiO2@m SiO2相对大的比表面积和丰富的孔隙结构,是导致两种吸附剂的饱和吸附量存在很大差异的根本原因。由于Fe3O4@n SiO2@m SiO2复合材料具有更强的吸附能力,我们重点对其吸附性能进行深入的研究。图8结果显示,随着染料初始浓度的增大,饱和吸附量也相应地增加:当 RhB浓度从 25 mg·L-1增大到250 mg·L-1时,复合材料对其饱和吸附量从24.0 mg·g-1提高到 112.4 mg·g-1; 当 MB 浓度从25mg·L-1增大到 500 mg·L-1时,对其饱和吸附量从22.0 mg·g-1提高到 235.1 mg·g-1。
2.2.2 pH值对吸附性能的影响
pH值是影响材料吸附过程的重要因素。随着pH值的变化,染料的离子化程度和结构会随之发生变化,从而影响溶液中材料的表面电荷,导致吸附剂表面活性官能团的变化。对Fe3O4@n SiO2@m SiO2,pH值对其影响如下所示[14]:
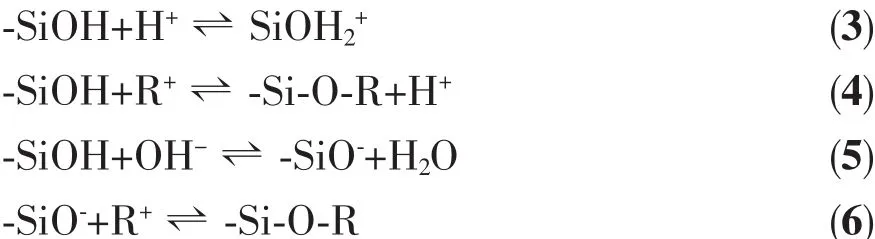
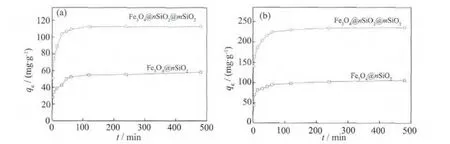
图7 材料对不同染料分子的等温吸附曲线Fig.7 Dye adsorption curves of the composites for RhB(a)and MB(b)(C0(RhB)=250 mg·L-1,C0(MB)=500 mg·L-1)
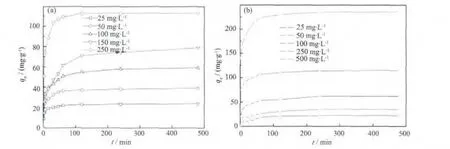
图8 吸附剂对不同染料分子浓度吸附曲线Fig.8 Adsorption curves of Fe3O4@n SiO2@m SiO2 for RhB(a)and MB(b)with different concentration
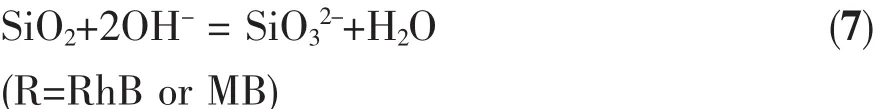
在碱性条件下,SiO2会和OH-发生反应生成SiO32-而逐渐溶解,因此只考虑pH<7的条件下吸附量的变化。图9显示复合材料在不同pH值条件下对染料的饱和吸附量。对于RhB,随着pH值的增加,饱和吸附量不断增加。这是因为pH值的提高抑制了罗丹明B分子中羧基H的电离,所以导致饱和吸附量随着pH值增大而增大;对于MB,饱和吸附量变化不明显。这是因为MB形成的阳离子在酸性条件下受溶液中的H+的变化影响小,所以pH值对于MB的吸附影响不大。
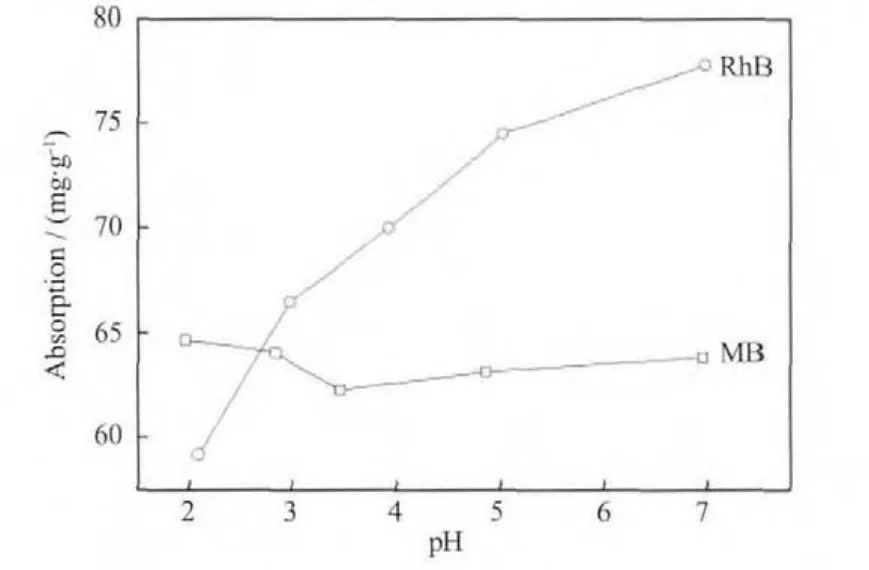
图9 pH值对Fe3O4@n SiO2@m SiO2饱和吸附量的影响Fig.9 Effect of pH value on saturation absorption capacity of Fe3O4@n SiO2@m SiO2(C0(RhB)=50 mg·L-1,C0(MB)=100 mg·L-1)
2.2.3 温度对吸附性能的影响
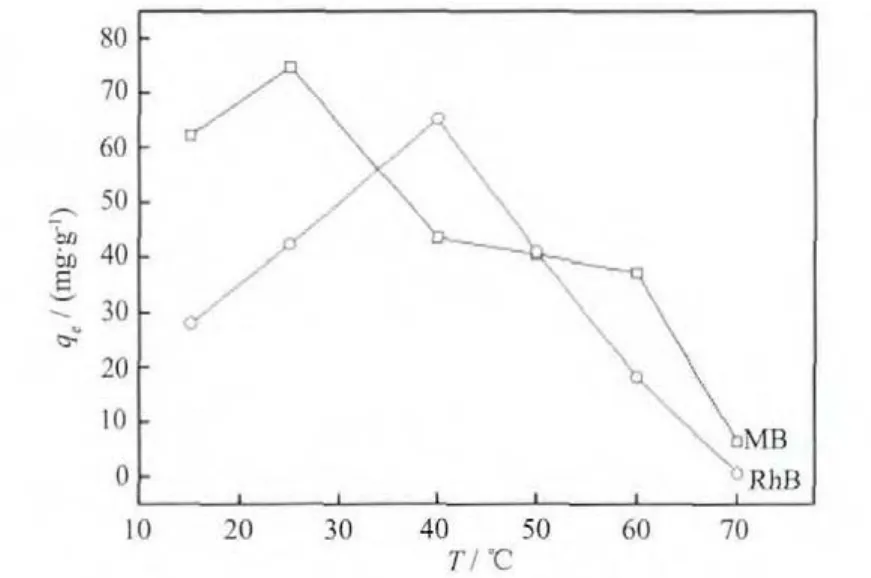
图10 温度对Fe3O4@n SiO2@m SiO2饱和吸附量的影响Fig.10 Effect of temperature on saturation absorption capacity of Fe3O4@n SiO2@m SiO2(C0(RhB)=50 mg·L-1,C0(MB)=100 mg·L-1)
图10 显示了温度对染料分子饱和吸附量的影响。随着温度的升高,饱和吸附量呈现先增大后降低的现象,对于RhB染料,饱和吸附量在40℃达到最大值(65.0 mg·g-1),对于MB染料,在25℃达到最大值(74.7 mg·g-1)。Fe3O4@n SiO2@m SiO2对于染料的吸附有物理吸附和化学吸附。物理吸附速率较快,一般来说是可逆的,存在脱附。吸附是放热过程,温度升高会导致脱附,从而造成饱和吸附量降低。化学吸附则是吸附剂表面与被吸附分子之间形成化学键,需要一定的活化能,速率慢,温度升高有利于化学吸附进行,因此吸附量增大[15]。但是,温度过高则会导致化学键的断裂,导致吸附量降低。此外,温度对溶液粘度和染料分子活性也产生一定的影响[16],在一定温度范围内,随着温度的升高溶液的粘度减小,分子活性提高,运动加剧,与吸附剂的碰撞机会提高,从而有利于吸附作用,引起吸附量增加。这些因素的综合结果呈现为饱和吸附量随温度的升高先增大而后降低。
2.3 再生重复吸附实验
再生可循环使用性是评价吸附剂实际应用价值的重要指标之一。我们对Fe3O4@n SiO2@m SiO2吸附剂进行简单再生后,再进行吸附实验测定饱和吸附值,采用其与首次饱和吸附值的比值来判断其可循环使用性。图11的结果显示,吸附剂第6次的饱和吸附值仍然有首次饱和吸附值的80%左右,表现出较好的可重复使用性。需要指出的是,由于我们只是进行简单的水洗再生,然后干燥后进行下一次吸附试验,所以部分染料并没有脱除干净,对再次吸附有影响。
因此,我们相信,如果采用更好的再生方法,吸附剂的可循环使用性应该会更高。
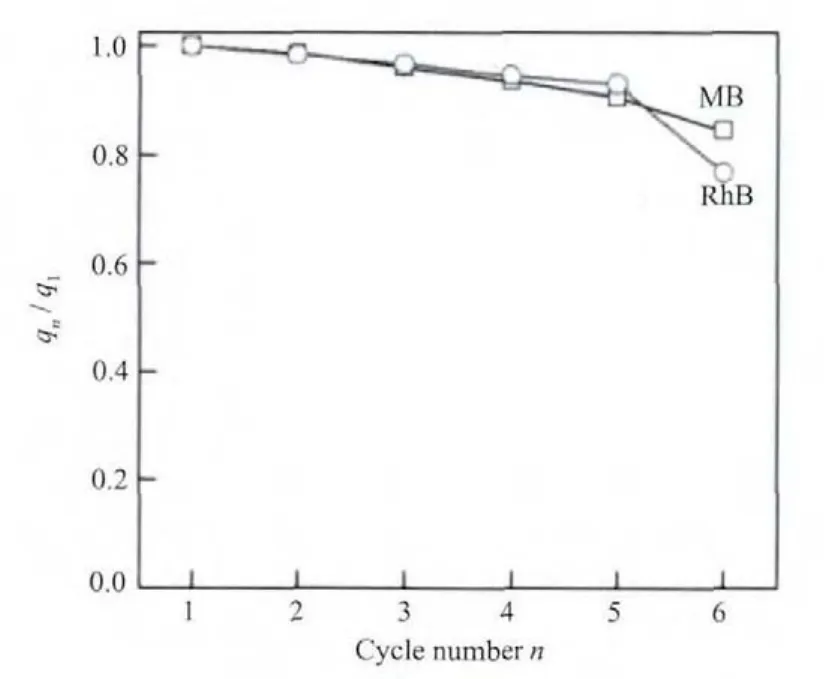
图11 Fe3O4@n SiO2@m SiO22的再生重复吸附Fig.11 Recycle experiment of Fe3O4@n SiO2@m SiO2(C0(RhB)=50 mg·L-1,C0(MB)=100 mg·L-1)
3 结 论
本文通过改进的Stober法合成多孔双层SiO2包覆Fe3O4磁性纳米颗粒Fe3O4@n SiO2@m SiO2。多孔双层包覆结构的Fe3O4@n SiO2@m SiO2比表面积和孔容为 308 m2·g-1和 0.508 cm3·g-1, 远大于单层 SiO2包覆Fe3O4复合材料的对应值,双层包覆后,复合材料的饱和磁化强度仍然有45.5 emu·g-1,在外加磁场作用下非常容易从水中分离出来。当罗丹明B和亚甲基蓝的初始浓度分别为250 mg·L-1和500 mg·L-1时,复合材料Fe3O4@n SiO2@m SiO2对它们的饱和吸附量分别为 112.4 mg·g-1和 235.1 mg·g-1,远高于单层SiO2包覆Fe3O4复合材料。简单再生后的再吸附实验表明,Fe3O4@n SiO2@m SiO2具有较高的可循环使用性。
[1]HAN Shun-Chang(韩顺昌).Dev.Appl.Mater.(材料开发与应用),1998,13(1):36-40
[2]LIAO Zhen-Hua(廖振华),CHEN Jian-Jun(陈建军),YAO Ke-Fu(姚可夫),et al.Chinese J.Inorg.Mater.(无机材料学报),2004,19(4):749-754
[3]Schellenger AEP,Larese-Casanova P.Environ.Sci.Technol.,2013,47(12):6254-6262
[4]LIU Bing-Qiu(刘炳泅),YUAN Wei-Fu(袁维富).Ind.Water Treat.(工业水处理),1991,11:6-9
[5]JIANG Chao-Lan(蒋朝澜),LEI Guo-Yuan(雷国元).Environ.Prot.(环境保护),1993,11:7-10
[6]CHEN Rui-Fu(陈瑞福),ZHOU Chao-Hui(周朝晖).Technol.Water Treat.(水处理技术),1995,21(3):171-174
[7]FENG Lin(冯琳),SONG Yan-Lin(宋延林),WAN Mei-Xiang(万梅香),et al.Chin.Sci.Bull.(科学通报),2001,46(16):1321-1325
[8]Ibrahim A SS,Al-Salamah A A,El-Toni A M,et al.Electron.J.Biotechnol.,2014,17:55-64
[9]Alam S,Anand C,Logudurai R,etal.Microporous Mesoporous Mater.,2009,121:178-184
[10]Gao J,Ran X,Shi C,et al.Nanoscale,2013,5:7026-7033
[11]Peng X,Xu F,Zhang W,et al.Colloids Surf.A,2014,443:27-36
[12]Badruddoza A Z M,Rahman M T,Ghosh S,et al.Carbohydr.Polym.,2013,95:449-457
[13]Fang Y,Chen Y,Li X,et al.J.Mol.Catal.A:Chem.,2014,392:16-21
[14]Hu J,Huang S,Huang X,et al.Microporous Mesoporous Mater.,2014,197:180-184
[15]Ghorai S,Sarkar A K,Panda A B,et al.Bioresour.Technol.,2013,144:485-491
[16]CHEN Rong(陈荣).Chemistry(化学通报),1963,16:18-25