慢性温和应激后老年大鼠抑郁症状及HSP70的变化
钟静玫 郭 强 陈 辉 赵乃伟 赵 忠 (云南省第一人民医院临床心理科,云南 昆明 650032)
抑郁症是常见多发病,而老年期的抑郁症发病率尤高,达到36.8%〔1〕。抑郁症发病机制目前尚未完全清楚,目前有观点认为心理应激与抑郁易损基因的相互作用,导致的氧化应激、神经细胞凋亡、神经可塑性改变与抑郁症有关〔2〕。老年期存在应激应答能力、抗氧化、抗凋亡能力及神经重塑能力的改变〔3〕。而热休克蛋白70(HSP70)是一种应激应答蛋白,具有抗氧化、抗凋亡,增加神经元可塑性的作用〔2〕。本研究旨在了解老年大鼠在慢性温和应激的作用下,HSP70水平的改变及其对抑郁症状的影响。
1 资料与方法
1.1 动物与分组 老年期大鼠为SPF16月鼠龄SD雄性大鼠12只,体重460~575 g,按体重随机分为两组,各6只一组接受Western印迹和RT-PCR检测,另一组接受免疫组化检测;对照组为SPF标准3月鼠龄的SD雄性大鼠12只,体重180~220 g,按体重随机分为两组,各6织一组接受Western印迹和RT-PCR检测,另一组接受免疫组化检测。大鼠购自四川省简阳达硕动物科技有限公司,动物合格证号0023237,许可证号:SCXKL 11122008-74。适应性喂养1 w,鼠舍温度(21±1)℃,湿度40% ~60%,12 h光照与黑暗循环,早8点亮灯,20点熄灯,能够自由地接近食物与水,一鼠一笼。适应性喂养第4、5天,给予每笼1%蔗糖水。第6、7天,给予每笼1%蔗糖水和纯净水各一瓶。第8天开始进行慢性温和应激,应激前后分别进行抑郁症状行为学检测。行为学检测完成后,将大鼠用无巴比妥(60 mg/kg)麻醉。对进行Western印迹、RT-PCR检测的大鼠断颈取脑,分别取出大鼠海马与额叶,经液氮固定后放置于-80℃冰箱冻存备用。对进行免疫组化的大鼠,采用4%的多聚甲醛内固定,剥取全脑后用4%的多聚甲醛外固定。外固定后48 h,经梯度脱水,石蜡包埋,行冠状切片,片厚5 μm。
1.2 抑郁症状行为学检测 ①糖水偏好实验:第8天8点开始禁饮禁食24 h,次日8点每笼给予1%蔗糖水和纯净水各一瓶,喂养1 h。喂养前后分别将1%蔗糖水和纯净水称重,前后水量的差值为消耗量,计算出1%蔗糖水在总消耗量中的百分比,为糖水偏好程度。于3 w慢性温和应激的最后1 d 8点禁饮禁食24 h,次日8点再次进行糖水偏好实验,检测糖水偏好程度。首次糖水偏好程度减去末次糖水偏好程度,为糖水偏好程度下降值。②敞箱实验:糖水偏好实验后进行敞箱实验。将每只大鼠放入敞箱中央格,开始计时2 min,分别计数垂直运动指数、水平运动指数、中央格停留时间。垂直运动指数为前腿抬离地面的次数;水平运动指数为四肢离开1个正方形小格的次数;中央格停留时间为从计时到四肢离开中央格的时间。
1.3 慢性温和应激 慢性温和应激的内容包括:禁饮禁食24 h(8∶00 ~ 次日 8∶00),限制 1 h(8∶00 ~9∶00),旋转鼠笼30 min(8∶00 ~8∶30),鼠笼倾斜12 h(8∶00 ~20∶00),同性入侵24 h(8∶00 ~ 次日8∶00),湿笼12 h(8∶00 ~20∶00),昼颠倒12 h(8∶00 ~20∶00),夜颠倒12 h(20∶00 ~8∶00)。每周随机安排每天的慢性温和应激内容,持续3 w。
1.4 Western印迹 首先进行蛋白的提取,将少量组织块置于匀浆器中,加400 μl单去污剂裂解液裂(含 PMSF)于匀浆器中,重复碾压组织尽量碾碎,裂解30 min后将裂解液移至1.5 ml离心管中,然后在4℃下12000 r/min离心5 min,取上清分装于0.5 ml离心管中并置于-20℃保存。然后进行蛋白定量。随后进行SDS-PAGE电泳,配10%分离胶,加入 TEMED后立即摇匀即可灌胶;配4%的浓缩胶,加入TEMED后立即摇匀即可灌胶;计算含20 μg蛋白的溶液体积即为上样量;取出上样样品至200 μl的EP管中,加入5×SDS上样缓冲液至终浓度为1倍。将样品置于热变性装置中5 min使蛋白变性;加足够的电泳液后开始上样;电泳45 min。转膜至PVDF膜上75 min。10%脱脂奶封膜,4℃过夜。TPBS洗膜,标一抗,抗HSP70单克隆抗体及抗β-actin(Cruz Co.)。TPBS洗膜,标二抗。再洗膜,最后化学发光,显影,定影。以HSP70与β-actin条带光密度的比值表示HSP70蛋白的相对水平。
1.5 RT-PCR 将组织剪碎,液氮研磨后,Trizol法提取总RNA,并经完整浓度、纯度测定,符合实验室要求。根据Gen-Bank中HSP70与β-actin mRNA序列设计特异性引物,由上海生工生物工程技术服务有限公司合成。HSP70正义引物为5'-GCTGGTGAGCCACTTCGTG-3',反义引物为 5 '-TGGATCTGCGCCTTGTCC-3',扩增产物为288 bp。β-actin 正义引物为5'-CACTGCCGCATCCTCTTCCTC-3 ',反 义 引 物 为 5 '-CTCCTGCTTGCTGATCCACAT-3',β-actin PCR扩增产物为400 bp。PCR反应体系为:5 μl cDNA,14.5 μl 2 × Taq PCR MasterMix,3.5 μl H2O,上下游引物各1 μl。HSP70反应条件:94℃预变性2 min;94℃3min;56℃ 30 s,72℃ 45 s,29 个循环;72℃延伸10 min。β-actin反应条件:94℃预变性5 min;94℃ 30 S;59℃ 1 min,72℃ 1 min,28个循环;72℃延伸10 min。PCR产物由2%的琼脂糖凝胶进行电泳,以 HSP70与 β-actin条带光密度的比值表示HSP70 mRNA的相对表达量。
1.6 免疫组化 石蜡切片常规脱蜡;微波抗原修复20 min;滴加山羊血清,室温下15 min;滴加兔抗鼠HSP70单克隆抗体(浓度1∶100,Santa Cruz Co.),4℃过夜;以非免疫血清代替一抗作为阴性对照,用DAKO公司的EnVisionTM法检测12例组织标本,按说明操作,DAB显色。免疫组化结果判断:以细胞质(或细胞核/细胞膜,根据每个抗体不同)中出现棕黄色颗粒为染色阳性,分别在至少有5个代表性的高倍视野计数500个细胞中的阳性细胞数。染色结果综合染色强度及阳性细胞数量两个方面进行半定量分析,分别评分。染色强度:阴性(0分),浅黄色(1分),棕黄色(2分),棕褐色3分;阳性细胞数计分:无着色细胞为0分,阳性细胞数占5% ~25%为1分,26% ~50%为2分,51% ~75%为3分,76%以上为4分。根据两项结果相加分数判断结果:0~1分(-),2~3分(+),4~5分(),6~7分()。
1.7 统计学方法 采用SPSS13.0软件进行t及χ2检验。
2 结果
2.1 慢性温和应激前后行为学检测 老年组大鼠糖水偏好程度的下降明显大于青年组;老年组垂直运动指数、水平运动指数、中央格停留时间均低于青年组(P<0.05)。见表1。
表1 慢性温和应激前后行为学指标比较(±s,n=6)
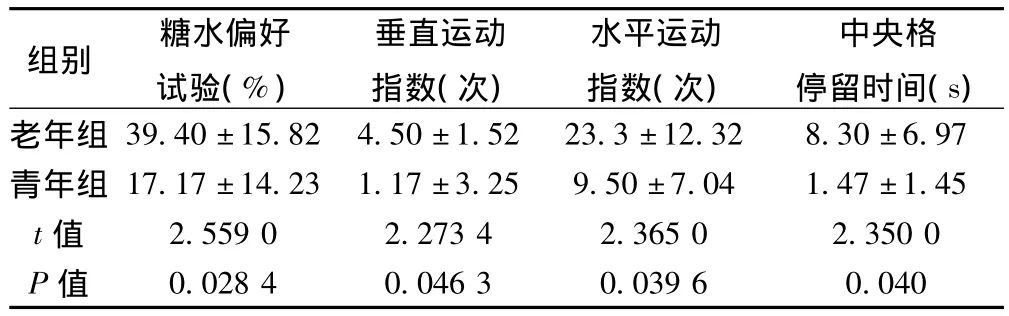
表1 慢性温和应激前后行为学指标比较(±s,n=6)
组别 糖水偏好试验(%)垂直运动指数(次)水平运动指数(次)中央格停留时间(s)39.40±15.824.50±1.5223.3±12.328.30±6.97青年组 17.17±14.231.17±3.259.50±7.041.47±1.45 t值 2.5590 2.2734 2.3650 2.3500 P值老年组0.0284 0.0463 0.0396 0.040
2.2 Western印迹检测 HSP70 在海马与额叶,老年组的HSP70水平也明显低于青年组(P<0.05),见表2,图1。
表2 Western印迹检测HSP70表达结果比较(±s,n=6)

表2 Western印迹检测HSP70表达结果比较(±s,n=6)
组别 海马组 额叶组老年组0.75±0.080.51±0.08青年组 0.89±0.060.72±0.16 t/P值3.4293/0.0064 2.8755/0.0165
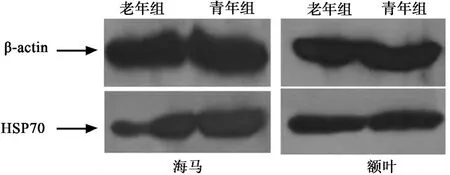
图1 两组间HSP70的Western印迹检测对比
2.3 RT-PCR检测HSP70 mRNA表达 在海马与额叶,老年组的HSP70水平也明显低于青年组(P<0.05)。见表3,图2。
2.4 免疫组化检测HSP70蛋白表达 在海马与额叶,HSP70染色呈+及以下的,老年组明显高于青年组,而及以上的,老年组明显低于青年组(P<0.05)。见表4,图3。
表3 HSP70 RT-PCR结果比较(±s,n=6)

表3 HSP70 RT-PCR结果比较(±s,n=6)
组别 海马组 额叶组老年组0.93±0.020.88±0.08青年组 1.05±0.051.08±0.09 t/P值5.4583/0.0003 4.0684/0.0023
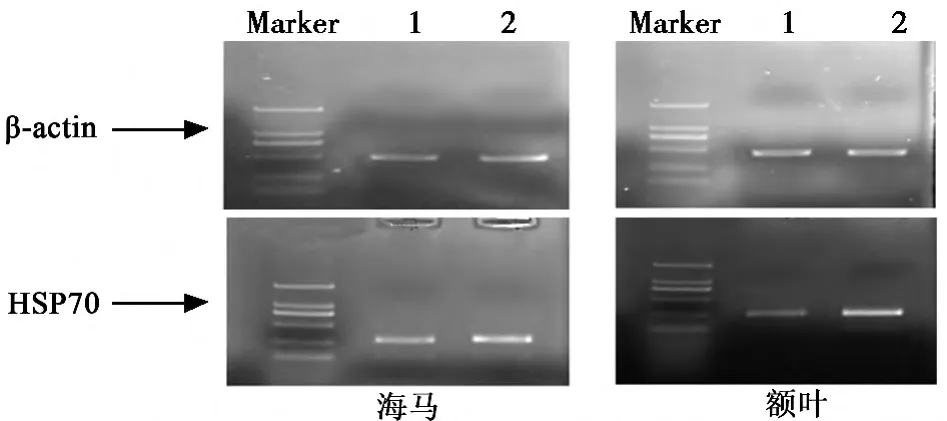
图2 HSP70 mRNA RT-PCR结果比较
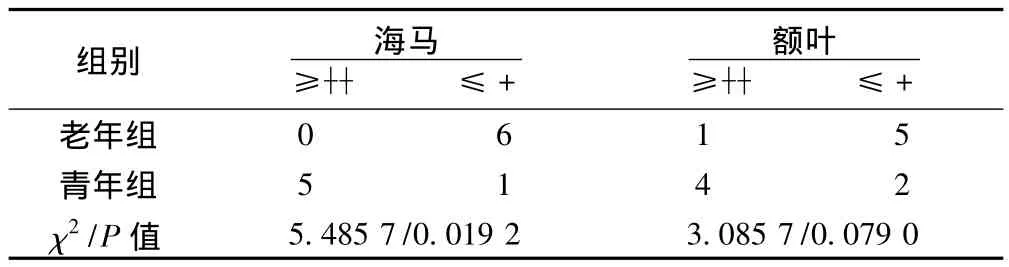
表4 免疫组化检测HSP70蛋白表达比较(n=6,n)
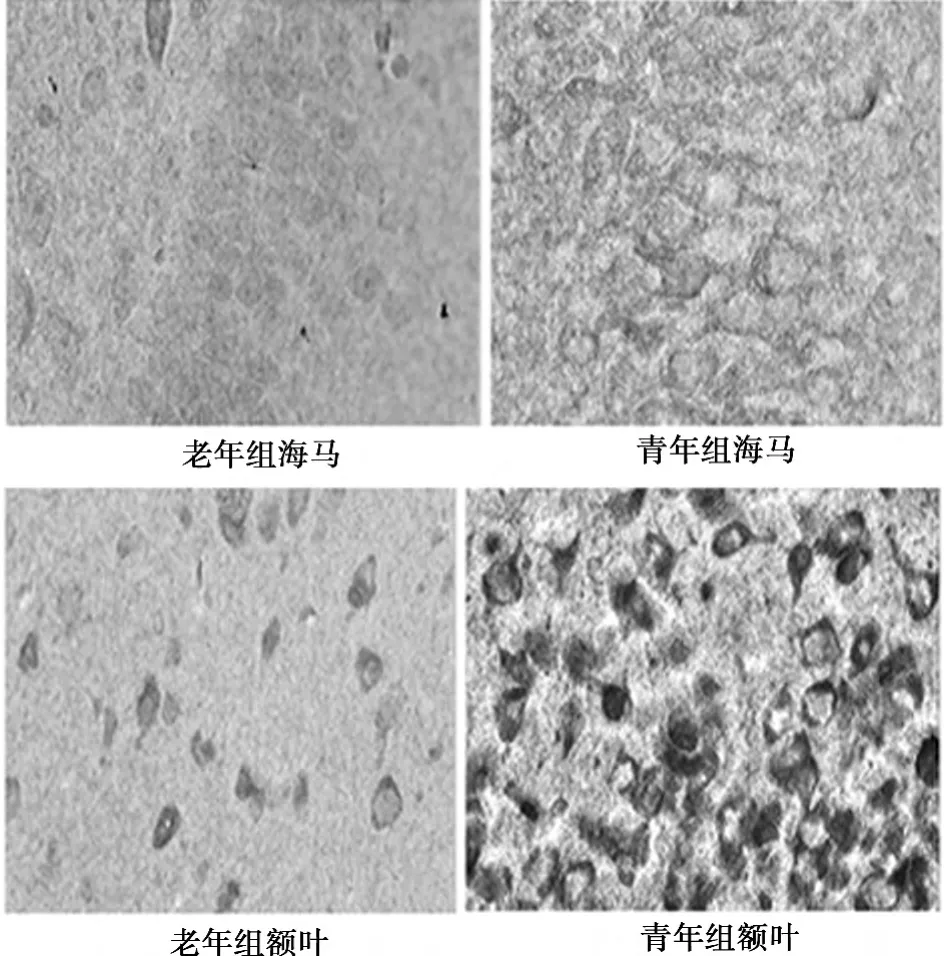
图3 免疫组化法检测HSP70蛋白表达(DAB,×10)
3 讨论
抑郁症通常表现为以情绪低落为核心症状,并表现出兴趣低下,活动减少,饮食睡眠等改变,可伴有植物神经症状,持续2 w以上,反复发作的精神疾病由于本病对工作、生活、人际关系有明显的影响,甚至会导致绝望、自杀,危害严重〔4〕。本研究借助慢性温和应激来构建鼠的抑郁症模型〔5〕。通过随后的糖水偏好实验、敞箱实验、强迫游泳实验对鼠的抑郁症状进行观察、评价、量化、记录。动物在实验中表现出来的糖水偏好减少,运动减少,甚至不动,分别与抑郁中的兴趣低下,活动减少,绝望等症状相对应。一系列研究显示抑郁症中也存在氧化应激、神经细胞凋亡、神经可塑性改变等病理生理过程〔2〕。老年期的抑郁症发病率高达到36.8%〔1〕,这可能与老年期应激应答能力、抗氧化、抗凋亡能力以及神经重塑能力衰退有关〔3〕。而HSP70作为抗氧化、抗凋亡的蛋白,且参与脑源性神经生长因子(BDNF)介导的神经营养作用〔2〕,与抑郁症和老年期脑改变均有关联,所以本研究的目的就是要了解慢性温和应激中HSP70的反应能力,是否会因为老龄而下降。本研究说明老年期大鼠在应激状态下更容易出现抑郁症状,而且HSP70在老年期的脑组织中反应能力也降低。虽然HSP70是应激状态下多种细胞内都会产生的,对细胞产生保护作用的蛋白质家族成员之一,它可以与伴侣蛋白质51 kD FK506结合蛋白协作,负反馈调节糖皮质激素受体(GR)活性〔6〕;也可以通过抑制一氧化氮合酶(NOS)和活性氧(ROS)的活性,而产生抗氧化〔7〕;还可通过与凋亡信号调节激酶(ASK1)结合,阻碍 JNK1活性,稳定PKC和Akt,而抑制caspase-3凋亡等多条途径产生抗凋亡的作用〔8〕;而且提高 HSP70的许多物质,如多酚类、原花青素、HDAC抑制剂等,均可提高BDNF水平,有增加神经元的可塑性的作用〔9〕。但是老年期大鼠的研究显示,老年期大鼠海马在无应激刺激的状态下,也存在着应激时才应该出现的皮质酮(CORT)水平增高及星形胶质细胞反应,而且老年期大鼠应激后CORT水平恢复的时间要比正常对照恢复的时间延长〔10〕。老年期大鼠的CORT结合蛋白(CBGs)水降低,糖皮质激素受体兴奋性高,更容易激活Bcl-2,导致凋亡〔11〕。另外老年期的BDNF以及其受体的水平都有一定程度的下降,从而会影响神经的重塑能力〔12〕。这些因素不光会导致老年期抑郁症状更容易出现,还与HSP70降低有关。老年的这种类似应激的持续状态,会导致细胞核与细胞质中的 HSP70水平下降〔13〕,这与HSP70在蛋白水平与RNA水平均降低的表现一致。
1 Ladin K,Daniels N,Kawachi I.Exploring the relationship between absolute and relative position and late-life depression:evidence from 10 European countries〔J〕.Gerontologist,2010;50(1):48-59.
2 钟静玫,郭 强,武绍远,等.抑郁症与氧化应激〔J〕.中华行为医学与脑科学杂志,2011;20(7):665-6.
3 Garrido P.Aging and stress:past hypotheses,present approaches and perspectives〔J〕.Aging Dis,2011;2(1):80-99.
4 Aanhet Rot M,Mathew SJ,Charney DS.Neurobiological mechanisms in major depressive disorder〔J〕.CMAJ,2009;180(3):305-13.
5 Bessa J,Mesquita A,Oliveira M,et al.A Trans-dimensional approach to the behavioral aspects of depression〔J〕.Front Behav Neurosci,2009;3(1):1.
6 Hunsberger J,Austin D,Chen G,et al.Cellular mechanisms underlying affective resiliency:the role of glucocorticoid receptor-and mitochondrially-mediated plasticity〔J〕.Brain Res,2009;1293(10):76-84.
7 Zhang K,Zhao T,Huang X,et al.Preinduction of HSP70 promotes hypoxic tolerance and facilitates acclimatization to acute hypobaric hypoxia in mouse brain〔J〕.Cell Stress Chaperones,2009;14(4):407-15.
8 Hwang J,Zhang C,Patterson C.C-terminus of heat shock protein 70-interacting protein facilitates degradation of apoptosis signal-regulating kinase 1 and inhibits apoptosis signal-regulating kinase 1-dependent apoptosis〔J〕.Cell Stress Chaperones,2005;10(2):147-56.
9 Abel T,Zukin R.Epigenetic targets of HDAC inhibition in neurodegenerative and psychiatric disorders〔J〕.Curr Opin Pharmacol,2008;8(1):57-64.
10 Sapolsky RM,Krey LC,McEwen BS.The adreno cortical stress-response in the aged male rat:impairment of recovery from stress〔J〕.Exp Gerontol,1983;18(1):55.
11 Du J,Wang Y,Hunter R,et al.Dynamic regulation of mitochondrial function by glucocorticoids〔J〕.Proc Natl Acad Sci USA,2009;106(9):3543.
12 Neto FL,Borges G,Torres-Sanchez S,et al.Neurotrophins role in depression neurobiology:a review of basic and clinical evidence〔J〕.Curr Neuropharmacol,2011;9(4):530-52.
13 Simic I,Mitic MD,Jordjevic J,et al.Chronic stress decreases availability of heat shock proteins to glucocorticoid receptor in response to novel acute stress in Wistar rat hypothalamus〔J〕.Cell Mol Neurobiol,2012;32(4):625-32.

