沉默NGAL基因对肺癌细胞迁移及侵袭的影响
唐健 李捷 李少军 李璟波 于长海 尉承泽
肺癌,又称原发性支气管肺癌,是肺部常见的恶性肿瘤。在全球,肺癌的发病率和死亡率均居癌症之首,而且目前呈现出一种继续上升趋势[1]。NGAL基因的蛋白编码产物是一种25 kDa的糖蛋白,是1993年由Kjeldsen等[2]在中性粒细胞中首先发现,是脂质运载蛋白(Lipocalln)家族的成员之一。肿瘤组织中,如肺癌、结肠癌、肝癌、乳腺癌和胰腺癌等,均能够检测到NGAL基因高表达[3]。这提示NGAL可能与肿瘤的发生和发展有关[3-6]。本研究旨在探讨NGAL在肺癌组织的表达,观察小干扰RNA(siRNA)沉默NGAL基因表达对肺癌细胞增殖及侵袭能力的影响。
1 材料与方法
1.1 一般资料 选择解放军总医院第一附属医院胸外科76例肺癌患者手术切除的肺癌及30例癌旁组织蜡块(2010年5月-2014年4月),所有标本均经多聚甲醛固定,石蜡包埋,5 μm厚连续切片。年龄45岁-72岁,平均年龄62.6岁。
1.2 试剂 高转移的肺癌细胞系A549购自中国科学院,培养基RPMI-1640购自Gbico公司,siRNA oligos购自上海吉玛公司,转染试剂X-tremeGENE(Roche公司),鼠一抗NGAL、GAPDH、MMP-2、MMP-9抗体,兔一抗E-cadherin、Vimentin购自Santa Cruz公司;Alex 594/488标记羊抗兔二抗(Jackson公司),HRP标记的二抗羊抗兔、HRP标记的羊抗鼠(北京中杉金桥公司),TRIzol(Invitrogen公司),反转录试剂盒及定量PCR试剂盒(TAKARA公司);倒置荧光显微镜为Zessis公司、移液器均为Eppendorf公司。免疫组化SP法试剂盒及DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。
1.3 方法
1.3.1 细胞培养 A549细胞用RPMI-1640培养液,含10%胎牛血清、100 U/mL青霉素和0.1 mg/mL链霉素的培养液,置37 ℃,5%CO2条件下培养。
1.3.2 免疫组织化学 60 ℃烤片20 min后,常规二甲苯脱蜡,梯度酒精脱水;3% H2O2室温孵育15 min,PBS冲洗3次(每次不少于5 min);抗原修复后以羊血清工作液封闭,室温孵育30 min加一抗于4 ℃过夜,用与一抗相应的免疫血清IgG代替一抗作为阴性对照; 滴加生物素标记二抗,37 ℃孵育30 min,PBS冲洗后滴加辣根过氧化物酶标记的链霉素卵白素工作液;二氨基联苯胺(DAB)显色,自来水充分冲洗后,苏木素复染,常规脱水,透明,干燥,封片。
1.3.3 免疫荧光 石蜡切片脱蜡,水化5 min后,蒸馏水洗3次,3 min/次;微波抗原修复10 min,冷却至室温;滴加正常山羊血清,室温孵育1 h,封闭抗原非特异性结合位点。滴加一抗兔抗Cadherin(1:1,000),Vimentin(1:1,000)(Santa Cruz公司)4 ℃孵育过夜。PBS洗3次,5 min/次;滴加Alex594/488标记的羊抗兔IgG(1:1,000)二抗,室温孵育1 h。PBS洗3次,5 min/次;滴加DAPI,孵育10 min,用来染细胞核;PBS洗3次,3 min/次;抗荧光淬灭封片剂封片。用与一抗相应的免疫血清IgG代替一抗作为阴性对照。用Zessis荧光显微镜拍照。
1.3.4 转染 按Invitrogen公司提供的脂质体LipofectamineTM2000转染程序进行。将各组siRNA与转染试剂混合物加入各个培养细胞的六孔板,转染24 h后,更换正常培养液进行实验。NGAL干扰序列为5′-ACATCCGGCAGGACAATGA-3′;对照序列为5′-AACGUACGCGGAAUACUUCGA-3′[7]。
1.3.5 qRT-PCR检测A549细胞中NGAL mRNA的表达 分别收集对数生长期的转染及对照组A549细胞,按TRIzol试剂盒说明书提取细胞总RNA,用紫外分光光度计分别测定RNA浓度,根据吸光度(optical delnsity,OD)260和OD280的比值,判定其纯度。分别取5 μg细胞总RNA,按反转录试剂盒说明书反转录成cDNA,以cDNA 为模板应用。反应条件为:94 ℃预热3 min,然后94 ℃ 30 s,52 ℃ 30 s,72 ℃ 50 s,扩增29个循环,72 ℃延伸10 min。PCR产物进行1%琼脂糖凝胶电泳,通过ImageJ图像分析软件分析各电泳条带的灰度值,以目的条带的灰度值与GAPDH内参照条带的灰度值的比值表示各目的基因mRNA的相对表达量。NGAL的上游引物为5′-GAAGACAAAGACCCGCAAAAG-3′,下游引物为5′-CTGGCAACCTGGAACAAAAG-3′。内参GAPDH的上游引物为5′-ACCACAGTCCATGCCATCAC-3′,下游引物为5′-TCCACCACCCTGTTGCTGTA-3′。
1.3.6 蛋白质印迹检测NGAL蛋白的表达 转染24 h后,A549细胞中加入适量RAPI(PMSF)裂解液,碾碎匀浆,离心提取总蛋白,按照BCA法测定总蛋白浓度,上样量为每孔30 μg总蛋白。按1:4加上样缓冲液后,98 ℃变性10 min。100 V恒压电泳,电泳后进行湿式电转。转膜后用5%牛奶封闭液封闭1 h,一抗鼠来源的NGAL、MMP-2、MMP-9、GAPDH,兔来源的E-cadherin、Vimentin用0.05%TBST按1:1,000稀释,4 ℃孵育过夜,0.05%TBST洗3次,每次5 min。二抗为HRP标记的羊抗兔IgG,羊抗鼠IgG(1:1,000),室温孵育1 h,0.05%TBST洗3次,每次5 min。用ECL化学发光法来检测,试验重复3次。
1.3.7 MTT检测A549细胞球的生长抑制率 转染24 h后,取生长良好的A549细胞球消化成细胞悬液,计数并将细胞浓度调整到1×103/孔,接种于96孔板。培养24 h、48 h后,每孔加入10 μL(5 mg/mL)的MTT溶液,孵育4 h后,每孔加入100 μL Formanzan溶液,继续孵育直至显微镜下观察到Formanzan全部溶解。用酶标仪在570 nm处检测各孔OD,空白孔调零。细胞存活率=实验孔/对照孔×100%;细胞生长抑制率=(1-实验组OD值/空白对照组OD值)×100%。
1.3.8 细胞侵袭及迁移实验 用无血清RPMI-1640培养液按1:5稀释Matrigel胶,加人80 μL于Transwell板上室,将Transwell小室置于24孔板中,37 ℃孵育5 h待胶凝固。转染24 h后,将细胞用0.25%胰酶消化,用无血清培养基悬浮并计数。转染NGAL-SiRNA及对照组A549细胞各取200 μL(5×105个/mL)加入上室,加入滤膜直径为8 μm的Transwell小室中。下室加600 μL含有10%FBS的RPMI-1640培养液,细胞继续培养12 h。取出Tanswell上室,PBS洗涤2次,用棉签擦去上表面的细胞,加无水甲醇固定细胞30 min;用0.4%的结晶紫染色液染色2 h。在光学显微镜(×100)下计数穿过基膜的细胞数,每张膜随机选取10个视野,每组设3个重复样品。侵袭率=(实验组侵袭细胞数/对照组侵袭细胞数)×100%。迁移实验只是在Transwell上室不加Matrigel胶,迁移率=(实验组迁移细胞数/对照组迁移细胞数)×100%。
1.3.9 细胞划痕 在24孔板中加入约5×105个细胞,培养24 h后用枪头比着直尺,尽量垂直于背后的横线划痕。用PBS洗细胞3次,加入完全培养基,37 ℃、5%CO2条件下再培养24 h后取样,拍照。实验至少重复3次,取平均值。
1.3.10 统计学方法 采用SPSS 11.0统计软件,数据比较采用t检验。Western blot条带灰密度用ImageJ软件进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化检测NGAL蛋白在肺癌组织中的表达 通过免疫组化检测NGAL在肺癌中的表达,结果发现NGAL在癌旁组织中表达率为13.3%(4/30),而在肺癌组织中NGAL的阳性信号主要定位于胞质(图1),其阳性表达率为76.32%(58/76),明显高于癌旁组织中NGAL的表达水平(P<0.01),提示NGAL与肺癌的发生发展有关系。
2.2 干扰NGAL的效率 A549细胞转染NGAL-siRNA 24 h后,用qRT-PCR和Western blot检测干扰NGAL的效果,发现control-siRNA转染组NGAL mRNA的表达量为1.05±0.09,NGAL-siRNA转染组NGAL mRNA的表达为的0.35±0.08,明显低于对照组,差异有统计学意义(P<0.01,图2A)。与NGAL mRNA表达相一致,NGAL-siRNA转染组NGAL的蛋白表达量较对照组的表达量降低(图2B)。结果提示,NGAL特异性SiRNA从转录和翻译水平高效抑制NGAL表达。
2.3 干扰NGAL抑制A549细胞的增殖 转染后,分别培养24 h、48 h后,用MTT法检测细胞增殖情况,结果发现沉默NGAL后,A549细胞增殖能力与对照组相比,受到明显的抑制。24 h、48 h细胞存活率为64.92%、56.58%;抑制率分别为35.08%、43.42%,与对照组相比,差异均有统计学意义(P<0.05)(图3)。
2.4 干扰NGAL表达抑制A549 细胞的体外迁移和侵袭 应用Transwell小室迁移实验发现在接种细胞24 h后,A549细胞穿过8 μm孔径膜的细胞数,对照组为每视野248.0±16.1,而NGAL-SiRNA组穿过膜的细胞数为每视野190.7±14.6(P<0.05)。Transwell小室侵袭实验检测细胞侵袭能力,在接种细胞24 h后,A549细胞穿过Matrigel胶的细胞数,对照组为每视野152.3±11.4,而NGAL-SiRNA实验组穿过Matrigel胶侵袭的细胞数为74.3±11.9(P<0.01)。细胞划痕实验显示,干扰组的细胞迁移较对照组和空质粒组缓慢,划痕后24 h,对照组细胞迁移明显,而干扰组迁移不明显。A549细胞对照组细胞迁移率为81.05%±4.36%,干扰组为41.33%±5.56%,差异有统计学意义(P<0.05)(图4)。以上结果表明下调NGAL基因的表达后,A549细胞的迁移及侵袭能力明显被抑制。
2.5 干扰NGAL抑制上皮细胞-间质细胞转化(epithelialmesenchymal transition, EMT)相关蛋白E-cadherin和Vimenntin的表达,同时也抑制MMP蛋白的表达 转染后再培养24 h,用免疫荧光及Western blot检测细胞EMT相关蛋白E-cadherin、Vimentin的表达情况。免疫荧光结果显示,干扰NGAL后E-cadherin表达的荧光强度明显强于对照组;而Vimentin的表达强度低于对照组(图5A)。Western blot检测显示,干扰NGAL后A549细胞中E-cadherin蛋白的表达水平明显于高于对照组,为对照组的2.27倍;Vimentin的表达较对照组明显降低,为对照组的0.23倍,差异均有统计学意义(P<0.05)(图5)。干扰NGAL后,用Western blot检测了A549细胞中MMP-2和MMP-9的表达,发现确实能够抑制MMP-2和MMP-9蛋白的表达,分别为对照组的0.37倍和0.26倍,差异均有统计学意义(P<0.05)。
3 讨论
肺癌是全球发病率和死亡率最高的恶性肿瘤之一,近年来其发病率在我国呈上升和年轻化趋势,其发生、发展和转移均涉及极其复杂的多基因调控异常过程[1]。因此,研究肺癌的病因、发病机制具有重要的临床意义。
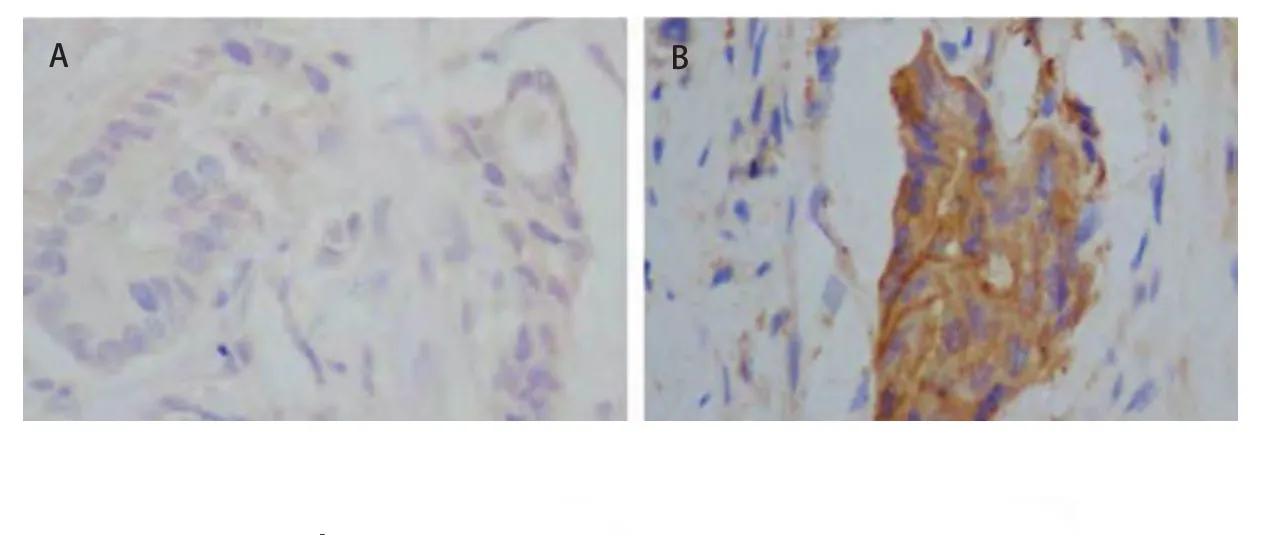
图 1 免疫组织化学检测NGAL在癌旁组织(A)及肺癌(B)组织中的表达(×400)Fig 1 The expression of NGAL in adjacent mucosa (A) and lung cancer (B) was detected by immunochemistry (×400)
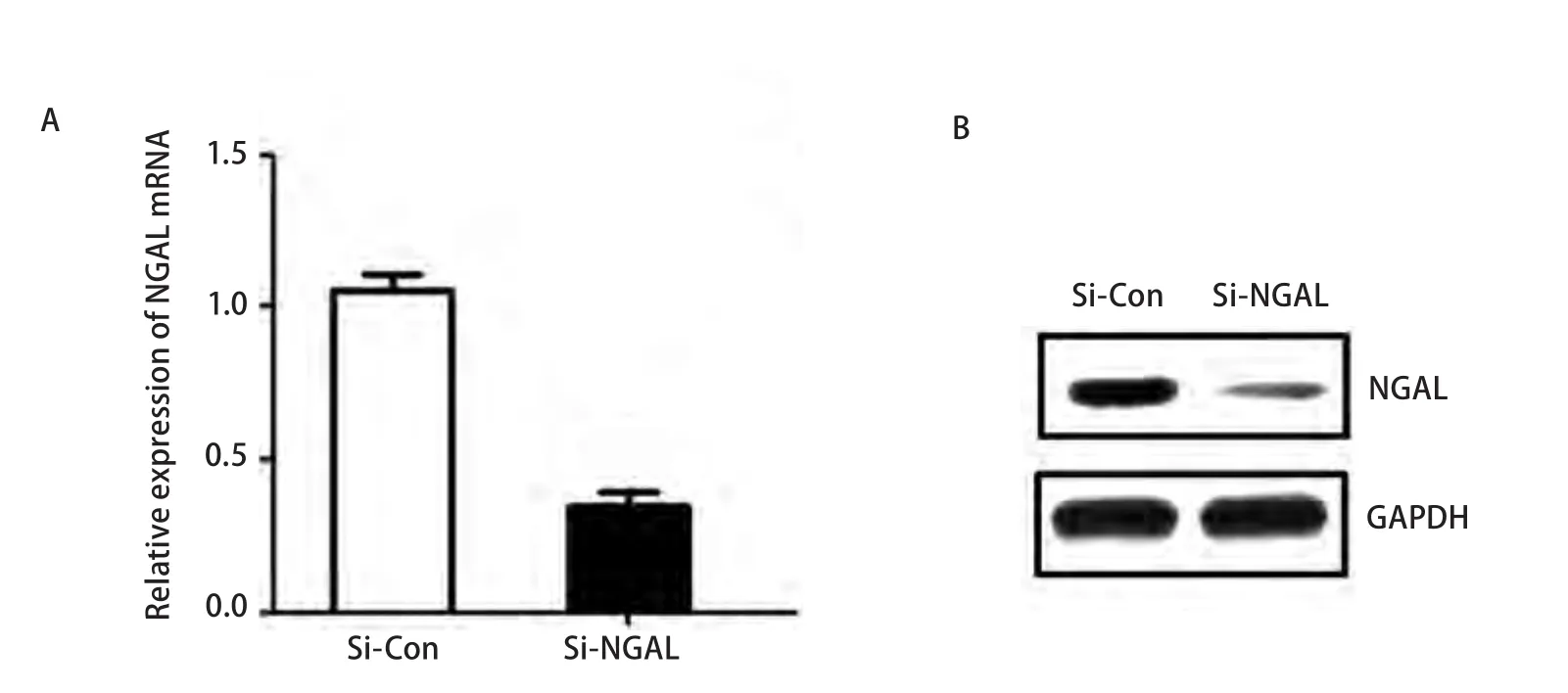
图 2 实时荧光定量PCR及Western blot检测干扰NGAL的表达情况。A:qRT-PCR检测表明NGAL mRNA在NGAL-siRNA转染的A549细胞中的表达明显下调;B:Westem blot检测表明NGAL蛋白在NGAL-siRNA转染的A549细胞中表达水平明显下调。Fig 2 The expression of NGAL mRNA and protein treated with NGAL-SiRNA. A: NGAL mRNA was down-regulated treated with NGAL-SiRNA in A549 cells by qRT-PCR; B: NGAL protein was down-regulated treated with NGAL-SiRNA in A549 cells by Western blot.
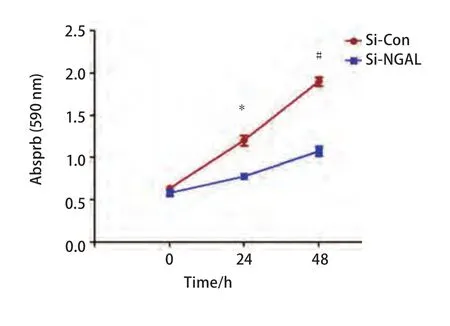
图 3 干扰NGAL后细胞在24 h、48 h的增殖情况。与对照组比较,*P<0.05,#P<0.01。Fig 3 NGAL downregulation reduced cell proliferation treated with NGAL-SiRNA after 24 and 48 h. Compared with control group, *P<0.05, #P<0.01.
NGAL是由Kjeldsen等[2]在1993年在人中性粒细胞中发现的。NGAL是Lipocalin家族成员之一。NGAL是分子量为25 kDa的多肽链,含有178个氨基酸残基,定位于人染色体9q34上,全长5,869 bp。近年来,一些研究提示NGAL在多种肿瘤的发生发展中发挥重要功能,是人类的一种新癌基因。
本研究通过检测NGAL蛋白在肺癌及癌旁组织中的表达发现NGAL在肺癌中阳性表达率远高于癌旁组织,说明NGAL的表达与肺癌发生发展存在一定的关联。已有研究[3,4]发现NGAL高表达肺癌,且于分化程度有关。这与我们报道的结果一致。
有研究发现在肺癌、乳腺癌、卵巢癌和胰腺癌等肿瘤都有NGAL的表达,但没有进一步阐明NGAL在其中究竟发挥着何种作用。为了研究NGAL对肺癌细胞增殖、侵袭迁移能力的影响,本实验通过转染NGAL-SiRNA降低肺癌细胞中NGAL的表达,同时利用MTT、Transwell方法检测抑制NGAL的表达后,肺癌细胞增殖、侵袭迁移能力的变化,结果显示干扰NGAL表达的肺癌细胞增殖能力明显低于对照组;侵袭迁移能力显著降低。我们进一步利用细胞划痕实验发现抑制NGAL的表达后,肺癌细胞的划痕愈合能力明显下调。这些结果都表明NGAL在肺癌细胞的侵袭迁移过程中起着非常重要的作用。许多研究证实在其他癌症中,如乳腺癌、甲状腺癌,干扰NGAL后,能够抑制肿瘤细胞的侵袭迁移,而过表达NGAL后能够增强癌细胞的迁移增殖能力[5,6]。NGAL蛋白的表达水平与肿瘤细胞的S期分数和增殖指数Ki67正相关[7]。提示NGAL不仅与肿瘤发生发展有关,还在肿瘤的浸润和转移中具有一定作用,但其作用机制目前尚未明确。
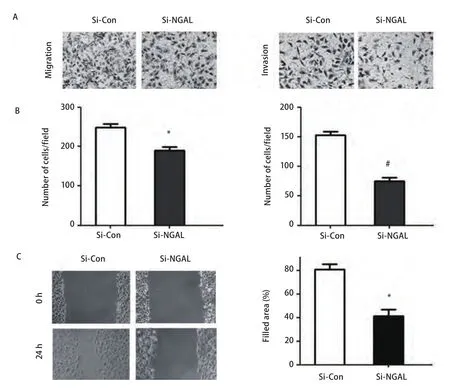
图 4 干扰NGAL后,A549细胞迁移侵袭能力的检测。A:干扰NGAL后,细胞迁移能力的比较(P<0.05);B:干扰NGAL后,细胞侵袭能力的比较;C:干扰NGAL后,对细胞划痕损伤愈合能力的影响。与对照组比较,*P<0.05,#P<0.01。Fig 4 The ability of magration and invasion treated with NGAL-SiRNA or NGAL-Control SiRNA on A549 cells. A: The cell numbers of transwell migration treated with NGAL-SiRNA; B: The ability of invasion treated with NGAL-SiRNA; C: Effect of NGAL-SiRNA transfection on the wound healing ability of A549. Compared with control group, *P<0.05, #P<0.01.
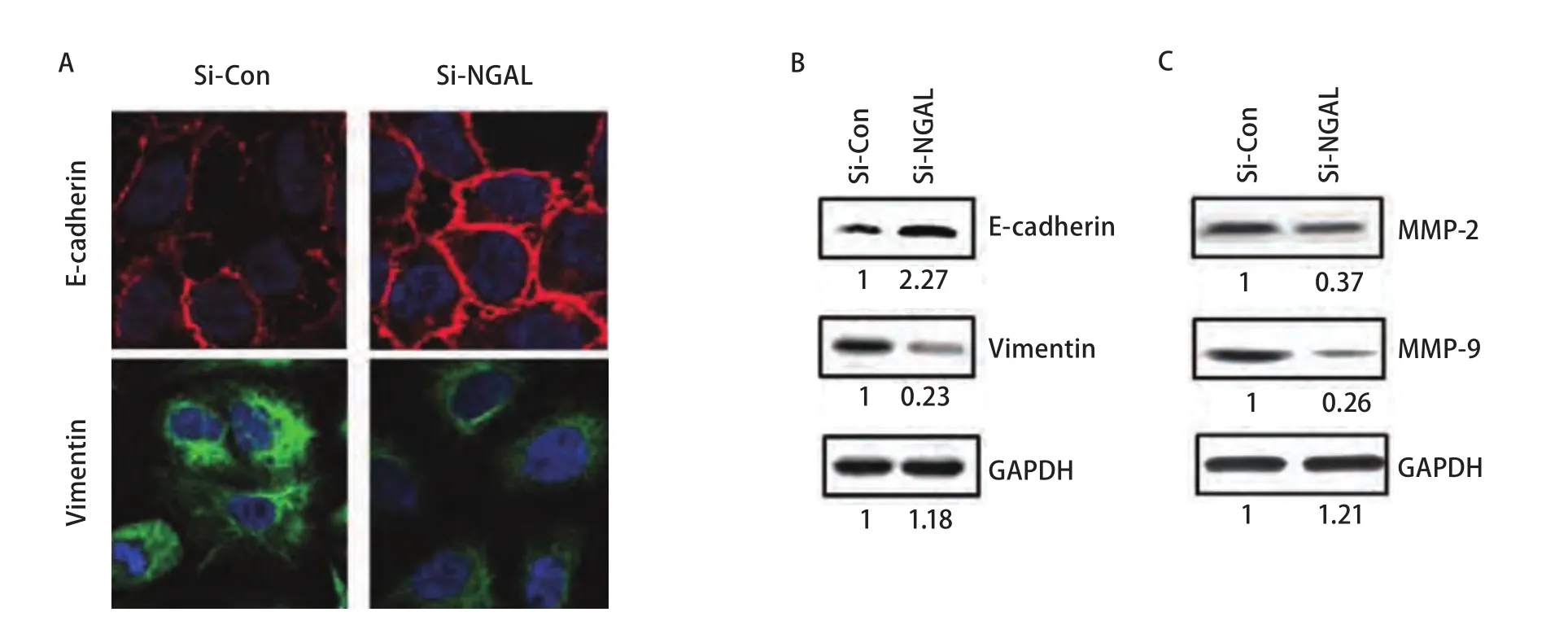
图 5 干扰NGAL后,EMT相关蛋白的表达。A:免疫荧光检测干扰NGAL后,E-cadherin和Vimentin的表达;B:Western blot检测干扰NGAL后,E-cadherin和Vimentin的表达;C:Western blot检测干扰NGAL后,MMP-2和MMP-9的表达。Fig 5 Expression of EMT related marker protein treated with NGAL-SiRNA. A: E-cadherin and vimentin expression was detected by immunoflouresence after treated with NGAL-SiRNA; B: E-cadherin and vimentin expression was detected by Western-blot after treated with NGALSiRNA; C: MMP-2 and MMP-9 expression was detected by Western blot after treated with NGAL-SiRNA. EMT: epithelial-mesenchymal transition.
EMT在生物的发育、组织修复和肿瘤转移中发挥着重要作用,是癌症发展和肿瘤转移过程的重要标志性转变EMT的发生是以E-cadherin、细胞角蛋白等上皮性标志物表达下调,Vimentin、N-cadherin等间叶性标志物表达上调为特点,而且发生EMT的肿瘤细胞细胞间迁移和侵袭能力增强[8]。本研究发现在抑制NGAL的表达时,Vimentin蛋白表达降低,而E-cadherin蛋白表达明显升高,说明抑制NGAL的表达可抑制A549细胞的EMT转化,进而抑制细胞迁移和侵袭移动。在乳腺癌的研究中同样发现,干扰NGAL能够下调E-钙粘蛋白表达,参与表皮生长因子诱导的EMT,促进肿瘤的浸润和转移[9]。而多项研究[10,11]表明NGAL促进癌细胞侵袭行为的另一可能机制是NGAL蛋白能够与MMP-9形成复合物,增加MMP-9活性,促进细胞外基质的降解,促进新生血管的形成,增强肿瘤细胞迁移和侵袭的能力。本研究也证实了敲减NGAL后,MMP-2及MMP-9蛋白表达水平显著降低。还有研究[12,13]表明NGAL蛋白是一种新的铁离子转运载体,可以和铁高亲和力结合,促进肿瘤细胞的增殖。
综上所述,NGAL可作为肺癌发生、进展、迁移和侵袭等过程中一个重要的检测指标及潜在靶点,其在肿瘤发生发展中的机制和意义还有待进一步深入研究。

