抗阻运动对增龄大鼠血脂及股四头肌相关基因表达的影响
林文弢,杜 亚 ,翁锡全,范锦勤
2010年第六次全国人口普查数据显示:我国大陆31个省、自治区、直辖市和现役军人的人口中,60岁及以上人口占13.26%,其中65岁及以上人口占8.87%[1]。而2014年国民经济和社会发展统计公报显示:我国2014年年末人口数及其构成中,60岁及以上人口占15.5%,其中65岁及以上人口占10.1%[2]。这两组数据表明,我国已进入了老年化社会,且老年人口的增长速度惊人,如何提高老年人生命质量,以减轻家庭和社会负担变得刻不容缓。
机体在增龄性衰老时,不仅可能发生骨骼肌减少症(sarcopenia)[3],导致骨骼肌功能衰退,严重影响老年人生活质量[4],伴随着增龄而发生的机体物质代谢变慢和能量代谢速率下降,则还可能会引起老年人脂代谢紊乱,令2型糖尿病、高脂血症、冠心病和脑血管意外频发。研究表明,抗阻运动可有效延缓骨骼肌减少症的发展[5],且对脂代谢也有一定的影响[6-10]。本研究拟观察8周跑台抗阻力运动对自然增龄大鼠血清脂代谢指标及股四头肌有关脂代谢因子腺苷酸激活蛋白激酶(AMPK)和过氧化体增殖物激活型受体(PPARs)亚型PPARα、PPARγ基因表达的影响,以探讨抗阻运动与衰老机体脂代谢的关系。
1 材料与方法
1.1 实验对象与运动方案
健康雄性 SD 大鼠 40只,11月龄,体重(776.9±50)g。从广东生物医学动物实验中心 (许可证号:SCXK(粤)2008-0002)购入,分开每笼 3只饲养,使用国家标准啮齿类动物常规饲料喂养,控量饮食每笼每日90 g,自由饮水,昼夜节律光照,24 h通风,室温和湿度分别控制在(23±2)℃和 40%~60%。
大鼠自然增龄至18月龄后,采用翁锡全等的跑台抗阻运动模型[11],随机分为安静组AQ(N=8),0%最大负重运动组 AC(N=8),30%最大负重运动组 ASE(N=8),50%最大负重运动组 AME(N=8),70%最大负重运动组 ALE(N=8),其中对大鼠施加的负重量是通过预实验获取各鼠的最大负重的百分比,最大负重量为在大鼠尾部施加负荷直至大鼠在驱赶下持续前行时间不超过5 s的负重重量。运动时,尾部负重的大鼠在坡度为35°的跑台上以15 m/min的速度爬坡,每次运动 15 s,间歇休息 30 s,循环 4次后休息 3 min,此为1组,3组为1个循环,每天运动2个循环,循环间歇为10 min。适应性运动一周,随后正式实验8周,隔天进行1次,均从13:30开始。至实验结束时,AC组和ASE组大鼠均余7只,其余各组大鼠数量无变化。
1.2 样品采集
最后一次运动结束,大鼠禁食12 h后称体重,用10%水合氯醛 (300 mg/kg.wt)腹腔注射麻醉,腹主动脉采血,以3 500 r/min离心10 min分离血清,转 -70℃冰箱保存。解剖大鼠取股四头肌组织,用冷生理盐水漂洗去血液,滤纸吸干,锡纸包裹后即置液氮中速冻,随后于-70℃冰箱保存。
1.3 测试指标与检测步骤
1.3.1 血清脂代谢指标检测
血清游离脂肪酸(FFA)、血清甘油三酯(TG)、血清低密度脂蛋白(LDL)和血清高密度脂蛋白(HDL)均采用氧化酶法检测,使用仪器为RT-1904C半自动生化分析仪,试剂购自南京建成生物工程研究所。测试由专人操作,严格按照试剂盒说明书执行。
1.3.2 股 四 头 肌AMPK mRNA、PPARαmRNA和 PPARγ mRNA检测
采用实时定量PCR方法(RT-PCR)检测,使用仪器为BID-RAD实时定量PCR仪,试剂购自广州复能基因公司。AMPK mRNA、PPARα mRNA和 PPARγ mRNA检测步骤:(1)股四头肌总 RNA 抽提;(2)RNA 鉴定;(3)反转录反应;(4)qPCR 检测;(5)相对表达量的计算。
1.4 统计学分析
采用SPSS15.0统计软件包进行统计,实验数据以平均值±标准差(X±SD)表示。显著性差异采用one-way ANOVA检验,以P<0.05为显著性水平,以P<0.01为极显著性水平。
2 实验结果
2.1 抗阻运动对增龄大鼠血清脂代谢指标的影响
由表1可知,经过8周的跑台抗阻运动后,各运动组血清脂代谢指标出现了一定变化。与安静组(AQ)相比,所有运动组大鼠的血清甘油三酯 (TG)、低密度脂蛋白(LDL)和游离脂肪酸(FFA)都出现不同程度的下降,其中30%最大负重运动组(ASE)的血清LDL下降具有统计学意义(P<0.01),而高密度脂蛋白(HDL)则在各运动组出现了不同程度的升高。与0%负重运动组(AC)相比,其余各运动组的TG、LDL和FFA均较低,其中30%最大负重运动组(ASE)的血清LDL下降具有统计学意义(P<0.05),而高密度脂蛋白(HDL)则在30%最大负重运动组(ASE)和50%最大负重运动组(AME)有一定的升高,而70%最大负重运动组(ALE)与其持平。
表1 8周跑台抗阻运动中大鼠血清脂代谢指标变化TableⅠ Changes of the Indicators of the Serum Lipid metabolism of the Rats in 8-week Resistance Exercise

表1 8周跑台抗阻运动中大鼠血清脂代谢指标变化TableⅠ Changes of the Indicators of the Serum Lipid metabolism of the Rats in 8-week Resistance Exercise
注:与 AQ 组相比,*P<0.05,**P<0.01;与 AC 组相比,#P<0.05,##P<0.01。
?
2.2 抗阻运动对增龄大鼠股四头肌AMPK、PPARα和PPARγmRNA表达的影响
3种目的基因的RT-PCR对数扩增曲线及其对应溶解曲线请分别见图1、图2和图 3。由图 1~3可知,3种目的片段均具有较高特异性。
图1 AMPK mRNA RT-PCR对数扩增曲线图(左)及其对溶解曲线(右)Figure1 AMPK mRNA RT-PCR Logarithmic Amplification Curve(Left)and Corresponding Dissolving Curve(Right)

图2 PPARαmRNA RT-PCR对数扩增曲线图(左)及其对应溶解曲线(右)Figure2 PPARαmRNA RT-PCR Logarithmic Amplification Curve(Left)and Corresponding Dissolving Curve(Right)
图3 PPARγmRNA RT-PCR对数扩增曲线图(左)及其对应溶解曲线(右)Figure3 PPARγmRNA RT-PCR Logarithmic Amplification Curve(Left)and Corresponding Dissolving Curve(Right)
从表2可见,经过8周跑台抗阻运动后,与安静组(AQ)相比,各运动组的股四头肌 AMPK、PPARα 和PPARγmRNA表达均出现了不同程度的升高。其中,在AMPK mRNA表达上,30%最大负重运动组 (ASE)和50%最大负重运动组 (AME)的升高均具有统计学意义(P<0.05);PPARα mRNA表达在 30%最大负重运动组(ASE)的升高具有统计学意义(P<0.05);PPARγ mRNA表达在30%最大负重运动组(ASE)和50%最大负重运动组 (AME)的升高均具有统计学意义 (P<0.01,P<0.05)。
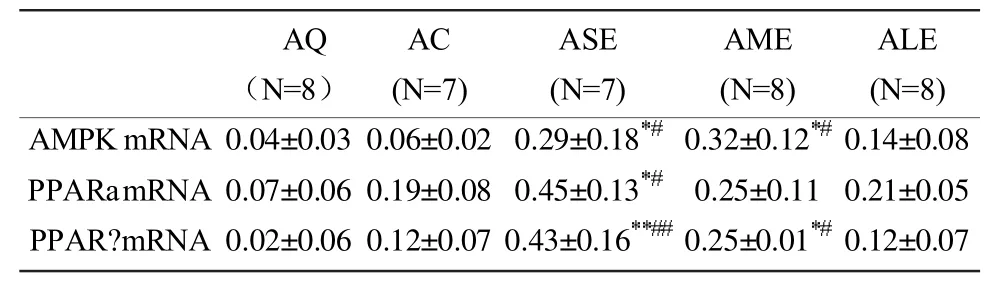
表2 8周跑台抗阻运动大鼠股四头肌 AMPK、PPARα和PPARγ 的 mRNA表达(X±SD)TableⅡ mRNA Expression of AMPK,PPARα and PPARγ of the Rat’s Quadriceps in 8-week Resistance Exercise (X±SD)
而与0%负重运动组(AC)相比,其余各运动组的股四头肌 AMPK、PPARα 和 PPARγmRNA表达变化具有不一致性。其中,在AMPK mRNA表达上,其余各运动组均有升高,30%最大负重运动组(ASE)和50%最大负重运动组(AME)的升高均具有统计学意义(P<0.05);PPARα mRNA表达在30%最大负重运动组(ASE)的升高具有统计学意义(P<0.05),在 50%最大负重运动组(AME)和70%最大负重运动组 (ALE)的升高不具有统计学意义(P>0.05);PPARγ mRNA表达在 30%最大负重运动组(ASE)和 50%最大负重运动组(AME)的升高均具有统计学意义 (P<0.01,P<0.05), 而在 70%最大负重运动组(ALE)的水平与0%负重运动组(AC)接近。
3 分析与讨论
3.1 抗阻训练与血清脂代谢指标
高甘油三酯血症是老年机体常见的血脂异常,其原因主要包括肝脏极低密度脂蛋白(VLDL)的过度合成和富含TG的脂蛋白粒子的清除障碍。LDL和HDL是胆固醇的主要载体,其中LDL是胆固醇转运和进入细胞的主要形式,HDL即主要进行胆固醇的逆向转运。血脂中的高TG、低HDL-C是引发冠心病的独立危险因素,血清FFA则被证实在致机体胰岛素抵抗中起重要作用。随着机体的增龄变化,老年机体可能出现胰岛素敏感性下降和脂蛋白酯酶(LPL)活性降低,两者均可导致TG和VLDL粒子清除障碍,引起FFA水平升高。升高的FFA又具有脂毒性作用,其通过抑制外周葡萄糖的利用和促进糖异生,进一步加剧胰岛素抵抗症状。
陈松娥等观察绝经期后的妇女在进行抗阻训练12周后,其血清TG水平显著低于对照组和运动前自身水平,LDL低于运动前水平,而HDL则显著高于对照组和运动前自身水平[6]。程会兰等对老年2型糖尿病患者开展9周的抗阻训练,发现抗阻训练结合治疗组较单纯治疗组的TG、总胆固醇(TC)、LDL-C水平更低[10]。有研究提出,抗阻训练可能通过提高骨骼肌脂解酶的活性,从而增加肌肉组织氧化和摄取FFA的能力,有效改善脂代谢[8-9]。
本研究结果显示,与安静组(AQ)大鼠相比,经过8周的抗阻运动,各运动组的血脂水平均向有利于机体健康的方向变化,但TG、HDL和FFA的变化并不具有统计学意义,仅有30%最大负重组(ASE)的 LDL水平下降具有显著性(P<0.05)。与 0%最大负重组(AC)相比,其余各负重运动组的血脂指标也呈现出同样的变化。提示在不同负重强度的抗阻运动中,30%的最大负重量更有利于机体的血清脂代谢。而在本研究的运动方案中,运动组大鼠每天的累积运动时间仅为6 min,结合中间的休息间歇,其是以磷酸原供能为主的运动方案,脂肪氧化供能的参与比例很低,这应是各运动组大鼠血脂指标变化大多数不具有统计学意义的主要原因。但结合抗阻运动对大鼠血脂的改变和前人的研究成果,提示抗阻运动对血清脂代谢具有一定的良好刺激,而采用30%的最大负重量运动更为有益。
3.2 抗阻运动与增龄大鼠股四头肌AMPK mRNA表达
腺苷酸激活蛋白激酶(AMPK)是由 α、β、γ3个亚基构成的异三聚体,广泛存在于骨骼肌、肝脏、胰腺和脂肪组织中[12]。AMPK既可启动分解代谢途径,如糖酵解和FFA氧化,增加ATP产生,同时也可关闭合成代谢途径,如FFA合成和蛋白质合成,减少ATP消耗[13]。AMPK是运动时能量代谢的重要调节因子,其可增加骨骼肌中葡萄糖转运和FFA氧化而不依赖于胰岛素作用机制[14]。
研究显示,AMPK活性在抗阻运动后升高。Drummond等报道,急性抗阻运动1~3 h后,年轻人及老年人骨骼肌中的AMPKα磷酸化增加,说明AMPK活性均升高,其中老年人升高得更明显[15]。Dreye等报道,成人进行抗阻运动后,AMPKα2的活性即刻明显升高且可持续至运动后1 h[16]。Oh等报道,老年大鼠进行8周抗阻运动后,其趾长伸肌中的AMPK磷酸化增加,AMPK活性升高,而进行耐力运动的老年大鼠则没有这种变化[17]。此外,AMPK可增加FFA氧化而减少TG的合成。有关研究提示脂联素刺激葡萄糖的利用和FFA的氧化可能就是在AMPK的介导下完成的[18]。Leff T等研究证实AMPK还可通过调控基因的表达来改善糖、脂代谢[19]。Zaha等研究也指出,AMPK可通过上调PPARα表达,调控FFA代谢的关键酶如肉碱棕榈酰转移酶 -1(CPT-1),进而促进 FFA 氧化[20]。
本研究数据显示,8周跑台抗阻运动后,与安静组(AQ)相比,各运动组大鼠的股四头肌AMPK mRNA表达均出现了不同程度的升高,而与0%负重运动组 (AC)相比,AMPK mRNA表达在其余各运动组同样均有升高。且其基因表达在30%最大负重运动组(ASE)和50%最大负重运动组(AME)的升高均具有统计学意义(P<0.05)。说明AMPK mRNA在股四头肌中的表达变化与上述前人的实验结果有相似之处,并提示AMPK mRNA在股四头肌中的表达变化与抗阻训练的负重强度具有一定的关联。有研究显示,运动中AMPK的激活与肌纤维类型有关,运动能显著升高慢肌中AMPK的磷酸化,但不能使快肌中的AMPK活性升高[21]。推测在本研究中,随着抗阻负重重量的增加,股四头肌中被动用的快肌纤维数量增多,从而影响了70%最大负重运动组 (ALE)中 AMPK mRNA的表达。再结合大鼠血清脂代谢指标分析,30%的最大负重抗阻练习能较好地刺激AMPK mRNA的表达,从而促进骨骼肌的糖、脂代谢。
3.3 抗阻运动与增龄大鼠股四头肌PPARα、PPARγ mRNA表达
过氧化物酶体增殖物激活受体 (peroxisome proliferator-activated receptor,PPARs)是一种固醇类受体,属于核受体超基因家族成员,可调控多种核内基因的表达,具有3种亚型(α、β 和 γ),主要表达于肝脏、肾脏、心脏等脂肪酸氧化器官,在骨骼肌内也有表达[22]。目前研究得知它们在脂肪生成、脂质代谢、胰岛素敏感性改善中起重要的作用[23],令其逐渐成为研究脂肪酸代谢分子基础的热点。
PPARα作为一个重要的脂质调节因子,在运动改善血脂中发挥着积极的作用。有研究[24]证明,有氧运动在有效改善血脂代谢的同时增强了骨骼肌中PPARα在转录和翻译水平的表达。Goto等的研究提示FFA作为PPARα的有效配体,运动时动员出来的FFA必将激活PPARα来启动PPARα对脂质代谢的调节作用[25]。张玥等也指出运动提高了机体对FFA的利用,可能是激活了PPARα,提高了CPT-1的表达,从而增强了机体的氧化能力,降低了脂质紊乱的发生,有效改善了血脂状况[26]。PPARγ主要在脂肪组织贮存中起重要作用。在动物实验中被证实,PPARγ表达随年龄增大而减少,其可能通过影响前脂细胞分化和成熟脂细胞的功能来参与胰岛素抵抗(IR)的形成[27]。
Stotzer等的研究发现,10周的爬梯抗阻力训练可减少去卵巢SD大鼠腹部脂肪组织的PPARγ的基因表达,增加脂肪酸的β氧化[28]。
本研究结果显示,与安静组(AQ)大鼠相比,8周跑台抗阻运动令各运动组大鼠股四头肌PPARα及PPARγmRNA的表达都出现不同程度的上升,PPARαmRNA表达在30%最大负重运动组 (ASE)的升高具有统计学意义(P<0.05),PPARγmRNA表达在 30%最大负重运动组(ASE)和 50%最大负重运动组(AME)的升高均具有统计学意义(P<0.01,P<0.05);与 0%负重运动组(AC)相比,PPARαmRNA表达在30%最大负重运动组(ASE)的升高具有统计学意义(P<0.05),PPARγmRNA表达在 30%最大负重运动组(ASE)和 50%最大负重运动组(AME)的升高均具有统计学意义(P<0.01,P<0.05)。抗阻运动组大鼠股四头肌的PPARα及PPARγmRNA的表达变化与AMPK mRNA表达变化相一致,提示抗阻运动可通过激活了AMPK的表达而上调了PPARα及PPARγ的基因表达。结果还提示,抗阻运动对PPARγmRNA在骨骼肌组织中的表达变化,与其在脂肪组织中的变化有着不一致的趋势。而小强度负重抗阻运动更能引起PPARα及PPARγ mRNA的表达变化,对血脂代谢影响较大的强度负重抗阻运动具有更良好的刺激作用。
4 结论
8周的跑台抗阻运动可令运动组大鼠的血清脂代谢水平向有利于机体健康的方向变化,大鼠股四头肌的AMPK mRNA、PPARαmRNA和 PPARγmRNA的表达出现与血脂变化相一致的改变;不同的负重强度可影响血脂及相关因子的mRNA表达,以30%和50%的最大负重量较为合适,尤以30%最大负重量的抗阻训练对大鼠血清脂代 谢 和 股 四 头 肌 AMPK mRNA、PPARαmRNA 和PPARγmRNA的表达最为有利;股四头肌中 PPARαmRNA和 PPARγmRNA的表达与 AMPK mRNA表达相一致,提示抗阻训练有可能通过激活AMPK而引起PPAR受体的基因表达。
[1] 中华人民共和国国家统计局.2010年第六次全国人口普查主要数据公报(第 1号)[EB/OL].2011-04-28,http://www.stats.gov.cn/tjsj/tjgb/rkpcgb/qgrkpcgb/201104/t20110428_30327.html.
[2] 中华人民共和国国家统计局.2014年国民经济和社会发展统计公报2014年[EB/OL].2015-02-26,http://www.stats.gov.cn/tjsj/zxfb/201502/t20150226_685799.html.
[3] Metter EJ,Talbot LA,Schrager M,et al.(2002).Skeletal muscle strength as a predictor of all cause mortality in healthy men[J].Gerontol A Biol Sci Med Sci,57(10):359-365.
[4] Roubenoff R.(2000).Sarcopenia:a major modifiable cause of frailty in the elderly[J].Nutr Health Aging,4(3):140-142.
[5] Granacher U,Gruber M,Gollhofer A.(2009).Resistance training and neuromuscular performance in seniors[J].Int J Sports Med,30(9):652-657.
[6] 陈松娥,彭峰林,邓树勋.抗阻训练对绝经后妇女血脂代谢和胰岛素敏感性的影响[J].体育学刊,2006,13(6):48-50.
[7] Shaw CS,Shepherd SO,Wagenmakers AJ,et al.(2012).Prolonged exercise training increases intramuscular lipid content and perilipin 2 expression in type I muscle fibers of patientswith type 2 diabetes[J].Am J Physiol Endocrinol Metab,303(9):e1158.
[8] Bacchi E,Negri C,Zanolin ME,et al.(2012).Metabolic effects of aerobic training and resistance training in type 2 diabetic subjects:a randomized controlled trial(the RAED2 study)[J].Diabetes Care,35(4):676.
[9] Kacerovsky-Bielesz G,Kacerovsky M,Chmelik M,et al.(2012).A single nucleotide polymorphism associates with the response of muscle ATPsynthesis to long-term exercise training in relatives of type 2 diabetic humans[J].Diabetes Care,35(2):350.
[10]程会兰,施加加,翁雅婧,等.抗阻训练对老年2型糖尿病患者糖代谢、脂代谢等方面的影响[J].实用临床医药杂志,2013,17(23):19-22.
[11]翁锡全,林文弢,孟艳,等.衰老大鼠跑台抗阻训练模型的实验研究[J].中国运动医学杂志,2013,32(3):226-231,225.
[12]Itani SI,Saha AK,Kurowski TG,et al.(2003).Glucose autoregulates its uptakein skeletal muscle:involvement of AMP-activated protein kinase[J].Diabetes,52(2):1635-1640.
[13]Mancini FP,Lanni A,Sabatino L,et al.(2001).Fenofibrate prevents and reduces body weight gain an adiposity in diet induce obese rats[J].FEBS Lett,491(12):154-158.
[14]刘敏.AMPK在运动介导的骨骼肌糖脂代谢中的作用[J].国外医学内分泌学分册,2005,25(3):205-207.
[15]Drummond MJ,Dreyer HC,Pennings B,et al.(2008).Skeletal muscle protein anabolic response to resistance exercise and essential amino acids is delayed with aging[J].Appl Physiol.104(5):1452-1461.
[16]Dreyer HC,Fujita S,Cadenas JG,et al.(2006).Resistance exercise increases AMPK activity and reduces 4E-BP1 phosphorylation and protein synthesis in human skeletal muscle[J].J Physiol.576(Pt 2):613-624.
[17]Oh YS,Kim HJ,Ryu SJ,et al.(2007).Exercise type and muscle fiber specific induction of caveolin-1 expression for insulin sensitivity of skeletal muscle[J].Exp Mol Med,39(3):395-401.
[18]Wu XD,Motoshima H,Mahadev K,et al.(2003).Involvement of AMP-activated protein kinase in glucose uptake stimulated by the globular domain ofadiponectin in primary rat adipocytes[J].Diabetes,52:1355-1363.
[19]Leff T.(2001).AMP-activated protein kinase regulates gene expressionbydirectphosphorylationof nuclear proteins[J].Biochem Soc Trans,31:224-227.
[20]Zaha VG,Young LH.(2012).AMP-activated protein kinase regulation and biological actions in the heart[J].Circ Res,111(6):800-814.
[21]Ai H,Ihlemann J,Hellsten Y,et al.(2002).Effect of fiber type and nutritional state on AICAR-and contraction-stimulated glucose transport in rat muscle[J].Am J Physiol Endocrinol Metab,282(6):E1291-1300.
[22]Furuhashi M,Ura N,Murakami H,et al.(2002).Feno fibrate improve insulin sensitivity in connection with intramuscular lipid content,musclefatty acid-binding protein,andβ-oxidation in skeletal muscle[J].J Endocrinol,174(2):321-329.
[23]Bernet J,Kloting N,Kralisch S,et al.(2005).Plasma visfatin concent rations and fat depot-specific mRNA expression in humans[J].Diabetes,54(10):2911-2916.
[24]McGeez SL,Howlett KF,Starkie RL,et al.(2003).Exercise increases nuclear AMPKα2 in human skeletal muscle[J].Diabetes,52:926-928.
[25]Goto M,Terada S,Kato M,et al.(2000).cDNA cloning and mRNA analysis of PGC-1 in epitrochlearis muscle in swimming-exercised rats[J].Biochem Biophys Res Commun,274:350-354.
[26]张玥,姜宁,苏丽,等.PPARα与运动改善脂质代谢的关系[J].中国康复医学杂志,2008,23(6):495-498,504.
[27]王兆君,叶平,张秀锦.大鼠过氧化体增殖物激活受体α在衰老过程中表达差异及与脂质代谢的关系[J].中国动脉硬化杂志,2003,11(6):285-287.
[28]Stotzer US,Rodrigues MF,Domingos MM,et al.(2015).Resistance Training Suppresses Intra-abdominal Fatty Acid Synthesis in Ovariectomized Rats[J].Int J Sports Med,36(3):226-233.

