基于三苯胺/二苯砜的热激活延迟荧光材料
黄 斌 代 钰 班鑫鑫 蒋 伟,* 张兆杭孙开涌 林保平 孙岳明,*
(1东南大学化学化工学院,南京 211189; 2东南大学成贤学院化工与制药工程系,南京 210088)
基于三苯胺/二苯砜的热激活延迟荧光材料
黄 斌1,2代 钰2班鑫鑫1蒋 伟1,*张兆杭1孙开涌1林保平1孙岳明1,*
(1东南大学化学化工学院,南京 211189;2东南大学成贤学院化工与制药工程系,南京 210088)
通过Suzuki反应合成了三种基于三苯胺/二苯砜的热激活延迟荧光(TADF)材料(1–3),采用紫外-可见(UV-Vis)吸收光谱、时间分辨荧光发射光谱、循环伏安(CV)测试、理论计算、热重分析和差示扫描量热法,系统地研究了三种材料的光物理、电化学、延迟荧光性能和热稳定性.材料1–3均为基于分子内电荷转移(ICT)的双极性分子.三种材料在薄膜中的单线态-三线态能级差分别为0.46、0.39和0.29 eV.荧光量子效率和荧光寿命的测试结果表明,三种材料均能发射延迟荧光,其中材料3具有最佳的延迟荧光性能.材料1–3的最高占有分子轨道(HOMO)能级分别为–4.91、–4.89和–4.89 eV.结合UV-Vis吸收光谱中得到的能隙(Eg)值,我们得到材料1–3的最低未占分子轨道(LUMO)能级,分别为–1.74、–1.89和–1.94 eV.热分析的结果表明,材料1–3具有其较高的热分解温度(Td,失重5%时的温度),分别为436、387和310°C.
三苯胺; 二苯砜; 双极; 分子内电荷转移; 单线态-三线态能级差; 热激活延迟荧光
Key Words:Triphenylamine; Diphenyl sulfone; Bipolar; Intramolecular charge transfer; Energy gap between singlet and triplet; Thermally activated delayed fluorescence
1 引 言
根据自旋统计估算,在电激发条件下,空穴和电子结合形成25%的单线态激子和75%的三线态激子.对传统荧光染料而言,由于它只能利用单线态激子,因而制备的有机电致发光器件(OLEDs)的最大内量子效率仅为25%;而基于贵金属配合物的磷光染料通过利用重原子效应,提高了分子自旋-轨道耦合,能充分利单线态和三线态激子,制得的有机电致磷光器件(PHOLEDs)可以实现100%的内量子效率.1,2近年来,人们都致力于开发高效PHOLEDs.然而,由于磷光染料大多含贵金属如Ir、Pt或Os等,成本较高.开发它们的替代物引起人们的越来越多的关注.3–6其中,基于有机小分子的热激活延迟荧光(TADF)材料有望替代贵金属配合物,制作低成本、高效的OLEDs.7–11但是该类材料仍存在一些局限性,如寿命较长,在高电流密度时容易发生三线态-三线态湮灭,导致器件效率滚降.10
一般来说,单线态-三线态能级差小(ΔEST)的有机分子才能作为TADF材料,因为有机分子的ΔEST越小,越有利于分子的反向隙间窜越(ISC),ISC所需要的能量可以由分子自身内能提供.6为了获得高效的TADF材料,一般的方法是设计具有分子内电荷转移(ICT)效应的双极分子.在一个ICT分子中,最高占有分子轨道(HOMO)和最低未占分子轨道(LUMO)分别位于电子给体基团(D)和电子受体基团(A)上.这样,材料分子的HOMO和LUMO容易实现分离,从而导致较小的ΔEST.7另外,作为优良的TADF材料,还需要有较高的荧光量子效率(Φf).7
近年来,研究发现砜基能增强荧光,含砜基的材料引起人们的广泛兴趣.12一些含砜基的材料作为主体材料、电子传输材料或荧光材料用于制作高效OLEDs.13–16如Zhang等13报道了一种基于三苯胺和二苯砜的双极材料(材料3,如图1所示),该材料在溶液中的ΔEST为0.48 eV,作为主体材料用于荧光-磷光掺杂的白光OLEDs,器件的起亮电压仅为2.4 V,外量子效率高达20.2%.最近,研究发现一些含砜基的双极材料,具有较小的ΔEST,具有良好的TADF性能,用于制作不含贵金属的高效OLEDs.17–19

图1 材料1–3的合成路线Fig.1 Synthetic routes for materials 1–3
在本文中,我们系统地研究了材料3的光物理、电化学等性质,发现材料3具有良好的TADF性能.在材料3的基础上,通过改变三苯胺在二苯砜上的取代位置,得到另外两种TADF材料1和2(如图1所示),并系统地研究了它们的光物理、电化学、延迟荧光性能和热稳定性.
2 实验部分
2.1 仪器与试剂
1H-NMR和13C-NMR由Bruker ARX-300型核磁共振仪测定,四甲基硅烷(TMS)为内标;质谱(MS)由BIFLEXIII型MALDI-TOF质谱仪测定;元素分析(EA)由Elementat Vario EL型CHN元素分析仪测定;紫外-可见(UV-Vis)光谱采用美国安捷伦公司出品的Agilent 8453型UV-Vis吸收光谱仪测定,仪器分辨率为0.1 nm,扫描波长范围200–450 nm;荧光发射光谱、荧光量子效率(积分球)、荧光寿命和时间分辨的荧光发射光谱均采用Jobin Yvon公司的Fluoromax-3荧光光谱仪测定,扫描波长范围350–650 nm,样品浓度为10–5mol·L–1;将材料1–3分别溶解在二氯甲烷溶液中(10 g·L–1),然后旋涂在硅片上,50°C烘干,制得薄膜;材料能级采用电化学循环伏安法测定,仪器为美国Princeton Applied Research公司Potentionstat/Galvanostat Model 283型电化学测试系统,工作电极为铂盘电极,对电极为铂丝电极,参比电极为银丝电极,支持的电解质为四丁基六氟磷酸铵盐溶液(Bu4NPF6,0.1 mol·L–1),溶剂为二氯甲烷.热分析测试采用Netzsch公司STA 409PC型同步热分析仪和DSC 2910型差热式扫描量热仪测定,氮气氛围,测定范围为50–650°C,升温速度为10°C·min–1.量子化学计算采用Gaussian 09软件.
3,3'-二溴二苯砜、3,4'-二溴二苯砜、4,4'-二溴二苯砜和三苯胺-4-硼酸频那醇酯均按文献18,20方法制备.其它试剂和溶剂均为分析纯,购自国药集团化学试剂有限公司.
2.2 三苯胺/二苯砜衍生物1–3的合成
2.2.1 二[3-(4-二苯胺基苯基)苯基]砜(材料1)的合成
将3,3'-二溴二苯砜(0.376 g,1.0 mmol)、三苯胺-4-硼酸频那醇酯(0.816 g,2.2 mmol)溶于甲苯(20 mL)和乙醇(8 mL)中,然后加碳酸钾水溶液(2.0 mol·L–1,4 mL),反应液通氮气10 min,再加四(三苯基磷)钯(0.11 g,0.096 mmol).将反应液加热,氮气保护下回流反应 24 h.反应液冷却到室温,加入20 mL水,用CH2Cl2萃取(3 × 20 mL).合并有机层,用饱和盐水洗(2 × 10 mL),无水硫酸钠干燥.减压蒸去溶剂,残留物加硅胶制砂,经过柱层析,得到的材料1为白色固体.收率:57.6%.m.p.226–228°C.1H NMR(300 MHz,CDCl3,TMS,δ):8.15(s,2H),7.88(d,J=7.5 Hz,2H),7.74(d,J=7.5 Hz,2H),7.54(t,J=7.8 Hz,8.4 Hz,2H),7.45(d,J=8.7 Hz,4H),7.30–7.26(m,10H),7.14–7.04(m,14H).13C NMR(75 MHz,CDCl3,TMS,δ):148.55,147.72,142.53,142.47,132.82,131.51,130.09,129.74,129.42,128.56,128.22,126.10,125.86,125.12,123.74,123.68.质谱(MALDI-TOF) [m/z]:C48H36N2O2S计算值,704.25;测量值,704.2155.元素分析,C48H36N2O2S(计算值)(%):C,81.79;H,5.15;N,3.97;测量值(%):C,81.75;H,5.18;N,3.99.
2.2.2 3-(4-二苯胺基苯基)苯基-4'-(4-二苯胺基苯基)苯基砜(材料2)的合成
用3,4'-二溴二苯砜代替3,3'-二溴二苯砜,其它操作步骤同材料1的合成,得到的材料2为淡黄色固体.收率:48.5%.m.p.180–181°C.1H NMR(300 MHz,CDCl3,TMS,δ):8.15(s,1H),8.00–7.98(d,J=8.4 Hz,2H),7.89(d,J=8.1 Hz,1H),7.74(d,J=8.1 Hz,1H),7.67(d,J=8.4 Hz,2H),7.54(t,J=8.1 Hz,8.1 Hz 1H),7.44(t,J=7.2 Hz,8.1 Hz,4H),7.31–7.26(m,10H),7.15–7.04(m,14H).13C NMR(75 MHz,CDCl3,δ):148.91,148.59,147.78,147.67,146.00,142.84,142.50,139.73,133.54,132.90,132.53,131.50,130.20,129.85,129.47,128.67,128.45,128.31,128.00,127.60,126.06,125.84,125.33,125.17,123.98,123.82,123.40,123.18,122.13,116.78.质谱(MALDI-TOF) [m/z]:C48H36N2O2S计算值,704.25;测量值,704.2652.元素分析,C48H36N2O2S(计算值)(%):C,81.84;H,5.12;N,3.95;测量值(%):C,81.73;H,5.16;N,3.99.
2.2.3 二[4-(4-二苯胺基苯基)苯基]砜(材料3)的合成12
用4,4'-二溴二苯砜代替3,3'-二溴二苯砜,其它操作步骤同材料1的合成,得到的材料3为淡黄色固体.收率:52.3%.m.p.>300°C.1H NMR(300 MHz,CDCl3,TMS,δ):8.01(d,J=8.1 Hz,4H),7.70(d,J=8.4 Hz,4H),7.45(d,J=8.4 Hz,4H),7.31(t,J=7.8 Hz,6.0 Hz,8H),7.16–7.06(m,16H).质谱(MALDI-TOF) [m/z]:C48H36N2O2S计算值,704.25;测量值,704.2276.元素分析,C48H36N2O2S(计算值)(%):C,81.73;H,5.19;N,3.99;测量值(%):C,81.82;H,5.11;N,3.95.
3 结果与讨论
3.1 理论计算
采用密度泛函理论(DFT)对材料1–3进行量子化学理论计算.基态几何构型优化方法采用最常见的B3LYP(即Becke's Three Parameter Hybrid Functional Using the LTP Correlation Functional)函数,采用基组为6-31G(d),所有计算均在Gaussian 09软件21上完成.在优化的基态几何构型基础上,运用含时密度泛函理论(TD-DFT)计算出分子的最低三线态能级、单线态能级、振子强度和激发态组成,理论计算的结果如表1所示.22
图2给出了材料1–3的基态优化几何构型,HOMO和LUMO的电子密度分布.材料1–3的HOMO都分布在电子给体基团三苯胺上,而LUMO主要分布在电子受体基团二苯砜上.材料1–3均具有较小的HOMO-LUMO交叠,具有强烈的ICT的特征,从而都有较小的ΔEST,分别为0.58、0.57和0.50 eV.与材料1和2相比,材料3的HOMO-LUMO交叠更小,ΔEST也最小,预示着其具有更好的TADF性能.
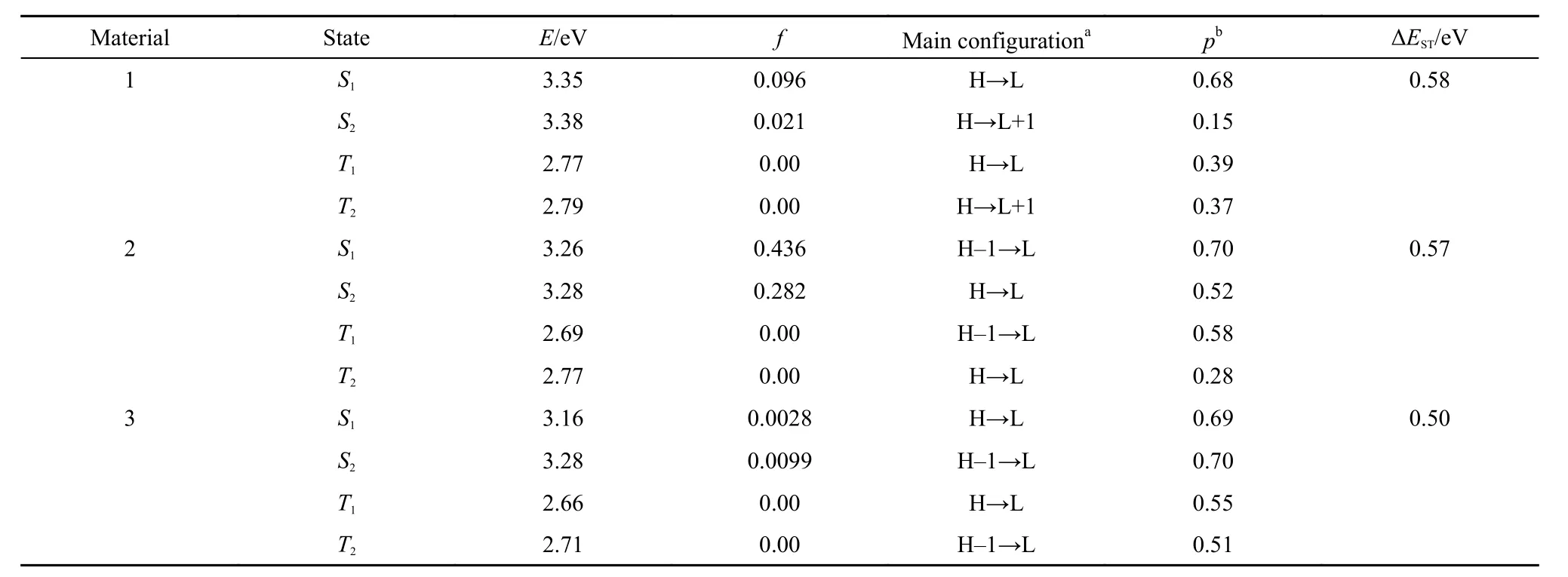
表1 材料1–3基于含时密度泛函理论(TD-DFT)在B3YP水平上使用6-31G(d)基组计算的三线态能级、单线态能级(垂直跃迁)、振子强度(f)和激发态组成Table 1 Triplet and singlet excitation energies(vertical transition),oscillator strength(f),and transition configurations of materials 1–3 calculated by time-dependent density functional theory(TD-DFT) at the B3LYP/6-31G(d) level
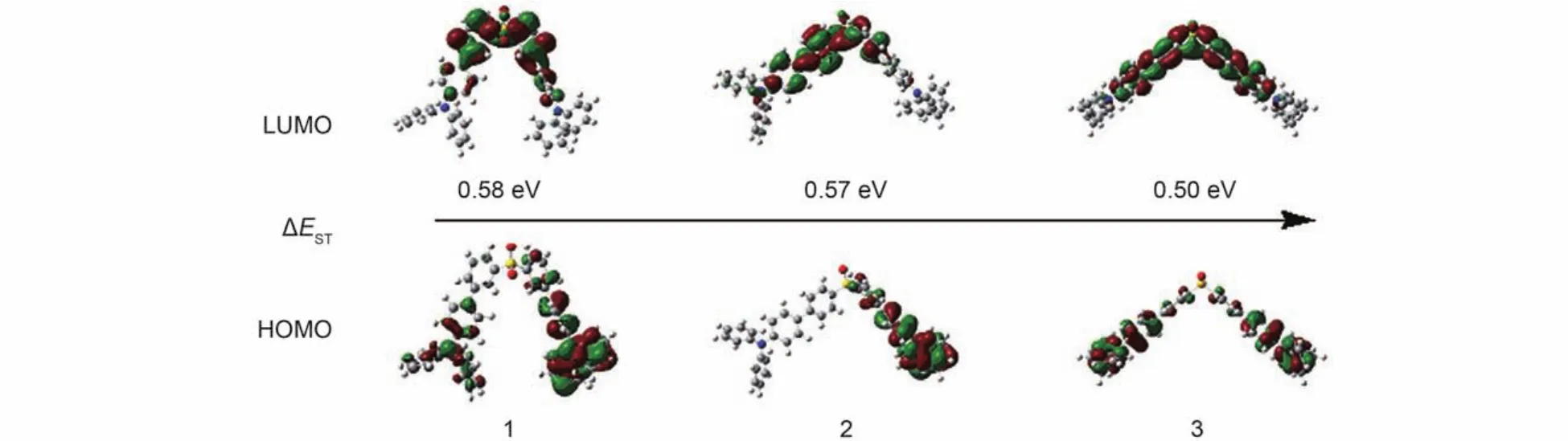
图2 材料1–3的优化基态几何构型和计算得到的HOMO和LUMO能级空间分布密度Fig.2 Optimized geometries and calculated spatial distributions of HOMO and LUMO energy densities for materials 1–3
3.2 UV-Vis吸收光谱
从UV-Vis吸收光谱图3可以看出,材料1–3在CH2Cl2溶液中均出现两个吸收峰,吸收波长位于300–310 nm和344–368 nm之间,分别对应是分子中苯环的π–π*跃迁和ICT效应的吸收.通过UV-Vis吸收光谱的起峰波长,我们可以估算出材料1–3的能隙(Eg)23分别为3.17、3.00和2.95 eV.结果表明,三苯胺在二苯砜上的取代位置对Eg值有重要影响,4-位取代产物(材料3)比3-位取代产物(材料1)由于具有更长的共轭结构,导致Eg值减小.
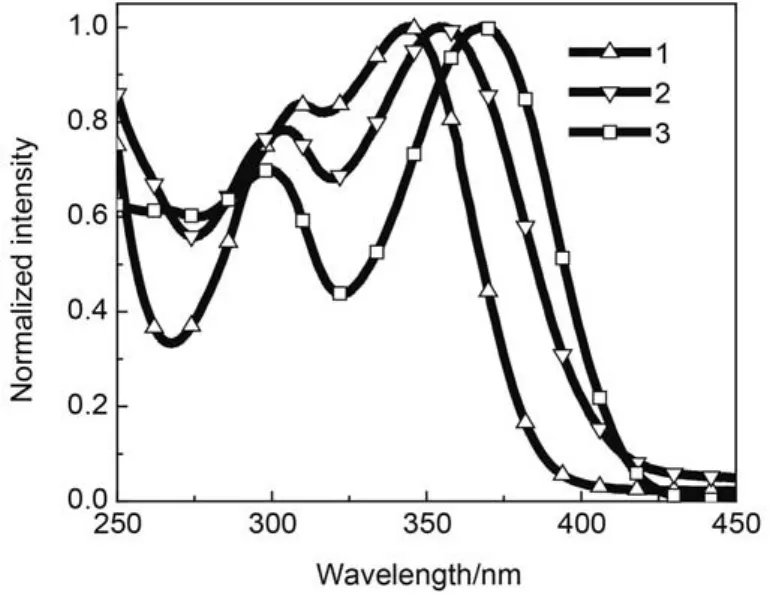
图3 材料1–3在CH2Cl2溶液中的UV-Vis吸收光谱图Fig.3 UV-Vis absorption spectra of materials 1–3 in CH2Cl2solution
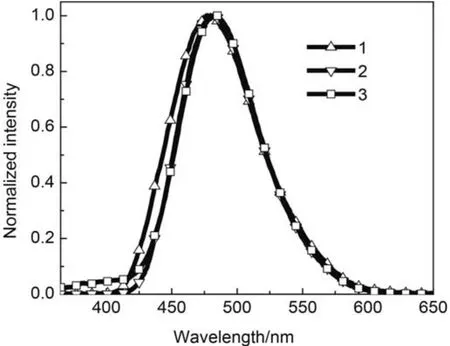
图4 材料1–3在CH2Cl2溶液中的荧光发射光谱图Fig.4 Fluorescence spectra of materials 1–3 in CH2Cl2solution
3.3 荧光发射光谱
材料1–3在CH2Cl2溶液中的荧光(PL)发射光谱如图4所示,在不同溶剂中的PL发射光谱和UVVis吸收光谱数据如表2所示.从图4中看出,材料1–3在CH2Cl2溶液中的最大发射波长分别为477、480和485 nm,对应的是ICT效应发射峰.由于材料3比材料1具有更长的共轭结构,因此最大发射波长红移了8 nm.材料1–3的最大发射波长均随着溶剂极性的增大发生红移,随着溶剂极性的减小发生蓝移.在极性溶剂甲醇中,材料1–3的最大发射波长分别红移到493、494和499 nm;相反,在非极性溶剂正己烷中,材料1–3的最大发射波长分别蓝移到437、423和453 nm,这是典型的ICT效应发射的特征.与在非极性溶剂相比,材料1–3在极性溶剂中具有非常大的Stokes位移.溶剂化效应结果表明,极性溶剂有利于材料1–3的激发态的稳定.
为了进一步探究溶剂的极性对于材料1–3的发射光谱的影响,我们用Lippert-Mataga方程(式(1))讨论了它们在不同溶剂中定向极化率Δf(ε,n)值(式(2)):24,25


其中,νa和νf分别为激发和发射的波数,h为普朗克常数(6.6 × 10–34J·s),c为光速(3.0 × 108m·s–1),ε和n分别为溶剂的介电常数和折射率,Δμ为荧光体的电子激发态和基态的偶极矩差值,a为分子激发时的溶剂笼半径.
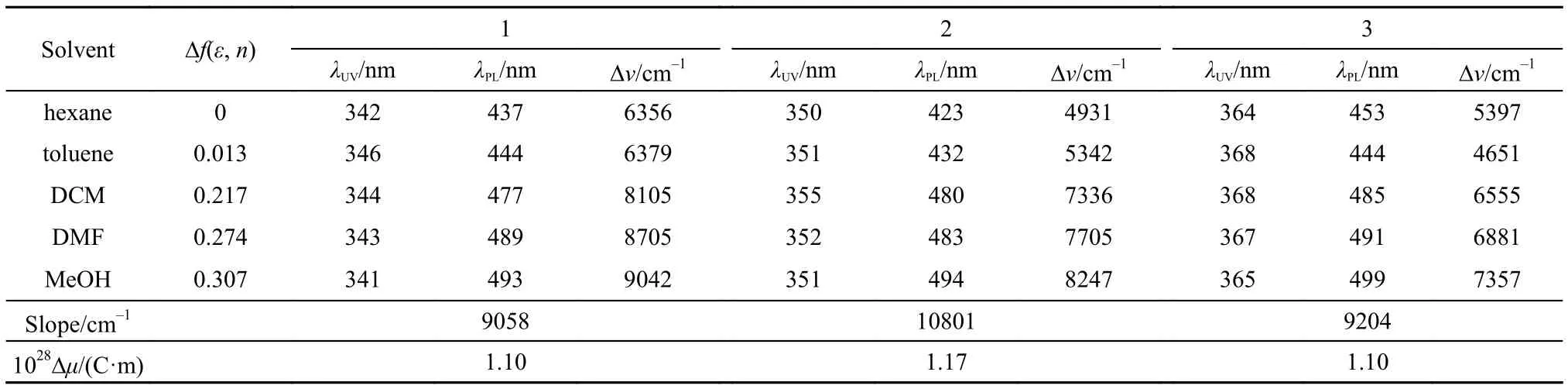
表2 材料1–3在不同溶剂中的光谱性质Table 2 Spectral properties of materials 1–3 in different solvents
根据文献报道的结构类似的二苯砜衍生物的溶剂笼半径,我们估计1–3的半径α为1 nm.13图5为分子1–3在不同溶剂中的Stokes位移(Δν)对Δf(ε,n)作图,直线斜率(slope)分别为9058、10801和9204 cm–1,根据Lippert-Mataga方程,可算出分子1–3在激发前后偶极矩的差值(Δμ).分子1–3的Δμ值分别为1.10 × 10–28、1.17 × 10–28和1.10 × 10–28C·m.如此大的偶极矩变化表明分子1–3中存在典型的ICT效应.
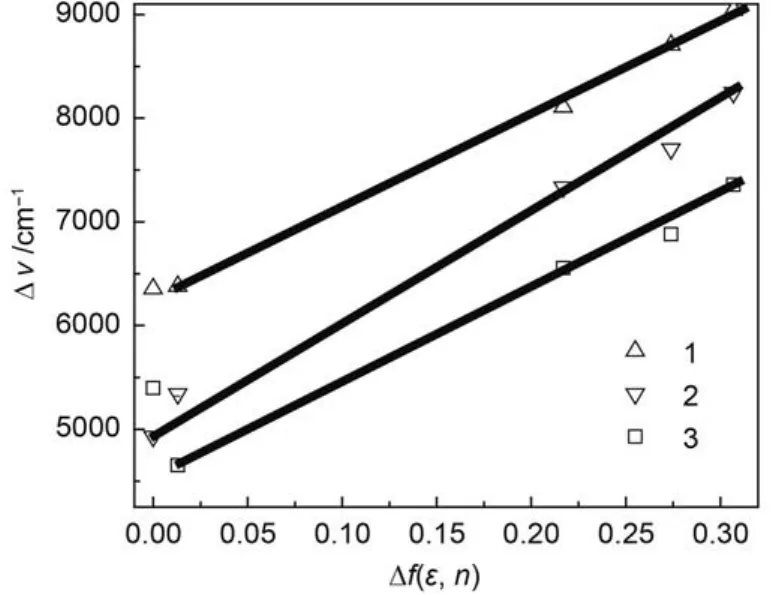
图5 材料1–3的Stokes位移(Δv)与 Δf(ε,n)值的关系Fig.5 Plots of Stokes shift(Δv) vs Δf(ε,n) of materials 1–3
3.4 低温下时间分辨的荧光和磷光发射光谱
为了研究材料1–3的ΔEST,分别测定了材料1–3在薄膜中时间分辨的荧光和磷光发射光谱(测低温磷光发射光谱时,延迟了100 µs以消除荧光发射的影响),结果如图6所示.从图6中可以看出,材料1–3在薄膜中的荧光发射波长分别为444、462和457 nm,对应的是ICT效应发射峰,相应的单线态能级分别为2.79、2.68和2.71 eV;材料1–3在薄膜中的最大磷光发射波长分别为532、541和512 nm,对应的三线态能级分别为2.33、2.29和2.42 eV.进而,计算得到材料1–3在薄膜中的ΔEST,分别为0.46、0.39和0.29 eV,比相应的TD-DFT计算值小,但是趋势是一致的.
3.5 热激活延迟荧光

图6 77 K下材料1–3在固体薄膜中的时间分辨荧光(PL)和磷光(PH)发射光谱(延迟100 µs)Fig.6 Time-resolved photoluminescence(PL) and phosphorescence(PH) spectra of materials 1–3 in solid films with 100 µs delay at 77 K
分别在空气中和无氧条件下(用氮气鼓泡10 min除去氧气),测定了材料1–3在CH2Cl2溶液中的荧光量子效率(Φf)和热激活延迟荧光量子效率(Φd),激发波长为350 nm.如表3所示,在空气中,材料1–3的Φf值分别为0.52、0.76和0.74.除氧后,材料1–3的Φd值分别为0.20、0.24和0.26.结果表明,用氮气置换空气后,材料1–3的三线态不再被氧气猝灭,三线态通过ISC到单线态,形成了延迟荧光.与材料1和2相比,3的Φd值要略大一些,具有更好的TADF性能,这与理论计算预测的结果是一致的.

表3 材料1–3的电化学、光物理性质和理论计算能级Table 3 Electrochemistry,photoluminescence properties and theoretically calculated energy levels of materials 1–3
为了进一步证明材料1–3的TADF性能,我们测定了它们在CH2Cl2溶液中的瞬时荧光寿命(τf)和延迟荧光寿命(τd),结果如表3和图7所示.在空气中,材料1–3的τf值分别为6.14、3.68和3.28 ns.除氧后,材料1–3的τd值分别为13.4、11.1和10.6 μs,是相应的τf值的103倍以上.与纳秒级的τf值相比,τd值达到微秒级,进一步证明了材料1–3的三线态经过ISC越到单线态,从而得到延迟荧光.与材料1和2相比,材料3的τd值要略小一些.在TADF器件中,材料的τd值越大,在高电流密度时容易发生三线态-三线态湮灭,从而导致器件效率滚降.材料具有较小的τd值对克服TADF器件中的效率下降具有重要的意义.10这从另外一个侧面也说明了材料3具有最佳的延迟荧光性能.
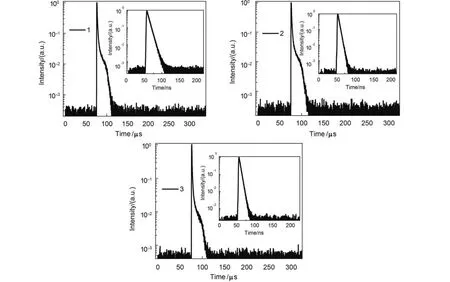
图7 材料1–3在CH2Cl2溶液中的发射衰减曲线(用氮气鼓泡10 min除氧)Fig.7 Emission decay curves of materials 1–3(by bubbling nitrogen through the solution for 10 min to exclude oxygen) in CH2Cl2solution
3.6 电化学性质
以TBAPF6作为电解质,二茂铁(SCE)作为内标,用循环伏安(CV)法测定了材料1–3在CH2Cl2溶液中的电化学性质.图8是四种材料分子的的循环伏安曲线.

图8 材料1–3在CH2Cl2溶液中的循环伏安曲线Fig.8 Cyclic voltammogram(CV) curves of materials 1–3 in CH2Cl2solution
如图8所示,材料1–3均出现可逆的氧化峰,这是电子给体基团三苯胺的氧化峰.根据氧化峰的电位,我们计算了材料1–3的HOMO能级,分别为–4.91、–4.89和–4.89 eV,相差不大,数据如表3所示.结合UV-Vis吸收光谱中得到的Eg值,我们得到材料1–3的LUMO能级,分别为–1.74、–1.89和–1.94 eV,与DFT计算值相差约0.4 eV,但趋势一致.
3.7 热稳定性
通过热重分析(TGA)和差示扫描量热法(DSC)研究了材料1–3的热稳定性,TGA和DSC曲线如图9所示.TGA测试结果表明,材料1–3具有其较高的热分解温度(Td,此处指氮气气氛中加热时,失重5%时的温度),Td分别为436、387和310°C.DSC测试结果表明,材料1具有较高的玻璃态转变温度(Tg),为212°C,材料2和3则没有表现出清晰的Tg.热分析的结果表明,材料1–3均具有较好的热稳定性,其中材料1的热稳定性最佳.
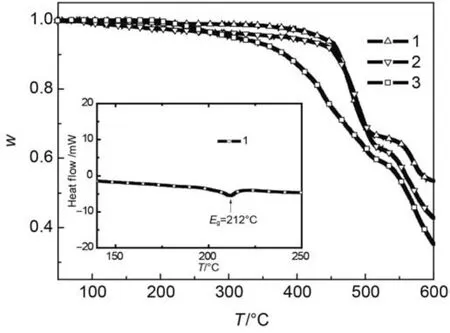
图9 材料1–3的热重分析(TGA)和材料1的差示扫描量热(DSC)曲线Fig.9 Thermogravimetric analysis(TGA) curves of materials 1–3 and differential scanning calorimetry(DSC) curve of material 1
4 结 论
通过Suzuki反应合成了三种基于二苯砜/三苯胺的热激活延迟荧光材料1–3,系统地研究了三种材料的光物理、电化学和延迟荧光性能和热稳定性.三种材料在薄膜中的单线态-三线态能级差分别为0.46、0.39和0.29 eV.在空气中,材料1–3的Φf值分别为0.52、0.76和0.74,τf值分别为6.14、3.68和3.28 ns;除氧后,材料1–3的Φd值分别为0.20、0.24和0.26,τd值分别为13.4、11.1和10.6 μs.荧光量子效率和荧光寿命的测试结果表明,三种材料均能发射延迟荧光,其中材料3的延迟荧光性能最佳,与理论计算预测的一致.热分析的结果表明,材料1–3均具有较好的热稳定性,Td均大于300°C,其中材料1的热稳定性最佳.本文为设计性能优异的新型TADF材料提供一定的参考.
(1)Baldo,M.A.;O'Brien,D.F.;You,Y.;Shoustikov,A.;Sibley,S.;Thompson,M.E.;Forrest,S.R.Nature 1998,395,151.doi:10.1038/25954
(2)Tao,Y.T.;Yang,C.L.;Qin,J.G.Chem.Soc.Rev.2011,40,2943.doi:10.1039/c0cs00160k
(3)Hashimoto,M.;Igawa,S.;Yashima,M.;Kawata,I.;Hoshino,M.;Osawa,M.J.Am.Chem.Soc.2011,133,10348.doi:10.1021/ja202965y
(4)Zhang,Q.;Komino,T.;Huang,S.;Matsunami,S.;Goushi,K.;Adachi,C.Adv.Funct.Mater.2012,22,2327.doi:10.1002/adfm.v22.11
(5)Zhang,D.;Duan,L.;Li,C.;Li,Y.;Li,H.;Zhang,D.;Qiu,Y.Adv.Mater.2014,26,5050.doi:10.1002/adma.201401476
(6)Tao,Y.;Yuan,K.;Chen,T.;Xu,P.;Li,H.;Chen,R.;Zheng,C.;Zhang,L.;Huang,W.Adv.Mater.2014,26,7931.doi:10.1002/adma.v26.47
(7)Uoyama,H.;Goushi,K.;Shizu,K.;Nomura,H.;Adachi,C.Nature 2012,492,234.doi:10.1038/nature11687
(8)Nakanotani,H.;Higuchi,T.;Furukawa,T.;Masui,K.;Morimoto,K.;Numata,M.;Tanaka,H.;Sagara,Y.;Yasuda,T.;Adachi,C.Nat.Commun.2014,5,4016.
(9)Wang,H.;Xie,L.;Peng,Q.;Meng,L.;Wang,Y.;Yi,Y.;Wang,P.Adv.Mater.2014,26,5198.doi:10.1002/adma.201401393
(10)Zhang,Q.;Li,B.;Huang,S.;Nomura,H.;Tanaka,H.;Adachi,C.Nat.Photon.2014,8,326.doi:10.1038/nphoton.2014.12
(11)Sato,K.;Shizu,K.;Yoshimura,K.;Kawada,A.;Miyazaki,H.;Adachi,C.Phys.Rev.Lett.2013,110,247401.doi:10.1103/PhysRevLett.110.247401
(12)Christensen,P.R.;Nagle,J.K.;Bhatti,A.;O'Wolf,M.J.Am.Chem.Soc.2013,135,8109.doi:10.1021/ja401383q
(13)Zheng,C.J.;Wang,J.;Ye,J.;Lo,M.F.;Liu,X.K.;Fung,M.K.;Zhang,X.H.;Lee,C.S.Adv.Mater.2013,25,2205.doi:10.1002/adma.201204724
(14)Ye,J.;Chen,Z.;Fung,M.K.;Zheng,C.J.;Ou,X.M.;Zhang,X.H.;Yuan,Y.;Lee,C.S.Chem.Mater.2013,25,2630.doi:10.1021/cm400945h
(15)Huang,T.H.;Lin,J.T.;Chen,L.Y.;Lin,Y.T.;Wu,C.C.Adv.Mater.2006,18,602.
(16)Sasabe,H.;Seino,Y.;Kimura,M.;Kido,J.Chem.Mater.2012,24,1404.doi:10.1021/cm3006748
(17)Wu,S.;Aonuma,M.;Zhang,Q.;Huang,S.;Nakagawa,T.;Kuwabara,K.;Adachi,C.J.Mater.Chem.C 2014,2,421.doi:10.1039/C3TC31936A
(18)Huang,B.;Qi,Q.;Jiang,W.;Tang,J.;Liu,Y.;Fan,W.;Yin,Z.;Shi,F.;Ban,X.;Xu,H.;Sun,Y.Dyes and Pigments 2014,111,135.doi:10.1016/j.dyepig.2014.06.008
(19)Zhang,Q.;Li,J.;Shizu,K.;Huang,S.;Hirata,S.;Miyazaki,H.;Adachi,C.J.Am.Chem.Soc.2012,134,14706.doi:10.1021/ja306538w
(20)Im,Y.;Lee,J.Y.Chem.Mater.2014,26,1413.doi:10.1021/cm403358h
(21)Wu,Y.X.;Ren,H.Y.;Wu,Y.F.;Wang,B.X.Acta Chim.Sin.2015,73(1),53. [巫友雄,任泓扬,吴义芳,王炳喜.化学学报,2015,73(1),53.]
(22)Lee,S.Y.;Yasuda,T.;Yang,Y.S.;Zhang,Q.;Adachi,C.Angew.Chem.Int.Edit.2014,53,6402.doi:10.1002/anie.201402992
(23)Ouyang,M.;Wu,Q.C.;Yu,Z.W.;Li,H.F.;Zhang,C.Acta Phys.-Chim.Sin.2014,30(7),1341. [欧阳密,吴启超,余振伟,李洪飞,张 诚.物理化学学报,2014,30(7),1341.] doi:10.3866/PKU.WHXB201405041
(24)Sumalekshmy,S.;Gopidas,K.R.J.Phys.Chem.B 2004,108,3705.doi:10.1021/jp022549l
(25)Mataga,N.;Kaifu,Y.;Koizumi,M.Bull.Chem.Soc.Jap.1956,29,465.doi:10.1246/bcsj.29.465
Thermally Activated Delayed Fluorescence Materials Based on Triphenylamine/Diphenyl Sulfone
HUANG Bin1,2DAI Yu2BAN Xin-Xin1JIANG Wei1,*ZHANG Zhao-Hang1SUN Kai-Yong1LIN Bao-Ping1SUN Yue-Ming1,*
(1School of Chemistry and Chemical Engineering,Southeast University,Nanjing 211189,P.R.China;2Department of Chemical and Pharmaceutical Engineering,Chengxian College,Southeast University,Nanjing 210088,P.R.China)
A series of thermally activated delayed fluorescence(TADF) materials(1–3) based on triphenylamine/diphenyl sulfone were synthesized by Suzuki cross-coupling reactions.The optical,electrochemical,delayed fluorescence,and thermal properties of these materials were characterized by UVVis spectroscopy,time-resolved fluorescence spectroscopic measurements,cyclic voltammetry(CV),theoretical calculations,thermal gravimetric analyses,and differential scanning calorimetry.Materials 1–3 are bipolar compounds based on intramolecular charge transfer(ICT),and they have small energy gaps between the singlet and triplet(ΔEST) of 0.46,0.39,and 0.29 eV,respectively.The results of fluorescent quantum yields and fluorescent lifetime indicate that these materials can emit delayed fluorescence,and material 3 has the greatest potential as a TADF emitter among materials 1–3.The highest occupied molecular orbital(HOMO) energy levels of materials 1–3 were estimated to be –4.91,–4.89,and –4.89 eV,respectively.From the HOMO energy levels and the optical bandgap(Eg) values,the lowest unoccupied molecular orbital(LUMO) energy levels were estimated to be –1.74,–1.89,and –1.94 eV for materials 1–3,respectively.Thermal gravimetric analysis results reveal that materials 1–3 have high thermal decomposition temperatures(Td),corresponding to 5% weight loss at 436,387,and 310°C,respectively.
April 7,2015;Revised:June 11,2015;Published on Web:June 12,2015.
O644
icle]
10.3866/PKU.WHXB201506121 www.whxb.pku.edu.cn
*Corresponding authors.JIANG Wei,Email:101011462@seu.edu.cn;Tel:+86-25-52090621.SUN Yue-Ming,Email:sun@seu.edu.cn;
Tel:+86-25-52090619-6311.
The project was supported by the National Natural Science Foundation of China(51103023,21173042),National Key Basic Research Program of China(973)(2013CB932900),and Natural Science Foundation of Jiangsu Higher Education Institutions,China(14KJB150003).
国家自然科学基金(51103023,21173042),国家重点基础研究发展规划项目(973)(2013CB932900)及江苏省高校自然科学研究项目(14KJB150003)资助
© Editorial office of Acta Physico-Chimica Sinica

