纳米TiO2颗粒与腐殖酸和SDBS的相互作用机制
鲁 晶,刘冬梅,2,刘世光,刘海星,杨晓南,赵 英,2,崔福义,2
(1.哈尔滨工业大学市政环境工程学院,150090哈尔滨;2.城市水资源与水环境国家重点实验室(哈尔滨工业大学),150090哈尔滨)
国内外学者在纳米材料的迁移转化领域主要考察了纳米材料本身性质(尺寸、形状、化学组成和表面电荷),环境溶液的化学性质(pH、离子浓度和天然有机物质量浓度)和流体动力学因素对纳米材料在水环境中的聚集、沉积及其潜在的暴露情况的影响[1].而关于纳米材料同环境有机物相互作用机制的研究相对较少.天然有机物和表面活性剂是两种在环境水体中广泛存在的环境有机物.天然有机物活性较高,当纳米材料进入到环境水体中,由于其自身高表面活性,极易同天然有机物和表面活性剂发生作用.Chen等[2]证明天然有机物可改变纳米颗粒的表面电荷,从而改变颗粒表面之间静电相互作用的大小及形式.Huangfu等[3]的研究表明,吸附于纳米颗粒表面的天然有机物之间产生的空间位阻作用可阻碍纳米颗粒之间的接近及减少范德华引力的影响,从而增强纳米颗粒在水体中的迁移能力.表面活性剂是一种人为源有机物,少数的相关研究也证明了表面活性剂的存在能够增强纳米颗粒之间的静电斥力和空间位阻斥力,从而增强纳米颗粒的迁移能力[4-5].
本文选取腐殖酸(HA)和十二烷基苯磺酸钠(SDBS),研究其同纳米TiO2颗粒的相互作用及环境水化学条件(pH、离子浓度)对其相互作用的影响.并探讨纳米TiO2颗粒同HA和SDBS的相互作用机制,旨在从本质上掌握纳米污染物在水环境中的污染效应,为饮用水水质安全保障提供理论基础.
1 实 验
1.1 实验材料
纳米TiO2颗粒购自德国德固赛公司,主要为干燥粉末状的纳米TiO2(P25),金红石和锐钛矿的质量分数分别为20%和80%,纯度>99.5%,在20℃时的密度为 3.8 g/cm3,颗粒平均表面积为(50±15)m2/g,平均粒径为21 nm.腐殖酸和十二烷基苯磺酸钠均为分析纯.取0.5 g的SDBS置于500 mL烧杯中,用超纯水配置得到SDBS储备液.取0.5 g的 HA粉末置于500 mL烧杯中,用0.1 mol/L的NaOH溶液将pH调至10,并加热搅拌使其充分溶解.待其冷却后,用0.45μm的滤膜进行抽滤,用0.1 mol/L 的 HCl溶液将滤过液pH调为7左右,得到HA储备液.
1.2 实验方法
纳米 TiO2固体粉末的表征采用日本理学D/max-rA转靶X射线衍射仪,以CuKa为源,管压和管流分别为36 kV和20 mA,扫描范围(2θ)为10°~80°,扫描速度为4°/min.将所获XRD图像与标准图谱进行对比可确定样品的晶型结构,通过谢乐(Scherrer)公式计算样品的平均晶粒尺寸.
水溶液中与HA和SDBS发生相互作用的纳米TiO2颗粒的粒径分布及表面电荷的表征方法如下:在25℃条件下,水溶液中纳米TiO2颗粒的粒径分布测量采用动态光散射(DLS)方法,通过Nano-S纳米粒度分析仪进行检测.为获得理想的分散效果,可在测定前将样品进行超声处理(40 kHz,200 W/L,15 min).采用马尔文公司(Nano-Z)电位仪测定纳米TiO2的Zeta电位.
不同pH和离子浓度影响因素下,HA和SDBS同纳米 TiO2颗粒的吸附实验参考 Chen和Tkachenko等[5-6]的方法.在500 mL烧杯中添加一定量的HA、SDBS储备液(5 mg/L),并用NaCl调节所需的离子浓度(3~100 mmol/L),用 0.1mol/L 的NaOH 和 HCl调节所需的 pH(4、5、6、7、8 和 9).将5 mg的纳米TiO2粉末加入到上述烧杯中,通过磁力搅拌器搅拌1 min后,水浴超声30 min,接着搅拌1 min,确保得到均一稳定和充分吸附的悬浮液.取一定量的悬浮液置于离心管中,在离心机中进行离心(10 min,1 200 r/s).取上清液通过紫外分光光度计测定其质量浓度.HA和SDBS的平衡质量浓度分别用紫外-可见光分光光度计在254、223 nm处的吸光度值表征,通过对比前后的HA、SDBS吸光度,得到HA、SDBS的吸附量(mg/g).上清液同时用ICP-OES法测定TiO2质量浓度,从而证明已将所有纳米TiO2颗粒分离出去.
实验所采用的pH、离子浓度、HA质量浓度等影响因素的数值范围均为水环境中的典型数值.每次实验重复3次,一个样品取3个平行样.
2 结果与讨论
2.1 纳米TiO2粉末的XRD表征
对纳米TiO2粉末(P25)通过XRD进行表征,结果如图1所示.在 2θ为 25.28°时,样品出现较强的衍射峰,通过与标准图谱的比对可知此处为锐钛矿晶型(101晶面)的特征衍射峰.在2θ为 27.13°时,此处为金红石晶型(110晶面)的特征衍射峰,其余峰的2θ值与晶面形式如图1所示,可知P25纳米TiO2粉末主要以锐钛矿为主.
利用Scherrer公式可以估算样品的微晶尺寸,计算得到D101为20 nm.同样对其余晶面进行计算得到的晶面垂直尺寸为19~26 nm,与所购商品包装所示的纳米TiO2颗粒尺寸相符.

图1 纳米TiO2粉末的XRD图
2.2 纳米TiO2颗粒与HA及SDBS的相互作用
为考察纳米TiO2颗粒与HA及SDBS在水环境中的相互作用,测定了pH=7、离子浓度为0.01 mol/L时,10 mg/L的纳米TiO2颗粒悬浮液与不同质量浓度的HA及SDBS相互作用后,纳米TiO2颗粒的平均粒径及表面Zeta电位变化.由图2可知,与不同质量浓度HA相互作用后的平均粒径在220~340 nm;与不同质量浓度SDBS相互作用后的平均粒径在200~340.结果表明,纳米TiO2颗粒在水中并不是以单体形式存在,几乎均是以聚集体的形式存在.随着有机物的添加,平均粒径均有所减小,表明HA和SDBS的存在均抑制了纳米颗粒之间的聚集.
在 pH=7、离子浓度为 0.01 mol/L 时,10 mg/L TiO2纳米颗粒悬浮液与不同质量浓度的 HA及SDBS相互作用后的表面电位变化如图3所示.

图2 纳米TiO2颗粒平均粒径变化

图3 纳米TiO2颗粒表面Zeta电位变化
当HA和SDBS的质量浓度在0~5 mg/L变化时,纳米TiO2颗粒的负电性均有所增强.HA和SDBS均为带阴离子基团的有机物,可证明HA和SDBS确实吸附于纳米TiO2颗粒表面.随着质量浓度由5 mg/L增加到10 mg/L时,纳米TiO2颗粒的表面电位几乎无变化.根据粒径分析可知,随着HA质量浓度由5 mg/L增加到10 mg/L时,平均粒径依然减小,可说明除了静电斥力作用之外,还有其他作用力阻碍了纳米颗粒的聚集.在有机物的存在下,纳米颗粒的聚集取决于DLVO力(范德华引力和双电层之间的静电斥力)和非DLVO力(空间位阻力、氢键作用力及水合作用力).因而说明吸附于颗粒表面的有机物之间的空间位阻力使得颗粒之间的斥力增大,阻碍了纳米颗粒的聚集.
2.3 pH及离子浓度对相互作用的影响
在IS为0.01 mol/L、有机物质量质量浓度为5 mg/L时,测定随着pH的变化纳米TiO2颗粒表面吸附有机物量的变化,结果如图4所示.可以看出,溶液pH对团聚有显著影响,pH为5时吸附量达到最大.随着pH的增大,吸附量也随之减小.
水中悬浮的TiO2由于表面离子的配位不饱和,在水溶液中与水配位,水发生离解吸附而生成羟基化表面[7].表面羟基(TiOH)在水中既可以质子化表现出酸性,也可以去质子化呈现碱性[8],即
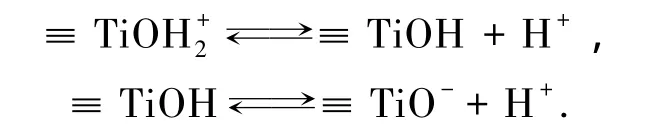
等电点在不同离子浓度下是变化的[9].分别测定在 IS 为0.01 mol/L ,pH 为3、4、5、5.5、6.5、7、8、9、10、11时纳米TiO2的Zeta电位,得到纳米TiO2的等电点 pHpzc=5.2.如图 5 所示,在 pH 分别为 3、4、4.5和5时,纳米 TiO2的表面电位均为正值,分别为30.3、17.1、9.7 和 4.7 mV,纳米 TiO2表面羟基主要表现为质子化作用;在pH为5.5时,纳米TiO2表面带负电,并且随着pH的进一步增加,颗粒表面的负电性越强,在pH为7和9时,颗粒表面Zeta电位分别达-27.2 和-30.2 mV,纳米 TiO2的表面羟基主要表现出去质子化作用.当溶液的pH为4和5时,纳米颗粒表面带正电荷.因而带有阴离子基团的有机物由于静电吸引的作用,极易吸附于纳米TiO2颗粒的表面,产生电荷屏蔽效应,颗粒表面电荷变小,静电斥力减小,易于发生团聚,降低迁移能力.当溶液的pH为6、7和9时,纳米颗粒表面带负电荷,此时阴离子所带基团同颗粒表面电荷电性相同,只有部分有机物依然吸附于纳米TiO2颗粒表面.

图4 不同pH下纳米TiO2颗粒表面吸附有机物量变化

图5 纳米TiO2的Zeta电位随pH的变化(IS为0.01 mol/L)
如图6所示,在pH=7时,随着IS的增加,HA及SDBS在纳米TiO2颗粒表面的吸附量也在不断增加.当IS为0.003 mol/L时,HA和SDBS的吸附量分别为 22 和 19 mg/g.当 IS 提高到 0.01 和 0.03 mol/L时,HA和SDBS的吸附量分别为32和41 mg/g及28和37 mg/g.而当 IS为 0.1 mol/L 时,HA 和 SDBS的吸附量进一步提高到68和59 mg/g,可见IS的提高对有机物在纳米TiO2表面的吸附有重要的影响.随着离子浓度的增加,双电层得到压缩,使得纳米TiO2和有机物之间的排斥力降低,两者之间的吸附能减小,有机物在颗粒表面的吸附量增加.

图6 不同离子浓度下纳米TiO2颗粒表面吸附有机物量变化
2.4 纳米TiO2颗粒与腐殖酸和SDBS相互作用机制
纳米颗粒单体同有机物作用时,由于尺寸上的差异可能被包裹在有机物之中,从而随着有机物的迁移而迁移.但从2.1节中的粒径分析可知,纳米颗粒在天然水环境中多以聚集体形式存在.因此,纳米颗粒可表现出较为明显的吸附界面,从而为有机物的吸附提供空间.

图7 纳米TiO2颗粒与腐殖酸和SDBS相互作用机制
如图7所示,表面存在吸附空间是纳米TiO2颗粒与HA及SDBS相互作用的第一步,第二步即HA及SDBS接近纳米TiO2颗粒的表面.由以上分析可知,纳米TiO2颗粒在水中是一种两性氢氧化物,当pH小于等电点时,表面带正电荷.HA及SDBS由于自身所带的阴离子基团与表面的静电吸引作用可到达颗粒表面.当pH大于等电点时,颗粒表面带负电荷.此时由于同性电荷作用,有机物与颗粒表面存在一定的静电排斥作用.因而有机物接近表面的可能性随着pH的增大而逐渐减小.此时需要考虑非DLVO作用力.对于HA,水合力及已经吸附上的腐殖酸所产生的空间位阻作用将阻碍纳米颗粒的接近及减少范德华力的影响.而对于SDBS,由于疏水作用力和氢键作用力的存在,SDBS离子的疏水尾端(十二烷基部分)会在颗粒表面发生吸附[4].
纳米TiO2颗粒与有机物的吸附不仅需要纳米颗粒表面的吸附空间和纳米颗粒与有机物接触的可能性,最重要的是纳米颗粒表面同有机物之间的强相互作用,即第三步.由前人的研究可知[10],HA 与纳米TiO2颗粒之间是化学吸附,SDBS与纳米TiO2颗粒之间是物理吸附,因而其相互作用也有不同的表现.对于HA,主要存在静电吸引和配位体交换的作用[11].当纳米颗粒的表面带正电荷时,较强的静电吸引作用诱使了纳米TiO2颗粒与有机物的吸附,并形成结合键.当颗粒表面带负电荷时,HA的酚羟基和羧基与纳米TiO2表面的配位体交换作用诱使了颗粒与HA的吸附与成键.对于SDBS,当颗粒的表面带正电荷时,也是静电吸引作用诱使了纳米TiO2颗粒与SDBS阴离子头端的吸附.当颗粒的表面带负电荷时,SDBS的疏水尾端因其疏水作用和氢键会在纳米TiO2颗粒的表面发生吸附.
3 结 论
1)纳米颗粒平均粒径随着有机物质量浓度的增加逐渐减小.表面电位的变化与其不同,当HA和SDBS的质量浓度在0~5 mg/L变化时,纳米TiO2颗粒的负电性均有所增强.随着质量浓度由5 mg/L增加到10 mg/L时,纳米TiO2颗粒的表面电位无明显变化.
2)当溶液的pH为4和5时,纳米颗粒表面带正电荷,因电荷屏蔽效应,HA和SDBS均易于吸附在颗粒表面.当溶液的pH为6、7和9时,纳米颗粒表面带负电荷,此时SDBS的疏水作用力及氢键作用力促进其吸附的发生.随着IS的增加,HA及SDBS在纳米TiO2表面的吸附量不断增加.
3)纳米TiO2颗粒与HA及SDBS的相互作用机制可分为聚集、接近和强相互作用3个步骤.
[1]PETOSA A R,JAISID P,QUEVEDO IR,etal.Aggregation and deposition of engineered nanomaterials in aquatic environments:role of physicochemical interactions[J].Environmental Science & Technology,2010,44(17):6532-6549.
[2]CHEN K L,ELIMELECH M.Influence of humic acid on the aggregation kinetics of fullerene(C60)nanoparticles in monovalent and divalent electrolyte solutions[J].Journal of Colloid and Interface Science,2007,309(1):126-134.
[3]HUANGFU X,JIANG J,MA J,et al.Aggregation kinetics of manganese dioxide Colloids in aqueous solution:influence of humic substances and biomacromolecules[J].Environmental Science& Technology,2013,47(18):10285-10292.
[4]杜鑫.SDBS对TiO2纳米颗粒在松花江水样中的团聚及混凝去除的影响[D].哈尔滨:哈尔滨工业大学,2014.
[5]TKACHENKO N H,YAREMKO Z M,BELLMANN C,et al.The influence ofionic and nonionic surfactants on aggregative stability and electrical surface properties of aqueous suspensions of titanium dioxide[J].Journal of Colloid and Interface Science,2006,299(2):686-695.
[6]CHEN G,LIU X,SU C.Distinct effects of humic acid on transport and retention of TiO2rutile nanoparticles in saturated sand columns[J].Environmental Science &Technology,2012,46(13):7142-7150.
[7]刘媛媛,潘纲.吸附模式对有机物光催化降解的影响1.H-酸在TiO2表面的吸附模式[J].环境化学,2006(1):1-5.
[8]刘世光.纳米二氧化钛在水中的聚集沉积特性研究[D].哈尔滨:哈尔滨工业大学,2013.
[9]KOSMULSKI M,MACZKA E, ROSENHOLM JB.Isoelectric points of metal oxides at high ionic strengths[J].The Journal of Physical Chemistry B,2002,106(11):2918-2921.
[10]陈启晴,尹大强,胡霞林.溶液化学对纳米二氧化钛吸附腐殖酸的影响[J].环境化学,2011(4):797-802.
[11]牟晓英.纳米二氧化钛在水中的特性及与腐殖酸的相互作用研究[D].哈尔滨:哈尔滨工业大学,2011.

