物理的“楞次”携手化学的“勒夏特列”
漳州第一中学 许美
物理的“楞次”携手化学的“勒夏特列”
自然界是一个统一、不可分割的整体。人类是自然界中的一员,而各种各样的科学规律则是自然界事物之间联系的体现。所以,由人们总结出来的规律也应该是紧密相连的。物理学上的楞次定律和化学上的勒夏特列原理便是其中的一个典例,通过两者的类比教学,会让学生更加熟练地掌握它们各自的内涵和用法,也能让我们感受到各学科之间的学习并不是孤立的,而是具有一种统一的美。
楞次定律 勒夏特列原理 类比学习 平衡系统
自然界万物有着一种统一的美,各个学科内部之间本来就存在着紧密的联系。比如:生物学上说,生态系统中有“牵一发而动全身”的特性,然而由于负反馈调节的作用,生态系统却具有一定的稳定性,能够保持自身结构和功能的相对稳定;物理学上说,当通过闭合回路的磁通量发生变化时,由感应电流所激发的磁场会阻碍原磁通量的变化;化学上说,对于一个已达到平衡的反应,当影响平衡的条件发生改变时,平衡将会朝着阻碍这种改变的方向移动。
上述各学科给予我们的启示是:一个平衡系统对外界干扰的反应总是会阻碍外界干扰的进行,当然这只是阻碍并不是阻止。这让我们不禁想到,不同学科之间是否有什么相同的规律?我们在教学中又该如何来利用这种共同规律让学生更快地理解、领会本学科的知识点?下面,让我们通过几个步骤来了解一下这两条原理之间的联系。
1 原理讲解
勒夏特列原理(又称平衡移动原理):在一个已经达到平衡的可逆反应中,改变影响化学平衡的一个因素(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动[1]。
勒夏特列原理给了我们一种定性判断化学平衡移动的方法。我们知道,影响化学平衡的条件主要有温度、压强和浓度。由于任何化学反应都存在能量的转化,当系统温度降低时,平衡将朝着放热反应的方向移动;当温度升高时,平衡将朝着吸热反应的方向移动。同样的道理,当某种反应物的浓度发生改变时,若其增加,平衡将正向移动,若其减少,平衡将逆向移动;生成物的浓度发生改变的情况则相反。如果是系统的压强发生改变呢?以氮气和氢气反应生成氨气为例,由于反应物的化学计量数总和大于生成物的化学计量数总和,那么当压强增大时,平衡就要向正反应方向移动;压强减小时,平衡就要逆向移动。特殊的是,如果反应物和生成物的化学计量数总和相等,那么压强的改变就不会引起平衡的移动。当然这种平衡的移动只会削弱或阻碍影响条件的改变,而不能完全地阻止这种改变。
物理学中的楞次定律的主要内容是:闭合回路中感应电流的方向,总是使得它所激发的磁场来阻碍引起感应电流的磁通量的变化[2]。同样的,这只是阻碍而不是阻止。
楞次定律是一条电磁学的定律,从电磁感应得出感应电动势的方向,其可确定由电磁感应而产生之电动势的方向,楞次定律是能量守恒定律在电磁感应现象中的具体体现。楞次定律还可表述为:感应电流的效果总是反抗引起感应电流的原因。“楞次定律”是能量转化和守恒定律在电磁运动中的体现,感应电流的磁场阻碍引起感应电流的原磁场的磁通量的变化,因此,为了维持原磁场磁通量的变化,就必须有动力作用,这种动力克服感应电流的磁场的阻碍作用做功,将其他形式的能转变为感应电流的电能,所以“楞次定律”中的阻碍过程,实质上就是能量转化的过程。
2 跨科关联
勒夏特列原理(又称平衡移动原理)归纳的是化学学科中关于平衡系统的原理,在物理学科中也有相应的平衡系统的定律——楞次定律。
根据高中教学的特点,楞次定律的教学先于勒夏特列原理,学生在学习完楞次定律的基础上可以更好地理解勒夏特列原理。因此在了解了“楞次定律”和“勒夏特列”原理的基本内容和用法之后,我们会发现两者之间有着惊人的相似之处。
楞次定律中,由于磁通量的改变必然会有感应出来的电流激发磁场来阻碍这种变化;同样,在勒夏特列原理中,由于外界环境的改变,必会有系统内部物质浓度的相应改变来阻碍这种变化;楞次定律中由感应出来的电流产生的磁场使物体受力,这个力必会阻碍原物体的运动;同样,在勒夏特列原理中,在平衡时由于外界压强、温度等的改变时平衡出现了移动,这个移动必会阻碍原平衡的进行。下面举两个简单的例子来揭示两者的紧密联系。
例1:如图,在垂直于纸面向里的磁场中,在一U形的光滑导轨上放置一根与其接触良好的金属棒,施加恒力F是导体棒向右运动,则以下正确的是:
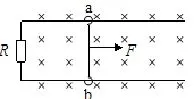
A:回路中有顺时针方向的电流;
B:回路中有逆时针的电流;
C:导体棒一直向右运动;
D:导体棒先向右运动后停止。
很明显答案是 BC。根据楞次定律可以知道,由于磁场的作用,产生的感应电流必然会阻碍导体棒的向外运动,由右手定则可判断电流方向为逆时针方向。另一方面由于感应电流只会阻碍导体运动而不会阻止其运动,所以导体棒会一直向右运动。
例 2:在一个密闭的容器中,发生如下的反应:N2+3H2⇔2NH3。当体系达到平衡时,向其中充入氮气,则以下正确的是:
A:平衡正向移动;
B:平衡逆向移动;
C:新的平衡时氮气浓度比原来的大;
D:新的平衡时氮气浓度比原来的小。
答案是 AC。根据勒夏特列原理,反应物的浓度发生增加时,则平衡正向移动,并且这种平衡的移动只会削弱或阻碍影响条件的改变,而不能完全阻止这种改变。因此新的平衡时氮气浓度会比原来的大。
3 结论
通过以上两例的对比,我们会发现,这两条定律似乎在阐述同一个道理,一个达到稳定状态的系统,总是会有想要维持原来状态的趋势,一旦有某种外来的力量想要破坏这种状态,系统就会产生一种“反力量”来阻碍这种外来力量。在高中的学习阶段中,学生对楞次定律的学习先于勒夏特列原理,当了解到两者的密切关系后,我们就要学会迁移,把物理中的知识应用到化学中来,解决平衡移动中的各种问题,做到举一反三。同时,这样的方法不仅会使学习事半功倍,而且让我们更加感到学科间并不是相互独立的,而是紧密相连、密不可分的一个整体。
在这样的比较中,我们利用其他学科已完成的相应原理或定律,启发学生理解本学科的知识点,同时也能加深和巩固学生对前一学科相应知识的理解。通过各学科相关知识交叉的引用和相互印证,让物理的“楞次”携手化学的“勒夏特列”,提高学生的学习兴趣,让学生在快乐中学习,以此提高教与学的效率,做到事半功倍,进而使学生由单学科的理解、逐渐融会到多学科的贯通,对学生构建完整的学科知识框架体系,拓展知识的横向联系有极大帮助。
终有一天,在科学上或者哲学上会有更一般化的规则被总结出来,这需要我们在平常的学习中不断地思考。只有如此,才能发现楞次定律和勒夏特列原理背后更为壮观的科学之美。
[1] 王祖浩. 化学反应原理[M]. 南京∶ 江苏教育出版社, 2006.
[2] 程守洙, 江之永. 普通物理学[M]. 北京∶ 高等教育出版社, 2006.

