干扰素-γ对黑色素瘤细胞血管生成拟态的影响及机制
韩健,孙保存△,马跃美,赵秀兰
干扰素-γ对黑色素瘤细胞血管生成拟态的影响及机制
韩健1,孙保存1△,马跃美2,赵秀兰1
目的 研究干扰素-γ(IFN-γ)对人黑色素瘤细胞系MUM-2B迁移、侵袭和血管生成拟态(VM)形成能力的影响。方法 将MUM-2B细胞体外培养后分为3组:对照组在含10%FBS的DMEM培养基中培养;实验1组另加入10 μg/L IFN-γ;实验2组另加入100 μg/L IFN-γ。利用划痕实验和侵袭实验分析IFN-γ对MUM-2B细胞迁移、侵袭能力的影响,三维培养观察IFN-γ对MUM-2B细胞VM形成能力的影响,Western blot检测MUM-2B细胞中血管内皮生长因子(VEGF)表达的变化。结果 划痕实验示实验组细胞迁移距离低于对照组,实验2组低于实验1组(P<0.05);侵袭实验示实验组细胞侵袭数量低于对照组,实验2组低于实验1组(P<0.05);三维培养示对照组细胞能够形成VM管道结构,实验组细胞不能形成明显的VM管道结构;Western blot示实验组细胞中VEGF蛋白表达量低于对照组,实验2组低于实验1组(P<0.05)。结论 IFN-γ可以在体外抑制MUM-2B细胞的迁移和侵袭,并通过抑制VEGF的表达而抑制其VM的形成。
黑色素瘤;干扰素γ,重组;血管内皮生长因子类;肿瘤干细胞;血管生成拟态
黑色素瘤是侵袭性最强的皮肤肿瘤[1],转移性黑色素瘤的预后很差,平均生存期只有4~6个月[2]。肿瘤血管生成是肿瘤细胞生长和转移的重要条件。与传统的内皮依赖性血管不同,血管生成拟态(vasculogenic mimicry,VM)是由肿瘤细胞通过自身塑形构成的一种功能性微循环管道,可以为肿瘤组织输送血液和营养物质,并有利于肿瘤的侵袭和转移[3]。由于VM的存在,单纯针对内皮细胞的抗血管生成治疗效果往往不理想[4-5],这提示在抗肿瘤血管生成治疗中需要同时兼顾内皮依赖性血管与VM才有可能获得良好的疗效。研究显示干扰素-γ(interferongamma,IFN-γ)能够抑制肿瘤的侵袭和转移[6],但其对肿瘤VM形成是否有影响尚不明确。本文旨在研究IFN-γ在体外对人黑色素瘤MUM-2B细胞VM形成能力的影响,探讨其可能的作用机制,为肿瘤抗血管生成治疗提供新的思路。
1 材料与方法
1.1 材料 人黑色素瘤细胞系MUM-2B保存于天津医科大学病理学实验室;重组人IFN-γ购于Peprotech公司;DMEM细胞培养基、胎牛血清(FBS)购于Hyclone公司;Matrigel基质购自BD公司;兔抗人血管内皮生长因子(VEGF)抗体、兔抗人β-actin抗体购于Abcam公司。
1.2 方法
1.2.1 细胞培养和实验分组 MUM-2B细胞接种于含10%FBS、1%双抗(100 U/mL青霉素、100 U/mL链霉素)的DMEM培养基中,置于37℃、5%CO2的细培养箱中孵育培养,待细胞生长融合至90%时传代培养,用于后续实验。将细胞分为3组:对照组在含10%FBS的DMEM培养基中培养;实验1组在含10%FBS的DMEM培养基中加入10 μg/L IFN-γ;实验2组在含10%FBS的DMEM培养基中加入100 μg/L IFN-γ。
1.2.2 细胞划痕实验 将3组MUM-2B细胞接种于24孔板中,待细胞生长融合至90%后,弃掉培养基,在细胞表面进行划痕,PBS清洗游离细胞,加入无血清培养基,以此时间点记为0 h。选取任意5个视野,于倒置显微镜下观察细胞从划痕边缘向划痕中央迁移的距离,分别于0 h、3 h、6 h、9 h、12 h和24 h拍照测量细胞迁移距离。实验重复3次。
1.2.3 Transwell细胞侵袭实验 将Matrigel胶以1.5 g/L的终浓度加入上层滤过小室(8 μm直径小孔)表面;无血清培养液溶解的200 μL细胞悬液(5×105个/mL)加入上层小室,300 μL含20%FBS的培养基加入下层小室。37℃、5%CO2培养箱培养24 h,透膜细胞用冷甲醛固定并用0.5%的结晶紫染色。倒置显微镜观察并计数。实验重复3次。
1.2.4 三维培养 将4℃预处理的Matrigel胶与DMEM培养基1∶1混匀后加入96孔板中,50 μL/孔(冰上操作);将96孔板置于37℃温箱中,待胶凝固后,将3组MUM-2B细胞浓度调整为1×105个/mL,每孔加入细胞悬液100 μL,置于37℃、5%CO2培养箱中孵育培养。定时于倒置显微镜下观察细胞形成VM管道结构的能力。
1.2.5 Western blot检测 实验1组和实验2组加入不同浓度IFN-γ处理24 h后,与对照组同时裂解细胞,提取总蛋白,在10%聚丙烯酰胺凝胶中进行电泳。将蛋白转至PVDF膜上,5%脱脂奶粉封闭抗原,加入一抗VEGF(1∶200)、β-actin (1∶1 000),4℃摇床过夜。次日取出PVDF膜,TBST漂洗3遍,加入二抗,室温孵育1 h,TBST漂洗3遍。化学发光法(ECL)显影、定影并拍照。
1.3 统计学方法 采用SPSS 20.0统计软件进行分析,3组间数据比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 IFN-γ对MUM-2B细胞迁移能力的影响 对细胞进行划痕后的0~12 h,3组细胞迁移距离差异无统计学意义,24 h后,实验1组和实验2组细胞迁移距离均低于对照组,实验2组细胞迁移距离低于实验1组(F=1 756.524,P<0.05),见图1、2。

Fig.1 Migration distances of cells in three groups图1 3组细胞迁移距离(×40)
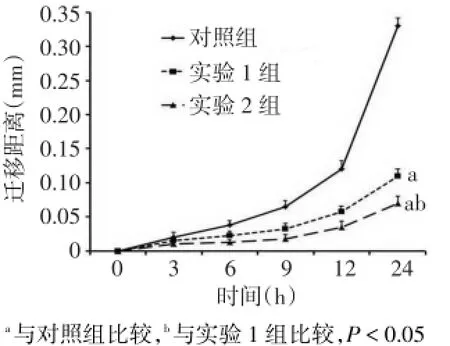
Fig.2 Comparison of migration distances of cells at different time points between three groups图2 不同时间点3组细胞迁移距离比较
2.2 IFN-γ对MUM-2B细胞侵袭能力的影响 加入IFN-γ 24 h后,实验1组和实验2组细胞侵袭数量均低于对照组,实验2组低于实验1组(P<0.05),见图3、4。
2.3 IFN-γ对MUM-2B细胞体外VM管道形成能力的影响 三维培养24 h后,对照组MUM-2B细胞可形成管腔平滑、结构完整的管道样结构,实验1组和实验2组细胞均不能形成明显的管道样结构,见图5;且随着浓度的增加,IFN-γ对MUM-2B细胞管道形成的抑制作用增强。
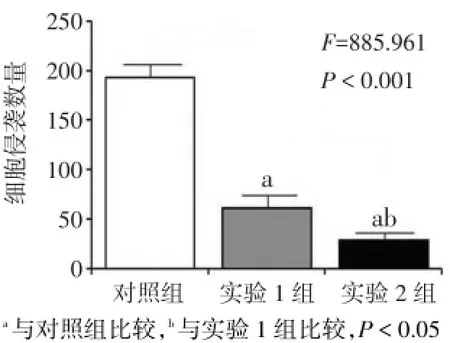
Fig.4 Comparison of invaded cell numbers between three groups图4 3组24后细胞侵袭数量比较
2.4 IFN-γ对MUM-2B细胞VEGF蛋白表达水平的影响 加入IFN-γ 24 h后,实验1组和实验2组的细胞VEGF蛋白表达量均低于对照组,实验2组低于实验1组(P<0.05),见图6、7。
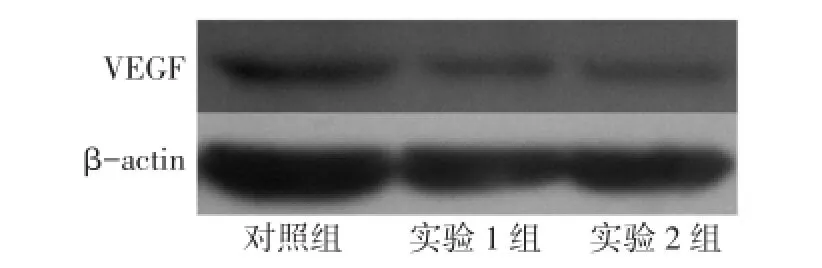
Fig.6 VEGF protein expressions of cells in three groups图6 3组24 h后细胞VEGF蛋白表达水平
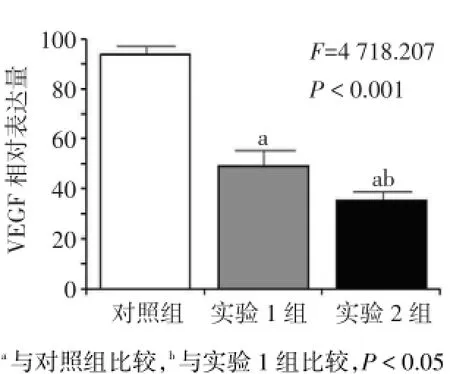
Fig.7 Comparison of VEGF protein expressions of cells between three groups图7 3组24 h后细胞VEGF蛋白表达水平比较
3 讨论
肿瘤的生长和转移被认为是一个依赖于血管生成的过程。Maniotis等[7]在研究高侵袭性人眼葡萄膜黑色素瘤微循环时发现并提出了一种全新的肿瘤血管生成模式,即VM,这种模式下恶性肿瘤细胞可以通过自身塑形和基质重塑而形成一种无内皮细胞衬覆、仅仅由肿瘤细胞和细胞外基质构成的微循环管道,血液可在其中流动。研究显示VM能够为肿瘤组织提供氧分和营养物质,其与内皮依赖性血管之间的连接可促进肿瘤细胞的血道播散,因此,VM的存在预示着肿瘤具有更高的侵袭性和转移性,以及更差的预后[3]。肿瘤干细胞(cancer stem cells,CSCs)是肿瘤组织中具有自我更新和多向分化潜能的细胞群[8]。能够形成VM的高侵袭性黑色素瘤细胞高表达与干细胞相关的基因,当新生血管的血液供应不足以满足肿瘤的生长需要时,CD133表达阳性的肿瘤细胞可以模拟内皮细胞的功能并参与VM形成,提示CSCs可以向内皮细胞方向分化,在肿瘤VM的形成中起重要作用,针对CSCs的靶向治疗可以抑制肿瘤细胞VM的形成[9-10]。
IFN-γ是多功能细胞因子家族的成员,具有抗病毒、免疫调节及抗肿瘤特性[11]。研究报道IFN-γ可以抑制肿瘤的侵袭和转移,将IFN-γ基因转入小鼠黑色素瘤细胞系B-16后,可有效抑制B-16细胞的生长[6,12]。本研究显示IFN-γ能够在体外抑制人黑色素瘤细胞系MUM-2B的侵袭和迁移能力,与既往报道相符[6],且抑制作用随着IFN-γ浓度的增加而增强,呈剂量依赖性。本研究通过三维培养进一步观察IFN-γ在体外对MUM-2B细胞VM管道形成能力的影响,结果显示IFN-γ能够抑制MUM-2B细胞的管道形成能力,并呈剂量依赖性。上述结果提示100 μg/L的IFN-γ对MUM-2B细胞的侵袭、迁移和VM管道形成能力的抑制作用更强。有研究报道IFN-γ能够通过激活吲哚胺2,3-加双氧酶(IDO)而抑制间充质干细胞和神经干细胞的增殖和分化,并可诱导或增强间充质干细胞抑制因子的产生[13-14],因此推测IFN-γ对MUM-2B细胞VM的抑制作用是通过对CSCs的影响而实现的。
VEGF不仅是重要的血管生成因子,还可以促进CSCs向内皮细胞方向分化。研究报道VEGF可以通过VEGFR-2/STAT3通路促进CSCs的自我更新,并能通过激活PI3K/Akt通路在体外促进大鼠干细胞向内皮细胞方向分化,抑制VEGF的表达后,C6神经胶质瘤干细胞的增殖和侵袭能力下降[15-17],提示VEGF对CSCs的生长和分化具有促进作用,抑制VEGF的表达可以抑制CSCs向内皮细胞方向分化。本研究通过Western blot检测了IFN-γ对MUM-2B细胞VEGF表达的影响,结果显示IFN-γ能够在蛋白水平抑制MUM-2B细胞VEGF的表达,并呈剂量依赖性,与其对MUM-2B细胞VM管道形成能力的抑制作用相一致,提示IFN-γ可能通过抑制VEGF的表达从而抑制了MUM-2B细胞中CSCs向血管内皮细胞方向的分化,最终抑制了VM的形成。
综上,IFN-γ可以在体外抑制人黑色素瘤MUM-2B细胞VM的形成,其机制可能是通过抑制肿瘤细胞VEGF的表达进而抑制CSCs向血管内皮细胞方向分化而实现的,提示IFN-γ可以作为潜在的抑制剂对VM这一肿瘤生长早期血液供应的主要来源进行干预,为肿瘤的临床治疗提供了新的思路。
(图3、5见插页)
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[2]Cao Z,Shang B,Zhang G,et al.Tumor cell-mediated neovascularization and lymphangiogenesis contrive tumor progression and cancer metastasis[J].Biochim Biophys Acta,2013,1836(2):273-286.doi:10.1016/j.bbcan.2013.08.001.
[3]Sun B,Zhang S,Zhao X,et al.Vasculogenic mimicry is associated with poor survival in patients with mesothelial sarcomas and alveolar rhabdomyosarcomas[J].Int J Oncol,2004,25(6):1609-1614.
[4]Carbone C,Moccia T,Zhu C,et al.Anti-VEGF treatment-resistant pancreatic cancers secrete proinflammatory factors that contribute to malignant progression by inducing an EMT cell phenotype[J].Clin Cancer Res,2011,17(17):5822-5832.doi:10.1158/1078-0432.CCR-11-1185.
[5]Vasudev N,Reynolds A.Anti-angiogenic therapy for cancer:current progress,unresolved questions and future directions[J].Angiogenesis,2014,17(3):471-494.doi:10.1007/s10456-014-9420-y.
[6]Bahrambeigi V,Ahmadi N,Moisyadi S,et al.PhiC31/PiggyBac modified stromal stem cells:effect of interferon gamma and/or tumor necrosis factor(TNF)-related apoptosis-inducing ligand (TRAIL)on murine melanoma[J].Mol Cancer,2014,13:255.doi: 10.1186/1476-4598-13-255.
[7]Maniotis A,Folberg R,Hess A,et al.Vascular channel formation by human melanoma cells in vivo and in vitro:vasculogenic mimicry [J].Am J Pathol,1999,155(3):739-752.doi:10.1016/S0002-9440 (10)65173-5.
[8]Fan Y,Zheng M,Tang Y,et al.A new perspective of vasculogenic mimicry:EMT and cancer stem cells(Review)[J].Oncol Lett,2013,6(5):1174-1180.doi:10.3892/ol.2013.1555.
[9]Liu Z,Sun B,Qi L,et al.Zinc finger E-box binding homeobox 1 promotes vasculogenic mimicry in colorectal cancer through induction of epithelial-to-mesenchymal transition[J].Cancer Sci,2012,103(4):813-820.doi:10.1111/j.1349-7006.2011.02199.x.
[10]Zhang Y,Sun B,Zhao X,et al.Clinical significances and prognostic value of cancer stem-like cells markers and vasculogenic mimicry in renal cell carcinoma.[J].J Surg Oncol,2013,108(6):414-419.doi:10.1002/jso.23402.
[11]Balachandran S,Adams G.Interferon-gamma-induced necrosis:an antitumor biotherapeutic perspective[J].J Interferon Cytokine Res,2013,33(4):171-180.doi:10.1089/jir.2012.0087.
[12]Kiyota T,Takahashi Y,Watcharanurak K,et al.Enhancement of anticancer effect of interferon-gamma gene transfer against interferongamma-resistant tumor by depletion of tumor-associated macrophages [J].Mol Pharm,2014,11(5):1542-1549.doi:10.1021/mp4007216.
[13]Zhang Z,Han Y,Song J,et al.Interferon-γ regulates the function of mesenchymal stem cells from oral lichen planus via indoleamine 2,3-dioxygenase activity[J].J Oral Pathol Med,2015,44(1):15-27.doi:10.1111/jop.12224.
[14]Sivanathan K,Gronthos S,Rojas-Canales D,et al.Interferon-gamma modification of mesenchymal stem cells:implications of autologous and allogeneic mesenchymal stem cell therapy in allotransplantation[J].Stem Cell Rev,2014,10(3):351-375.doi:10.1007/s12015-014-9495-2.
[15]Zhao D,Pan C,Sun J,et al.VEGF drives cancer-initiating stem cells through VEGFR-2/Stat3 signaling to upregulate Myc and Sox2 [J].Oncogene,2014 Aug 25.doi:10.1038/onc.2014.257.
[16]Xiao N,Qi X,Tang L,et al.VEGF promotes cardiac stem cells differentiation into vascular endothelial cells via the PI3K/Akt signaling pathway[J].Artif Cells Nanomed Biotechnol,2014,42(6):400-405.doi:10.3109/21691401.2013.837473.
[17]Li Q,Qiao G,Ma J,et al.Downregulation of VEGF expression attenuates malignant biological behavior of C6 glioma stem cells[J].Int J Oncol,2014,44(5):1581-1588.doi:10.3892/ijo.2014.2331.
(2014-12-10收稿 2015-01-25修回)
(本文编辑 闫娟)
Effects and mechanism of interferon-gamma on vasculogenic mimicry of melanoma cells
HAN Jian1,SUN Baocun1△,MA Yuemei2,ZHAO Xiulan1
1 Department of Pathology,Tianjin Medical University,Tianjin 300070,China;2 Department of Surgery,Tianjin Medical University
△Corresponding Author E-mail:sunbaocun@aliyun.com
Objective To investigate the effects of interferon-gamma(IFN-γ)on migration,invasion and vasculogenic mimicry(VM)formation of human melanoma cell line MUM-2B.Methods MUM-2B cells were divided into three groups,control group(10%FBS in DMEM),treatment group1(10 μg/L IFN-γ)and treatment group2(100 μg/L IFN-γ).Different concentrations of IFN-γ were added in the culture medium of MUM-2B cells.Wound-healing assay and matrigel invasion assay were performed to examine the migration and invasion ability of MUM-2B cells.Three-D culture was used to observe the VM formation.The expression of vascular endothelial growth factor(VEGF)of MUM-2B cells was detected by Western blot assay.Results The result of wound-healing assay showed that the migration distance of cells was decreased in treatment groups compared with that of control group.The migration distance of cells was decreased in treatment group2 compared with that of treatment group 1(P<0.05).The result of matrigel invasion assay showed that the number of invaded cells was decreased in treatment groups compared with that of control group,and which was significantly decreased in treatment group2 than that of treatment group1(P<0.05).The result of 3-D culture showed that cells in control group can form typical VM tube-like structures,whereas cells in treatment groups cannot.Western blot assay showed that the expression of VEGF protein was significantly decreased in treatment groups compared with that of control group,and the expression of VEGF protein was significantly decreased in treatment group2 than that of treatment group 1(P<0.05).Conclusion These data suggest that IFN-γ inhibits migration and invasion of MUM-2B cells,and inhibits VM formation by down regulating VEGF expression in vitro.
melanoma;interferon-gamma,recombinant;vascular endothelial growth factors;cancer stem cells;vasculogenic mimicry
R739.5
A DOI:10.11958/j.issn.0253-9896.2015.05.002
国家自然科学基金重点项目(81230050);天津市科委重点项目(10JCZDJC20400)
1天津医科大学病理学教研室(邮编300070);2天津医科大学外科手术学教研室
韩健(1983),男,助理实验师,硕士在读,主要从事肿瘤病理学研究
△E-mail:sunbaocun@aliyun.com

