肝移植术后急性排斥患者血清的蛋白质组学分析
蒋琪,茹雅维,李克秋,李光
肝移植术后急性排斥患者血清的蛋白质组学分析
蒋琪,茹雅维,李克秋,李光△
目的 寻找与肝移植术后急性细胞排斥反应(ACR)相关的血清蛋白标志物,并初探相应机制。方法 收集3例经肝移植手术、病理证实ACR患者血清为ACR组;3例肝移植术后、肝功能各项指标达到临床正常值,预后良好患者血清为No-ACR组;6例健康体检者血清等量混合后取出2份为Control组。应用蛋白质组学相关技术对血清蛋白质组进行分离,同位素标记相对与绝对定量(iTRAQ)技术筛选和鉴定出3组间的差异表达蛋白,并应用KEGG和STRING软件对其进行功能分析。结果 在ACR组与Control组间检出88个差异表达蛋白,No-ACR组与Control组间检出39个,ACR组与No-ACR组间检出10个;对比88个和10个差异表达蛋白,共同存在的有9个。88个差异表达蛋白中30个之间有直接的相互作用,并可被定位于软件中的13个信号通路,其中14个(46.67%)分布在补体和凝血级联反应通路;No-ACR组与Control组检出的39个差异表达蛋白中10个有直接相互作用,其中9个集中在补体和凝血级联反应通路。结论 应用蛋白质组学技术鉴定出的9种与ACR关系密切的差异表达蛋白,可作为开发ACR早期诊断标志物的候选蛋白;补体和凝血级联反应通路在肝移植术后被显著调节,预示与ACR的发生密切相关。
肝移植;血清;生物学标记;急性细胞排斥反应;蛋白标志物;同位素相对标记与绝对定量技术
自1963年Starzl首度将肝移植(liver transplantation,LT)技术应用于临床以来,历经半个世纪的发展,目前肝移植已成为治疗各种终末期肝病唯一有效的方法[1]。急性细胞排斥反应(acute cellular rejection,ACR)不仅是早期移植物失功的一个重要原因,而且也会影响移植物的长期存活。而如今由于强效免疫抑制剂的应用,临床ACR发生率明显降低,且发生ACR的临床症状、体征缺乏典型性,肝移植术后肝脏的一些其他病变和排斥反应的病理学表现重叠存在,使其早期诊断变得越发困难[2-4]。蛋白质组学具有高通量、高灵敏度、高效率的特性,已在多种重大疾病研究中发挥了重要作用,但在器官移植后辅助诊断排斥或耐受相关生物标志物领域应用较少[5-6]。本研究应用蛋白质组学及生物信息学技术对ACR、No-ACR患者及健康体检者的血清进行定量、筛选和鉴定,寻找与肝移植术后ACR相关的血清特异性表达标志物。
1 材料与方法
1.1 材料
1.1.1 血清 ACR组和No-ACR组血清来自天津市第一中心医院2013年1月—2014年12月行肝移植手术治疗的患者。经手术、病理学检查证实的ACR患者3例,男性,年龄42~65岁;肝移植术后、肝功能各项指标达到临床正常值、预后良好的No-ACR患者3例,男性,年龄37~63岁;同期选取健康体检者6例,男性,年龄35~65岁,为健康对照组(Control组)。
1.1.2 试剂 尿素(分析纯)为Gibco BRL公司产品;乙二胺四乙酸(EDTA,超纯)、苯甲基磺酰氟(PMSF,超纯)、考马斯亮蓝染料G250(超纯)、过硫酸胺(化学纯)购自Amesco公司;二硫素糖醇(DTT,化学纯)、碘乙酰胺(IAM,化学纯)购自Promega公司;丙烯酰胺(化学纯)、SDS(化学纯)、N,N,N′,N′-四甲基乙烯二胺(TEMED,分析纯)、溴酚蓝(分析纯)购自购自SIGMA公司;乙醇(分析纯)、乙酸(分析纯)、甲酸(质谱纯)购自北京化工厂;乙腈(质谱纯)、甲醇(质谱纯)购自Fisher Scientific公司;iTRAQ®Reagent-8Plex Multiplex Kit购自Applied Biosystem;strata-X C18除盐柱、SCX强阳离子交换柱Luna SCX 100A购自Phenomenex公司。双蒸水为华大蛋白实验室用MilliQ纯水仪制备。
1.1.3 仪器 岛津常规液相,戴安纳升液相,Thermo fisher Q-Exactive质谱仪,布鲁克 Ultra flex,UMAX Power look 2100XL-USB扫描仪,IKA振荡器,Tanon电泳槽,DYY-7C型电泳仪(北京六一仪器厂);恒温加热块(鼎国昌盛生物技术有限公司);离心机(eppendorf centrifuge 5417R型);LX-100手掌式离心机(其林贝尔仪器);电热恒温水浴锅(长安科学仪器);数据采集软件:Thermo fisher Proteome Discoverer 1.3;Mascot版本:2.3.0。
1.2 方法
1.2.1 血清收集 取3组研究对象清晨空腹肘正中静脉血3 mL。ACR患者在排斥期抽取;No-ACR患者在术后半年内抽取;Control组在体检时留取。于4℃放置60 min,2 000 r/min离心30 min,吸取血清,分装,于-80℃冰箱保存备用。
1.2.2 同位素标记相对与绝对定量(isobaric tags for relative andabsolute quantitation,iTRAQ)实验 为减少个体差异将Control组6个血清各取200 μL混合。分别在ACR组(3个)、No-ACR组(3个)、Control组(2个)各取250 μL,ProteoMiner去除血清中高丰度蛋白,提取蛋白质,使用Bradford法测量蛋白浓度。用胰酶消化蛋白质至肽段水平,使用iTRAQ试剂分别对8个样本进行标记(113~119、121),SCX分离肽段后进行质谱检测。
1.2.3 差异表达蛋白筛选 根据质谱检测数据,用Isobar软件对鉴定出的蛋白质进行相对定量分析,从而筛选出差异表达蛋白。设定的差异表达蛋白的定义标准是:(1)每个蛋白质拥有2个以上唯一肽段数(unique peptides)或者单一unique peptide具有两个以上谱图数。(2)2组中每份样本分别进行两两比对,所得到的每个比值应变化方向一致。(3)平均比值大于1.2或者小于0.83。
1.2.4 生物学分析 利用KEGG和STRING软件对筛选出的差异表达蛋白进行功能分析。
2 结果
2.1 ACR相关蛋白标志物的筛选 在ACR组与Control组之间筛选出88个差异表达蛋白,其中上调蛋白36个,下调蛋白52个;在No-ACR组与Control组之间筛选出39个差异表达蛋白,其中上调蛋白17个,下调蛋白22个;在ACR组与No-ACR组之间筛选出10个差异表达蛋白,其中上调蛋白3个,下调蛋白7个,见表1。将ACR组和Control组之间筛选出的88个差异表达蛋白与表1中差异表达蛋白进行比较,发现共同存在的差异表达蛋白共9个,包括3个上调蛋白和6个下调蛋白,见图1。这9种差异表达蛋白存在于2组差异表达蛋白的交集之中,即相对于健康人和预后良好患者而言,在ACR患者血清中他们的表达水平都发生了显著改变,且变化趋势一致,因此他们是理想的肝移植术后ACR相关蛋白标志物候选蛋白。
2.2 差异表达蛋白的功能分析 ACR组与Control组比较筛选到的88个差异表达蛋白中有30个蛋白质之间具有直接的相互作用,并可以被定位于软件中的13个信号通路:神经活性配体-受体相互作用(Neuroactive ligand-receptor interaction)、溶酶体(Lysosome)、补体和凝血级联反应(Complement and coagulation cascades)、蛋白质消化和吸收(Protein digestion and absorption)、ECM-受体相互作用(ECM-receptor interaction)、趋化因子信号通路(Chemokine signaling pathway)、细胞因子-细胞因子受体相互作用(Cytokine-cytokine receptor interaction)、肌动蛋白细胞骨架的调控(Regulation of actin cytoskeleton)、黏着斑(Focal adhesion)、非洲锥虫病(African trypanosomiasis)、系统性红斑狼疮(Systemic lupus erythematosus)、金黄色葡萄球菌(Staphylococcus aureus infection)和阿米巴疾病(Amoebiasis)。其中14个差异表达蛋白分布在补体和凝血级联反应(浅绿色表示)系统,占46.67%,见图2。同理,在No-ACR组与Control组中鉴定到的39个差异表达蛋白中,10个有直接相互作用的差异表达蛋白9个集中在补体和凝血级联反应(浅绿色表示)通路,占总数的90%,见图3。
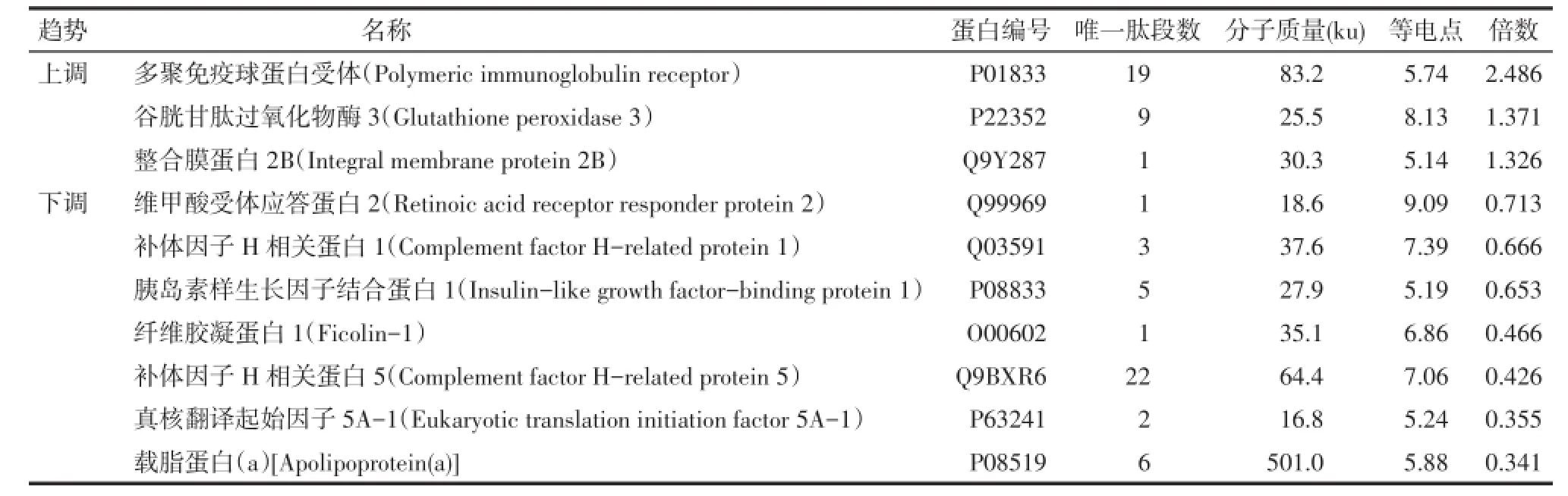
Tab.1 Comparison of differentially expressed proteins in serum between ACR group and No-ACR group after liver transplantation表1 肝移植后ACR组与No-ACR组比较血清中差异表达蛋白
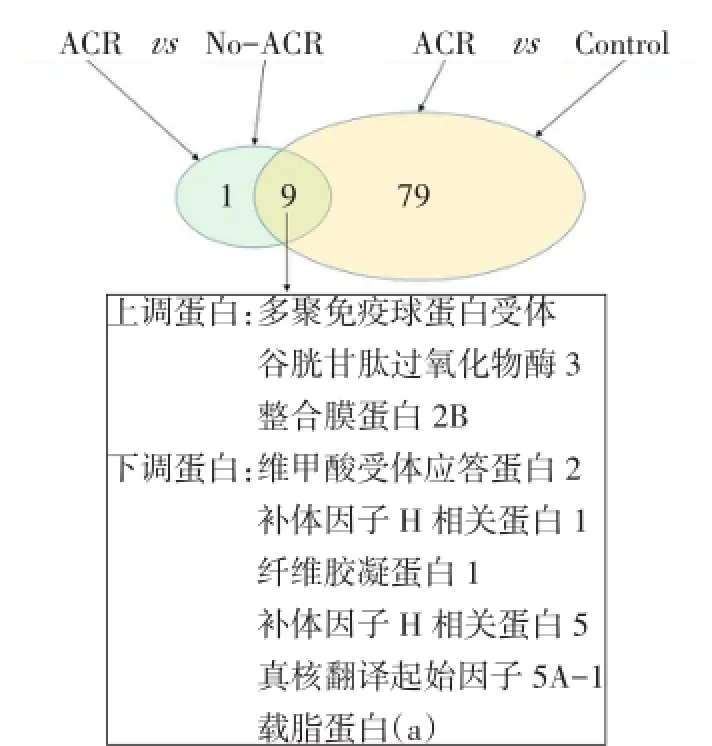
Fig.1 Screening of differentially expressed proteins related with ACR图1 ACR相关差异表达蛋白的筛选
3 讨论
ACR通常发生于移植后早期,一般为6周以内,ACR的诊断通常要依靠病理学检查,但由于穿刺活检的有创性限制了其临床应用,寻找可靠的诊断标志物可以帮助解决这一难题[4]。通常认为肝移植后ACR是细胞介导的免疫反应,但近年来研究发现,ACR阶段的移植肝与移植心脏和移植肾一样,组织内也有补体成分沉积[7]。体液免疫、细胞免疫及补体等多种免疫组分都参与ACR的发生。这些免疫组分通过血液循环在全身或局部发挥作用,因此血清中极有可能存在相关免疫成分,可以作为可靠的诊断标志物,协助早期诊断ACR[2,8-9]。补体系统作为机体最重要的非特异性免疫屏障,是构成免疫系统的重要组成部分。炎症及组织损伤都可以激活补体系统。不仅可以由抗原抗体反应经典途径激活,也可以由组织损伤碎片经旁路途径激活[10-11]。有研究报道,补体系统激活后可引起肝移植术后排斥反应的发生,C4和C1q都是ACR的独立预测标志物,C4的预测价值最高,他们都集中在补体经典通路中[12-13]。
本研究结果显示,2组差异表达蛋白(ACR与Control、No-ACR与Control)均在补体和凝血级联反应通路发生显著变化,提示补体和凝血级联反应通路在肝移植术后被强烈地激活或抑制,该通路的变化与肝移植术后免疫状态的产生有密切的联系。而且,图1中有9个ACR候选蛋白标志物,其中补体因子H相关蛋白(CFHR)1和CFHR5在ACR组中表达呈显著下调,他们在补体系统中发挥着重要的作用,因此笔者认为CFHR1和CFHR5可以作为进一步研究肝移植术后急性排斥相关机制的突破口,为诱导免疫耐受提供新的思路。
CFHR家族包括 5个血浆蛋白:CFHR1、CFHR2、CFHR3、CFHR4和CFHR5,属于补体调节蛋白,这些蛋白都与中心补体成分C3b相连,对于补体旁路途径的调节具有重要作用[14-15]。CFHR1可以与C5转化酶的C3b成分结合,从而阻止末端通路。另外,CFHR1还可以与H因子竞争性结合C3b。因此,CFHR1的表达下调,会减弱对C5分裂的抑制作用[16],不能及时抑制活化的补体系统,从而在某种程度上引发了ACR。CFHR5可以与H因子竞争性结合C3b,也能与C3b分裂产物iC3b结合。另外,CFHR5还与C反应蛋白(CRP)结合,通过CRP灭活C3b[16]。因此,CFHR5表达的降低也会引起补体调节系统的紊乱,与ACR的发生密切相关。
对表达下降的补体调节蛋白CFHR1和CFHR5进行深入的研究,将有利于进一步揭示肝移植术后急性排斥发生的分子机制。然而,要明确这两个蛋白的功能及适用于临床的检测方法,为ACR的早期诊断和应用药物靶向性治疗提供可靠的理论依据,还需要扩大样本量深入探究。
(图2、3见插页)
[1]Song AT,Avelino-Silva VI,Pecora RA,et al.Liver transplantation: fifty years of experience[J].World J Gastroenterol,2014,20(18): 5363-5374.doi:10.3748/wjg.v20.i18.5363.
[2]Rodriguez-Peralvarez M,Garcia-Caparros C,Tsochatzis E,et al.Lack of agreement for defining'clinical suspicion of rejection'in liver transplantation:a model to select candidates for liver biopsy[J].TransplInt,2015,28(4):455-464.doi:10.1111/tri.12514.
[3]Gehrau RC,Mas VR,Suh JL,et al.Liver transplant complications in hepatitis C infected recipients:recurrence versus rejection[J].Expert Rev GastroenterolHepatol,2014,8(5):453-456.doi:10.1586/ 17474124.2014.898562.
[4]de la Peña-Moral JM,Pons JA,Tome S,et al.Acute cellular rejection versus recurrent hepatitis C after liver transplantation:Clinical and pathological features driving a rational diagnostic approach[J].Hepatol Res,2015,45(4):423-431.doi:10.1111/hepr.12369.
[5]Germani G,Rodriguez-Castro K,Russo FP,et al.Markers of acute rejection and graft acceptance in liver transplantation[J].World J Gastroenterol,2015,21(4):1061- 1068.doi:10.3748/wjg.v21.i4.1061.
[6]Ren Z,Jiang J,Lu H,et al.Intestinal microbial variation may predict early acute rejection after liver transplantation in rats[J].Transplantation,2014,98(8):844-852.doi:10.1097/TP.0000000000000334.
[7]Dugum M,Askar M,Pai RK,et al.Re-examination of sinusoidal deposition of complement 4d in liver allografts:experience from a single institution[J].Int J Clin Exp Pathol,2014,7(2):784-791.
[8]Bentall A,Tyan DB,Sequeira F,et al.Antibody-mediated rejection despite inhibition of terminal complement[J].TransplInt,2014,27 (12):1235-1243.doi:10.1111/tri.12396.
[9]Shi YC,Sun YL,Liu ZW,et al.Characteristics of Tfh cells in the peripheral blood in recipients of liver allograft:A pilot study[J].Med J Chin PLA,2014,39(12):965-968.[石彦超,孙艳玲,刘振文,等.肝移植患者外周血Tfh细胞特征的初步研究[J].解放军医学杂志,2014,39(12):965-968].
[10]Verhelst XP,Troisi RI,Colle I,et al.Biomarkers for the diagnosis of acute cellular rejection in liver transplant recipients:A review[J].Hepatol Res,2013,43(2):165-178.doi:10.1111/hepr.12012.
[11]Fossati-Jimack L,Ling GS,Baudino L,et al.Intranasal peptide-induced tolerance and linked suppression:consequences of complement deficiency[J].Immunology,2015,144(1):149-157.doi:10.1111/ imm.12358.
[12]Massoud O,Heimbach J,Viker K,et al.Noninvasive diagnosis of acute cellular rejection in liver transplant recipients:a proteomic signature validated by enzyme-linked immunosorbentassay[J].Liver Transpl,2011,17(6):723-732.doi:10.1002/lt.22266.
[13]Touzot M,Obada EN,Beaudreuil S,et al.Complement modulation in solid-organ transplantation[J].Transplant Rev(Orlando),2014,28 (3):119-125.doi:10.1016/j.trre.2014.03.001.
[14]Chen Q,Wiesener M,Eberhardt HU,et al.Complement factor H-related hybrid protein deregulates complement in dense deposit disease[J].JClin Invest,2014,124(1):145-155.doi:10.1172/ JCI71866.
[15]Skerka C,Chen Q,Fremeaux-Bacchi V,et al.Complement factor H related proteins(CFHRs)[J].MolImmunol,2013,56(3):170-180.doi:10.1016/j.molimm.2013.06.001.
[16]Jozsi M,Meri S.Factor H-related proteins[J].Methods Mol Biol,2014,1100:225-236.doi:10.1007/978-1-62703-724-2_18.
(2015-02-11收稿 2015-03-11修回)
(本文编辑 陈丽洁)
Proteomic analysis of the serum from patients with acute rejection after liver transplantation
JIANG Qi,RU Yawei,LI Keqiu,LI Guang△
Tianjin Medical University,Tianjin 300070,China
△Corresponding Author E-mail:heshengguang@hotmail.com
Objective To investigate the protein markers that specifically expressed in patients with acute rejection (ACR)after liver transplantation,and to explore preliminarily the mechanisms.Methods Serum samples from three patients with pathologically confirmed ACR after liver transplantation in Tianjin First Central Hospital were collected as ACR group.Three serum samples from patients with normal liver function indicators after liver transplantation were collected as No-ACR group.And six serum samples from healthy examination were mixed with equal amount as healthy control group.Isobaric Tags for Relative and Absolute Quantitation(iTRAQ)was employed to separate,screen and identify the differentially expressed proteins between three groups.KEGG and STRING software were applied to deeply analyze the data of three groups.Results A total of 88 differentially expressed proteins were found between ACR group and healthy control group.There were 39 differentially expressed proteins between No-ACR group and healthy control group.Ten differentially expressed proteins were acquired between ACR group and No-ACR group.Comparing 88 and 10 differentially expressed proteins,9 proteins were the same.Among 88 differentially expressed proteins,30 of them showed a direct interaction,and can be positioned in 13 signaling pathways based on KEGG and STRING software.Fourteen(46.67%)of the 30 proteins were located in the complement and coagulation cascade pathway.Among 39 differentially expressed proteins,which were detected between No-ACR group and control group,10 proteins showed a direct interaction including 9 proteins concentrated in the complement and coagulation cascade pathway.Conclusion By proteomic analysis,nine differentially expressed proteins are obtained,which may be regarded as the candidate bio-markers for ACR early diagnosis after liver transplantation.The complement and coagulation cascades system is significantly adjusted after liver transplantation,indicating this pathway plays an important role in the occurrence of ACR.
liver transplantation;serum;biological markers;acute cellular rejection;protein biomarkers;isobaric tags for relative andabsolute quantitation
R392.4
A DOI:10.11958/j.issn.0253-9896.2015.05.001
国家高技术研究发展计划(863计划)资助项目(2012AA021003);国家自然科学基金资助项目(21177091);天津市科技计划项目(12ZCZDSY03400)
天津医科大学(邮编300070)
蒋琪(1985),女,硕士在读,主要从事器官移植免疫耐受研究
△E-mail:heshengguang@hotmail.com
—— “T”级联

