铅离子对轮叶黑藻生长的毒性影响
韩晓弟, 刘 丹
(1.山东大学海洋学院,山东 威海 264209;2.山东省林木种质资源中心,济南 250014)
· 试验研究 ·
铅离子对轮叶黑藻生长的毒性影响
韩晓弟1, 刘丹2
(1.山东大学海洋学院,山东 威海264209;2.山东省林木种质资源中心,济南250014)
以常见多年生沉水植物轮叶黑藻(Hydrillaverticillata)为材料,探讨水体重金属Pb2+对其生长的影响及各项生理生化指标的变化。比较研究了不同浓度(0.01,0.05,0.10,0.20mg/L)的Pb2+对轮叶黑藻的胁迫影响,包括叶绿素、叶绿素a/b比值、可溶性糖、脯氨酸、丙二醛等指标的变化。结果表明:在Pb2+胁迫下,黑藻叶片呈现不同程度的枯黄萎蔫现象,其程度随着处理浓度的增高而加重;叶绿素a和叶绿素b含量及叶绿素a/b值降低;脯氨酸、可溶性糖及丙二醛含量升高,试验表明Pb2+对轮叶黑藻生长的毒性影响明显。
轮叶黑藻;铅离子;脯氨酸;叶绿素;丙二醛;可溶性糖;毒理学
随着工业污水和人类生活废水的排放,重金属污染越来越突出,有关重金属对生物的毒害作用及机理的研究也日趋增加。铅是污染物中毒性很大的一种重金属元素,低浓度的Pb2+对植物的代谢过程或酶的活性具有一定促进作用,但是在高浓度和长时间胁迫时,对植物会产生明显的伤害作用[1]。同时,铅对人类健康危害较大,进入人体后主要积蓄在骨骼、动脉、肝、肾、胰和肺中,也可进入脑部[2],铅能置换骨骼中的钙而储存在骨中,可对人的中枢和外周神经系统、血液系统、肾脏、心血管系统和生殖系统等多个器官和系统造成损伤,而且具有一定致突变和致癌性[3,4]。研究表明,铅会导致植物体内活性氧自由基水平急剧上升,当这种自由基超出植物体活性氧清除酶清除能力时,氧自由基将会对植物产生危害,影响植物的生长发育,严重时致植物死亡[5]。
作为水生态系统中主要的初级生产者之一,高等水生植物具有重要的环境净化功能,不仅可去除N、P等营养物质和有机污染负荷,还可吸附、吸收污水中的重金属和有害元素[6]。多数水生植物能吸附并积累重金属,对水环境起到净化作用。一般情况下水生植物净化能力的大小是:沉水植物>漂浮植物和浮叶植物>挺水植物[7],因此,一些水生植物常用于构建人工湿地或植物塘[8~10],以达到减轻地表水体污染的目的。
轮叶黑藻隶属于水鳖科(Hydrocharitaceae)、黑藻属(Hydrilla),多年生沉水植物[11]。具有耐污能力和适应性强等特点,在国内外富营养化水体治理和生态修复中已经得到了广泛的应用,同时,轮叶黑藻对重金属具有很强的吸收积累能力[12]。鉴于轮叶黑藻在生物多样性及生态环境保护等诸多领域的的重要性,利用植物生理生化手段测定叶绿素、叶绿素a/b比值、可溶性糖、脯氨酸、丙二醛等毒理学指标的变化,研究Pb2+对轮叶黑藻生长发育的影响,为探讨重金属对植物的胁迫机理及植物对其逆境的反应机制提供理论依据。
1 材料与方法
1.1实验材料
轮叶黑藻采集于威海市环山路陶家夼隧道周围某小型池塘,由第一作者鉴定,标本保存在山东大学(威海)植物标本室。实验用化学试剂均为分析纯。
1.2实验仪器
紫外分光光度计(澳大利亚产,VARIAN-50型 ),离心机(TDL-5-A,上海安亭科学仪器厂)。
1.3铅离子浓度设计
实验设对照组和4个浓度梯度的实验组。用Pb(NO3)2配制质量浓度分别为0.01,0.05,0.10,0.20mg/L的Pb2+培养液,以纯净水作为对照。各浓度实验组均设五次重复,生理生化指标的测定结果为5次重复的平均值。
铅离子浓度设置依据:中华人民共和国国家环保总局发布的地表水环境质量标准(GB 3838-2002):Ⅰ类水铅含量≤0.01mg/L,Ⅴ类水铅含量≤0.1mg/L(pH要求在6~9之间)。
1.4材料处理
选择生长状况相似的黑藻分别放入装有不同Pb2+浓度的容器中,室温下培养,共培养5d,每隔24h观察轮叶黑藻的外部形态变化,并分别测量轮叶黑藻的生理生化指标。每天测量一次各培养液的pH值,以保证实验的有效性。
1.5生理指标测试
1.5.1植株叶片伤害症状观察
每隔24h观察轮叶黑藻的生长状况,叶片颜色及萎蔫变化等外部形态指标。
1.5.2叶绿素浓度测定
叶绿素含量测定采用分光光度法[13](稍有改动)。
1.5.3脯氨酸含量测定
脯氨酸含量测量选用酸性茚三酮法[14,15]。
脯氨酸含量计算公式: y(mg/g) =(876.399*D520-7.151)*10mL/1000/样品质量(g)。
1.5.4丙二醛含量测定
以硫代巴比妥酸法测量丙二醛含量[14,15]。
丙二醛含量计算公式:y(mg/g)={6.45(D532-D600)-0.56*D450}*5mL/1000/样品质量(g)。
1.5.5可溶性糖含量测定
用蒽酮法[13](稍有改动)可溶性糖含量。
可溶性糖含量:y(mg/g)=(138.666*D630-4.119)*10mL/1000/样品质量(g)。
1.5.6实验数据的统计处理
实验所得数据求平均值,将数据利用SPSS软件,按照方差分析法进行处理分析,检测不同处理的样品间及与对照间的差异显著性。数据显示均为平均值加减标准误差。
2 实验结果与分析
2.1外部形态伤害症状
实验前各组轮叶黑藻生长状况良好。1d后,在最高浓度处理组中的轮叶黑藻叶片有轻微的褪色现象出现,与对照组植株叶片相比颜色偏黄。随着处理时间的延长,植物体的褪色现象逐渐增大,各实验组植株叶片均出现了程度不一的褪色现象,处理浓度越高叶片褪色越明显。其中,铅离子浓度为0.05mg/L、0.1mg/L和浓度为0.2mg/L的处理组在实验后期叶片呈现不同程度的枯黄萎蔫,其程度随着处理浓度的增高而加重。铅离子浓度为0.2mg/L处理组植株茎由初时的绿色转为黄绿色,个别萎蔫叶片甚至有脱落现象出现。
2.2实验数据的统计学分析
将所得数据利用SPSS软件,采用单因素方差分析法进行检验,所得结果如下表:
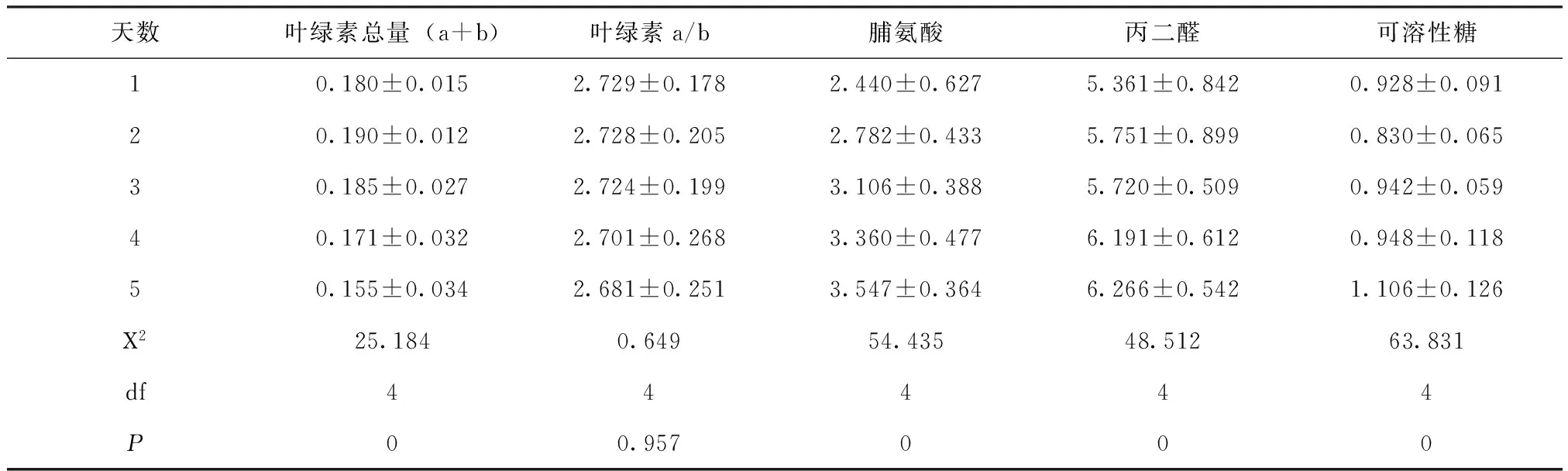
表1 不同处理时间对测量值的影响
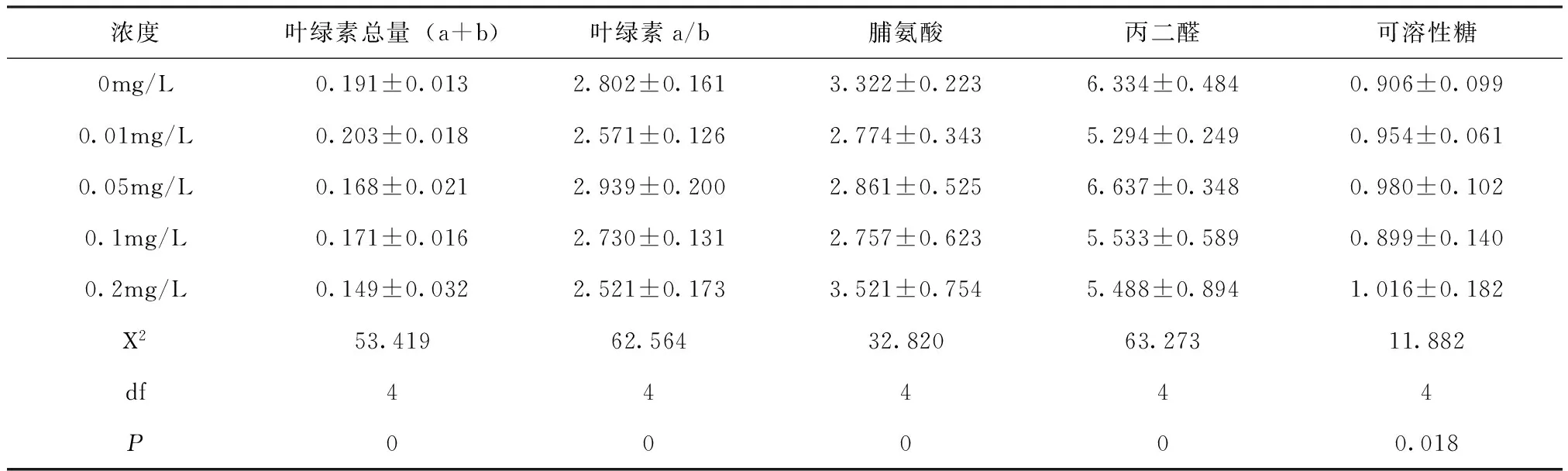
表2 不同铅离子浓度对测量值的影响
由表1可以看出,各生理指标随着时间推移而发生变化,其中叶绿素总量随时间逐渐降低,脯氨酸、丙二醛及可溶性糖含量随时间逐渐升高,卡方检验结果P值均小于0.05,测量值随时间变化显著;而叶绿素a/b的P值大于0.05,其随处理时间降低不明显。
由表2得知,叶绿素总量和叶绿素a/b的值随处理浓度升高而下降,脯氨酸、丙二醛和可溶性糖含量随处理浓度升高而不断增加。5项生理指标的卡方检验结果P值均小于0.05,可见处理浓度的变化对各生理指标的影响显著。
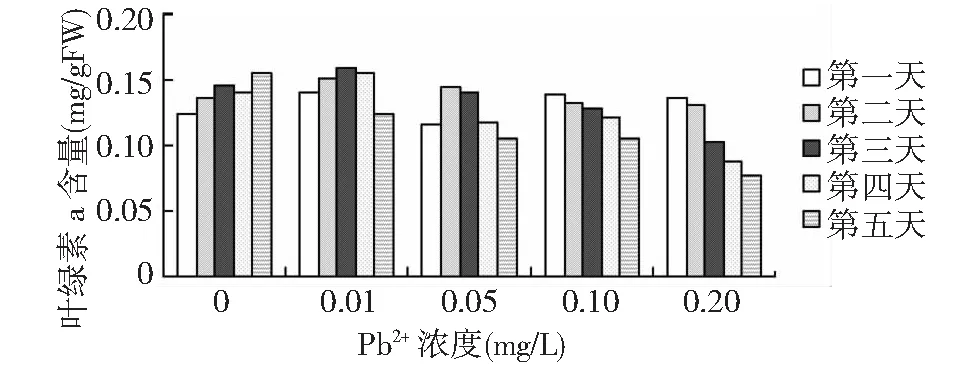
图1 不同浓度Pb2+ 对叶绿素a含量的影响Fig.1 Effects of different Pb2+ concentrations on Chla contents
2.3铅胁迫下轮叶黑藻叶绿素含量变化
不同铅离子浓度对叶绿素含量的影响见下图。
据图1和图2所示,经铅离子处理的各浓度组轮叶黑藻植株的叶绿素a和叶绿素b含量是随着时间的延长而下降,其中铅离子浓度为0.01mg/L和0.05mg/L的处理组叶绿素a及叶绿素b含量,先产生了小幅的增加,而后下降,并且浓度0.05mg/L的处理组的叶绿素含量更早下降;铅离子浓度为0.1mg/L和0.2mg/L浓度组随时间延长逐渐下降,不同铅离子浓度处理组黑藻叶绿素含量下降幅度不同,即随着铅离子处理浓度的增大叶绿素a和叶绿素b含量显著降低。
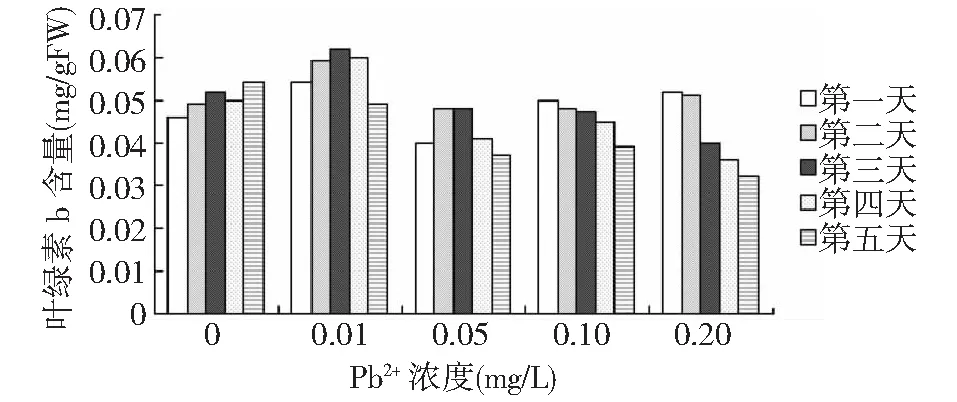
图2 不同浓度Pb2+对叶绿素b含量的影响Fig.2 Effects of different Pb2+ concentrations on Chlb contents
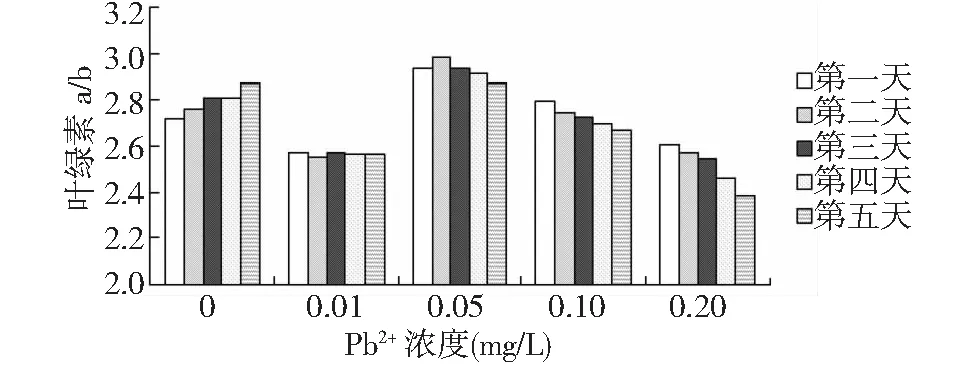
图3 不同浓度Pb2+对叶绿素a/b的影响Fig.3 Effects of different Pb2+ concentrationons on Chla/b
由图3可以看出,叶绿素a与叶绿素b的比值随着处理时间段延长而逐渐下降,铅离子浓度为0.01mg/L时叶绿素a/b的值变化趋势较平缓,而后其余3个实验组的叶绿素a/b值则随着铅离子培养液浓度的增大下降幅度越来越大。叶绿素a/b比值降低时,叶绿体2,6-二酚还原能力增强,叶绿体光合磷酸化活性提高,光合能力增强[16],叶绿素a对活性氧的反应较叶绿素b敏感,因而更易分解破坏。
2.4铅胁迫下轮叶黑藻脯氨酸含量变化
铅离子浓度为0.1mg/L和浓度为0.2mg/L的处理组脯氨酸含量在第二天出现跳跃性的增加,而后趋于舒缓。高浓度处理组轮叶黑藻的脯氨酸增加幅度明显大于低浓度组(图4)。脯氨酸常以游离状态广泛存在于植物体内,当植物受到环境胁迫时,植物体内游离的脯氨酸积累增加[17],脯氨酸是体内重要的代谢调节物。在逆境条件下植物体内脯氨酸变化对其抗逆具有重要意义[18]。
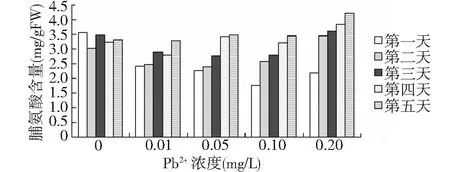
图4 不同浓度铅离子对脯氨酸含量的影响Fig.4 Effects of different Pb2+ concentrations on Proline contents
2.5铅胁迫下轮叶黑藻丙二醛含量变化
丙二醛含量的变化趋势表现为随着时间延长,MDA含量逐渐增大,变化趋势明显大于对照组。不同铅离子浓度,MDA含量增加幅度不同,低浓度处理组MDA含量的变化相对较缓,差异不够显著。而0.05mg/L、0.1mg/L和0.2mg/L的处理组MDA含量变化趋势则越来越显著(图5)。

图5 不同浓度铅离子对丙二醛含量的影响Fig.5 Effects different Pb2+ concentrations on MDA content
2.6铅胁迫下轮叶黑藻可溶性糖含量变化
图6表明,实验组的轮叶黑藻植株可溶性糖含量第二天和第一天相比都有一个小幅度的下降,而后都随时间的延长而逐渐升高。随着铅离子浓度的增大,轮叶黑藻植株可溶性糖含量增加幅度不一,高浓度处理组可溶性糖增加量幅度明显高于低浓度处理组。
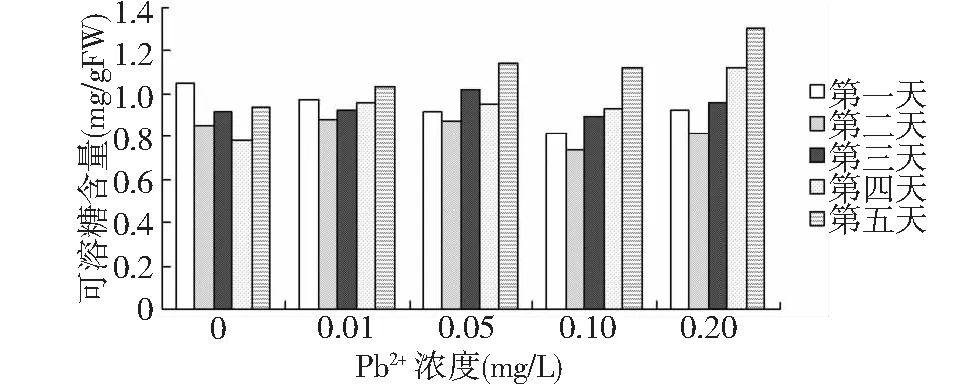
图6 不同浓度铅离子对可溶性糖含量的影响Fig.6 Effects of different Pb2+ concentration on soluble sugar content
3 讨 论
铅离子溶液处理后,无论是从轮叶黑藻的外观的褪色萎蔫程度或是叶绿素的含量、可溶性糖含量、脯氨酸和丙二醛的含量变化都可看出,重金属铅离子对轮叶黑藻生长的影响显著。
3.1铅离子对轮叶黑藻外观影响
正常生长的轮叶黑藻植株呈深绿色,受到重金属离子的胁迫作用后,植株叶片的颜色就会随之逐渐改变,由深绿色逐渐变为黄绿色,当抑制效应较强时,植株会继续褪色至枯黄色,甚至萎蔫;处理浓度与伤害程度呈显著正相关。植株褪色的原因可能是,重金属引起的超量活性氧自由基将叶绿素作为靶分子,致使叶绿索结构破坏、叶片失绿[19,20]。
3.2铅离子对轮叶黑藻叶绿素含量影响
叶绿素的含量受多种逆境的胁迫而下降。有研究表明,轮叶黑藻经重金属Cd、Pb处理后,叶绿体膜系统会遭到破坏,在低浓度处理下,叶绿体的基粒片层稀疏,层次减少;高浓度下,膜系统开始破坏,叶绿体功能丧失[21~23],从而阻碍了叶绿素的合成。轮叶黑藻在重金属离子浓度相对较低的情况下,会对其产生一定的刺激作用,以促进其体内过氧化氢酶、过氧化物酶等的活性,从而使光合作用在逆境条件下有异常升高的现象[24,25],这可能是叶绿素合成系统对低浓度重金属毒害的一种应激反应[26]。据研究,在叶绿素中,叶绿素a对活性氧的反应较叶绿索b敏感[27,28],叶绿索a不及叶绿素b稳定,因而更易分解破坏。
3.3铅离子对轮叶黑藻丙二醛含量的影响
丙二醛(MDA)是衡量膜脂过氧化程度的重要指标,丙二醛的含量越高表明细胞膜的过氧化越快[29],在正常情况下,活性氧对植物的毒害作用被活性氧清除系统的活性所平衡,不会存在超氧自由基的积累[30]。逆境胁迫下,黑藻体内活性氧清除系统发生改变,破坏了活性氧产生和清除的平衡关系[31],导致细胞膜系统的严重损伤[32]。随着重金属离子浓度的加大和处理时间的延长丙二醛的含量显著增加,这可能是黑藻对于胁迫的反应。由于POD对氧自由基的清除防御保护作用有限,逆境中轮叶黑藻植物体的膜脂过氧化程度加剧,远远超出了POD的保护能力,造成细胞内自由基累积,引起MDA含量上升。
3.4铅离子对轮叶黑藻脯氨酸及可溶性糖含量的影响
与丙二醛一样,脯氨酸的含量变化也能用来判断植物组织受到伤害的严重程度。游离脯氨酸在逆境条件下的积累对植物具有保护作用,稳定细胞内的蛋白质[33]、螯合重金属[34],抑制脂类过氧化反应[35]。实验中轮叶黑藻脯氨酸含量随铅离子处理浓度增加,符合上述理论。
可溶性糖作为植物组织中又一重要的渗透调节物质,主要来源于淀粉等碳水化合物的水解[36]。研究表明,逆境胁迫下植物渗透调节物质可溶性糖的增加可以降低植物体内的渗透势,有利于植物体在逆境干旱逆境中维持体内正常代谢的所需水分,提高植物的抗逆适应性。可溶性糖含量增加,可以增强植物体的渗透调节能力以抵御重金属离子胁迫造成的危害。
综上所述,叶绿素含量的变化是由于重金属离子对轮叶黑藻光合作用体系的损害;脯氨酸含量变化反映了重金属离子对代谢过程的影响;丙二醛含量的变化反应了植物体抗氧化能力及膜脂过氧化程度;可溶性糖含量的变化可以体现重金属胁迫下细胞的渗透调节作用。合理有效的利用轮叶黑藻等沉水植物资源,充分发挥它们在环境保护中作用,对水体净化和修复及水生生态系统的多样性和稳定性的保护具有重要意义[37]。
[1]王锦文,白秀,陈锦峰,等.复合重金属Pb/Zn对香樟生理特征的影响[J].安徽农业科学,2009,37(21):10253-10254,10257.
[2]张晓枫.微量元素铅与人体健康的关系[J].数理医药学杂志,2004,17(5):473-474.
[3]Wierzbieka M.Comparison of lead tolerance in Allium cepa with other p1ant species[J].Environmental Pollution,1999,l04:41-52.
[4]徐进,徐立红.环境铅污染及其毒性的研究进展[J].环境与职业医学,2005,22(3):271-274.
[5]王慧忠,何翠屏.重金属胁迫对草坪草根系生长及其活力的影响[J].中国草地,2002,24(3):55-63.
[6]郭静,阮宜纶,林荣忱.水生植物对地热废水净化作用的研究[J].环境科学学报,1995,15(2):251-255.
[7]韩阳,李雪梅,朱颜姝,等.环境污染与植物修复功能[M].北京:化学工业出版社,2005.
[8]Alaerts G,Mahbubar R,Kelderman P.Performance analysis of a fullscale duckweed-covered sewage laguon[J].WaterResearch,1996,30(4):843-852.
[9]成水平,夏宜垮.香蒲、灯心草人工湿地的研究:Ⅲ.净化污水的机理[J].湖泊科学,1998,10(2):66-71.
[10]贺锋,吴振斌.水生植物在污水处理和水质改善中的应用[J].植物学通报,2003,20(6):641-647.
[11]中国科学院中国植物志编辑委员会.中国植物志(第八卷)[M].北京:科学出版社,1992.
[12]黄亮,李伟,吴莹,等.长江中游若干湖泊中水生植物体内重金属分布[J].环境科学研究,2002,15(6):1-4.
[13]郝建军,康宗利,于洋.植物生理学实验技术[M].北京:化学工业出版社,2006.
[14]陈建勋,王晓峰.植物生理学实验指导(第2版) [M].广州:华南理工大学出版社,2006.124.
[15]中国科学院上海植物生理研究所,上海市植物生理学会.现代植物生理学实验指南[M].北京:科学出版社,1999.305-306.
[16]左宝玉,匡延云.一些高等植物功能叶光合器官的结构和功能[J].植物学集刊,1994,(7):1-20.
[17]辛国荣,董美玲.水分胁迫下植物乙烯、脯氨酸积累、气孔反应的研究现状[J].草业科学,1997,14(2):62-66.
[18]刘根红,谢应忠,兰剑,等.NaCl、水分复合胁迫下宁夏5种禾本科牧草幼苗体内脯氨酸含量的变化[J].农业科学研究,2008,29(1):31-34.
[19]赵会杰,李兰其,朱元集,等.羟自由基对小麦叶片的氧化损伤及外源抗氧化剂的防护效[J].作物学报,1999,25(2):174-180.
[20]何翠屏,王慧忠.重金属镉、铅对草坪植物根系代谢和叶绿素水平的影响[J].湖北农业学,2003,(5):60-63.
[21]Yang J R,He J X,Jiang W R.Effect of Cd pollution on the physiology and biochemistry of plant[J].Agro-Environ Protection,1995,14(5):193-197.
[22]彭鸣.铅污染对叶绿体膜系统的影响[J].中国环境科学,1991,6:426-431.
[23]Jiang X Y,Zhan K F.Mechanism of heavy metal injury and resistance of Plants[J].Chinese Journal of Applied & Environmental Biology,2001,7(1):92-99.
[24]郝怀庆,施国新,杜开和,等.镉污染对水鳖的毒害作用[J].西北植物学报,2001,2l(6):1237-1240.
[25]Patra J,Lenka H,Panda B B.Tolerance and co-tolerance of the grass Chloris barbala to mercury,cadmium and zinc[J].New Phytol,1994,128:165-171.
[26]常福辰,施国新,吴国荣,等.汞、锡复台污染对金鱼藻的影响及其抗性机制的探讨[J].广西植物,2002,22(5):453-457.
[27]林植芳,李双顺,林桂珠,等.水稻叶片的衰老与超氧物歧化酶活性及脂质过氧化作用的关系[J].植物学报,1984,26(6):605-615.
[28]伍泽堂.超氧自由基与叶片衰老时叶绿素破坏的关系[J].植物生理学通讯,1991,27(4):277-279.
[29]冯琛,路新枝,于文功.逆境胁迫对条斑紫菜生理生化指标的影响[J].海洋湖沼通报,2004,(3):22-26.
[30]罗广华,王爱国.高浓度氧对水稻幼苗的伤害及活性氧的防御酶[J].中国科学院华南植物研究所集刊,1989,(4):169-176.
[31]高桂花,王瑞兵,刘艳芳,等.低温胁迫下玉米幼苗生理变化的研究[J].河北农业科学,2006,10(4):16-19.
[32]江福英,李延,翁伯琦植物低温胁迫及其抗性生理[J].福建农业学报,2002,17(3):190-195.
[33]Shah K,Dubey R S.Effect of Cadmium on Proline Accumulation and Ribon-clease Activity in Rice Seedlings:Role of Proline as a Possible Enzyme Protectant[J].Biologia Plantarum,1998,40:121-130.
[34]Farago M E,Mullen W A.Plants Which Accumulate Metals.Part IV.A Possible Copper-Pro1ine Complex from the Roots of Armeria maritime[J].Jnorganica Chimica Acta,1979,32:L93-L9.
[35]Mehta S K,Gaur J P.Heavy-Metal-Induced Proline Accumulation and its Role in Ameliorating Meta1 Toxicity in Chlorella Vulgaris[J].New Phytologist,1999,143:253-259.
[36]何若韫.植物低温逆境生理[M].北京:中国农业出版社,1995.
[37]邓义样,张爱军.试论藻类在水体污染监测中的运用[J].环境与开发,1999,14(1):43-45
Toxicological Effect of Pb2+on the Growth of Hydrilla Verticillata
HAN Xiao-di1,LIU Dan2
(1.MarineCollege,ShandongUniversutyatWeihai,Weihai,Shandong264209,China;2.ShandongForestGermplasmResourcesCenter,Jinan250014,China)
In this paper, Hydrilla verticillata, as one kind of common perennial submerged plants, were used to explore the effect of Pb2+in water on the growth and the physiological and biochemical indices Different concentrations (0.01, 0.05, 0.10, 0.20 mg/L) of Pb2+were used for comparative study of their effects on Hydrilla verticillata, including changes of their chlorophyll, chlorophyll a/b ratio, soluble sugar, proline, MDA and other indices. The results showed that: leaves of Hydrilla verticillata had presented different degrees of yellow wilting phenomenon with Pb2+, aggravated with the increased concentration of Pb2+; content of chlorophyll a and chlorophyll b and chlorophyll a/b ratio decreased with the increased concentration of Pb2+;content of proline, soluble sugar and MDA increased with the increased concentration of Pb2+. This test showed significant toxicological effects of Pb2+on the growth of Hydrilla verticillata.
Hydrilla verticillata;Pb2+;proline;chlorophyll;malondialdehyde;soluble sugar;Toxicology
2014-12-20
山东省林木种质资源中心资助课题(1070432121202、1070413421414)。
韩晓弟(1963-),男,山东莱州市人,1987年毕业于山东大学植物学专业,理学硕士,副教授,研究方向为植物生物学、植物毒理学。
X172
A
1001-3644(2015)02-0020-06

