超声波处理硅藻中细胞的完整性研究
姚娟娟,杨 峰,黄东洪,汪顺帆,张咏雪,陈龙甫
(三峡库区生态环境教育部重点实验室,重庆大学,重庆 400045)
· 试验研究 ·
超声波处理硅藻中细胞的完整性研究
姚娟娟,杨峰,黄东洪,汪顺帆,张咏雪,陈龙甫
(三峡库区生态环境教育部重点实验室,重庆大学,重庆400045)
硅藻水华问题是目前三峡库区亟待解决的一个重要问题,本文通过研究高低频超声波对硅藻的去除效果,利用简单的手段——显微镜和TOC分析仪,对超声波处理3种不同类型的硅藻进行分析。发现200kHz超声的强烈机械振荡作用对硅藻破坏效果较明显优于800kHz高频超声波。
超声波; 细胞完整性; 针杆藻; 直链属藻; 脆杆藻
三峡水利枢纽作为世界规模最大的水电工程,在为社会带来防洪、发电、航运等工程效益的同时,由此引发的环境问题也不容忽视。截至目前,嘉陵江、汉江等三峡库区次级河流多次发生水华[1~2],其中硅藻水华问题尤为突出[3],对硅藻水华的处理和预防刻不容缓。由于常规的处理工艺难以解决水华问题,超声波技术作为一种环境友好型的水处理工艺开始逐渐发展起来[4]。现阶段国内外已有众多学者对应用超声波处理蓝绿藻水华进行了深入的研究[5],但是针对超声波在硅藻水华上的应用研究却明显滞后。硅藻和蓝藻从粒径大小到结构形态存在着极大的差异[6],硅质的细胞壁结构使其能够保持良好的完整性[7],因此一旦饮用水水源地硅藻水华爆发,将严重影响水处理工艺的效能[8]。除此之外,在灭活硅藻的过程中伴随着胞内有机物的释放和降解[9],对于水质安全而言有一定隐患,目前尚无相关规律研究。藻细胞的完整性是灭活硅藻安全性一项重要指标。本实验通过显微镜观察在相同功率下,超声波处理前后硅藻细胞形态的变化,对超声波处理硅藻水华的可行性进行研究。
1 方 法
1.1试验藻种及培养
实验所用的淡水针杆藻(Synedra)、直链属藻(Melosira)和脆杆藻(Fragilaria)来自中国科学院淡水藻种库,3种藻单独培养,采用AGP培养基[10],在恒温光照培养箱中进行培养。恒温光照培养箱运行参数为:温度——20.0 ℃±1.0 ℃,光照强度——1500 Lux,光/暗周期——14h∶10h。实验中所使用的针杆藻初始浓度为15~25×107cell/L。直链属藻的浓度为15~18×107cell/L,脆杆藻浓度为60~70×107cell/L。
1.2分析方法
本实验采用200kHz和800kHz两个波段,采用相同的实际功率控制单一变量进行比较。
使用10×10倍放大显微镜通过血球计数板对藻细胞进行计数;使用10×40倍放大显微镜对藻细胞形态进行观察。
本实验中溶解性有机碳DOC(Dissolved Organic Carbon)采用德国元素分析系统公司的Liqui TOCⅡ测量,将超声波处理后的藻液吸入针筒并用0.7um醋酸纤维滤膜过滤,将滤液用TOC分析仪测定。
超声波功率采用焦耳热量进行测定[11]。
1.3实验方法
超声发生器型号为SF200(226kHz)和 SF800(800kHz),输出电功率为0~120w可调(中科院声学研究所东海站,上海)。超声反应在一个开放的不锈钢圆筒中进行[12],实验反应的温度控制在20.0℃±1℃。为了便于研究,实验中采用控制变量法对不同时间段下,超声处理藻细胞的形态进行比较。统一采用生长在稳定期的藻液200mL进行实验。通过焦耳热法测定实际功率为35W。
2 结果与讨论
2.1显微镜观察超声波对藻细胞完整性的破坏
2.1.1针杆藻超声波处理前后细胞完整性
如图1(a)所示,天然情况下针杆藻中间宽两头窄,呈细长的针杆状,当针杆藻被超声波处理后,细胞中部容易受到超声波攻击,细胞器被破坏,胞内物质部分释放出来,如图1(b)。随着超声波处理时间增加,胞内有机物释放,细胞成为了空壳如图1(c)所示。最终,针杆藻的硅壳被打碎,断裂成2~3截的碎片如图1(d)。

图1 超声波处理不同时间段针杆藻细胞形态变化Fig.1 The morphological changes of the synedra with ultrasound treatment time
以图1(a)中细胞形态作为参考,统计不同处理时间段的具有完好细胞形态的针杆藻比例,得出了细胞形态的变化规律。通过控制时间作为单一变量,观察在200kHz和800kHz频率超声波处理10min内细胞形态的变化,将完整性不同的细胞分成四类:完整的针杆藻细胞如图1中的(a)、细胞形态发生变化且细胞内物质部分被释放出来的细胞如图1中的(b)、仅剩硅质空壳的细胞如图1(c)、完全破碎的空壳如图1(d)。由于细胞碎片的数量无法统计,在分析细胞形态时最后一种细胞形态不纳入统计,做出各个细胞形态占总细胞的比例以及这3种细胞的总个数,如图2所示。
从图2(a)中可以看出,在200kHz超声波处理2min之后,细胞浓度由17.1×107cell/L 下降到6.0×107cell/L ,65%的细胞直接被打碎到图1(d)所示的形态。在仍保持细胞形态的的35%的针杆藻细胞中:胞内物质伴随着细胞变形而逐渐开始释放,59%细胞形态发生变化,如图1(b),35%细胞受到超声波的攻击比较严重,胞内物质释放完全,细胞变成空壳,如图1(c)。6min时虽然各个细胞形态的细胞在显微镜视野下比例变化不大,此时的细胞浓度为3.4×107cell/L,80%的细胞已经被打成碎片。6min之后由于细胞浓度较低,超声波对藻细胞的攻击的同时还会对细胞空壳以及细胞碎片进行攻击,导致细胞碎片进一步被打碎。因此,200kHz频率的超声处理时间不宜超过6min,一方面是由于胞内有机物的释放对水质造成影响,另一方面从水处理工艺的角度考虑,将粒径较大的细胞打碎以后将更难沉淀下来。
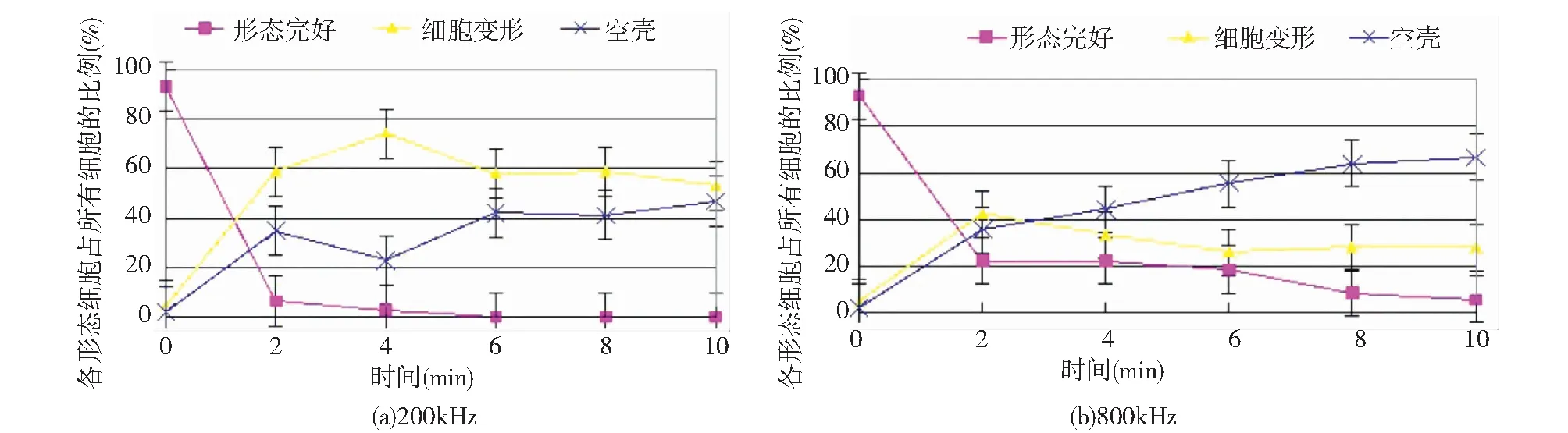
图2 各形态细胞所占比例随超声波处理时间变化Fig.2 Change of the proportion of different kinds of cells with sonication time using the frequencies of 200kHz and 800kHz
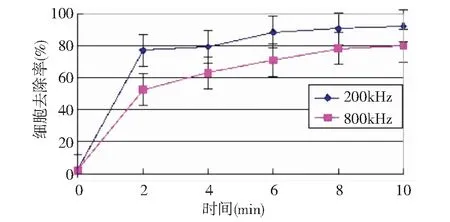
图3 200kHz和800kHz超声波处理针杆藻细胞去除率随时间变化Fig.3 Bacterial cell removal by the frequencies of 200kHz and 800kHz
同理, 800kHz下的各个细胞形态所占比例随时间的变化折线图如图2(b)所示。在超声波处理初期,细胞浓度较大,其破坏较明显,在前2min,细胞浓度由17.1×107cell/L 下降到12.6×107cell/L,26%的细胞在超声波作用下变成碎片。在74%的细胞中,42%的细胞变形,36%的细胞变成空壳。在2~10min,细胞浓度由12.6×107cell/L 下降到10.3×107cell/L,细胞浓度下降不到20%,在此阶段超声并未直接将细胞打成碎片,而空壳细胞的比例在不断上升,由36%上升到67%,超声波主要作用是将细胞变成碎片但其细胞形态仍然得到保持。
形态完好的细胞在800kHz超声波处理下折线图的总体走向与200kHz基本相同,但是在800kHz超声处理6min之后,800kHz仍有19%的细胞形态完好,而200kHz已经不存在形态完好的细胞;800kHz下仅26%的细胞被打成碎片;而200kHz在超声处理同样时间,有80%的细胞被打成碎片。在超声波处理6min时,800kHz空壳细胞的比例为56%,而200kHz空壳细胞比例仅为42%,由于200kHz时超声波破坏主要是使得细胞浓度下降(即细胞被打成碎片),而800kHz时超声波破坏主要将细胞变成空壳而不将其破碎。
超声波对细胞的作用,无论是将其打成空壳或者是碎片,细胞内部细胞器已经完全破坏,通过统计800kHz和200kHz的细胞去除率(即空壳细胞和破碎细胞的总和与总细胞数的比值),如图3所示。在200kHz超声作用下,超声波处理4min时细胞去除率达到80%,而800kHz则要到10min才能达到80%的细胞去除率,可见800kHz对藻细胞的破坏效果远不及200kHz。
因此,从藻细胞的破坏的角度相比较而言,200kHz频率的超声波比800kHz对藻细胞处理更有效,更彻底。从实验过程中观察到在相同功率下,200kHz的超声主要为机械振荡作用,在超声处理过程中液体间强烈碰撞,产生摩擦力和剪切力将藻细胞打碎。800kHz相对而言比较温和。这一点上与Wu等人对微囊藻的研究结果相吻合,低频比高频超声波处理具有更好的效果[13]。
2.1.2多细胞硅藻超声波处理前后细胞形态
通过观察直链属藻和脆杆藻这两种多细胞藻,在800kHz的超声波处理过程中发现多细胞藻被超声波破坏的过程与单细胞藻(针杆藻)有明显的不同。脆杆藻和直链属藻为多细胞形态,是由多个单细胞串成,在超声波处理下,首先细胞连接处受到攻击,多细胞逐渐裂解成单细胞。随后,单细胞继续受到破坏,释放出胞内的物质,变成空壳,图4分别表示了直链属藻(a)和脆杆藻(b)在超声处理下的破坏路径。
镜检结果显示,在超声波处理的初期直链属藻和脆杆藻结构发生变化,但结构变化又略微的有些不同。从直观的显微镜下的细胞形态变化可以看出来,直链属藻遭到超声作用而导致细胞连接处断裂具有随机性,其断裂部位处于细胞中部和细胞首尾的概率相同。而脆杆藻细胞破碎部位则大多数位于脆杆藻细胞的首尾,这是由于两种细胞的连接方式不同:脆杆藻连接部位的接触面积较大,其中间部分受到两端相连细胞的保护;直链属藻接触面积小,则各个部位受到超声波攻击的可能性相等。
参考Purcell等人[14]对长链多细胞破坏形态的定义:将有10个及10个以上的细胞相连直链属藻如图4(a)中的第一幅图定义为完整的细胞;断裂指的是图4(a)第二幅图的细胞形态,长链细胞连接处断裂分散成十个以下的细胞;完全破碎则是图4(a)的第三幅图的形态(还有极少部分细胞破坏形态介于3种之间的,则不做具体分析)。

图4 超声处理不同时间段藻细胞形态变化Fig.4 The morphological changes of the Fragilariaceae(a)and Melosira sp.(b) cells with different ultrasound treatment time
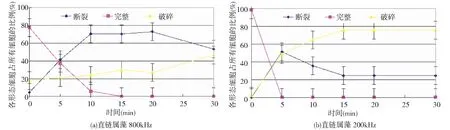
图5 各形态细胞所占比例随超声处理时间变化Fig.5 Change of the proportion of different cell forms with sonication time using the frequencies of 200kHZ(a) and 800kHz(b)
图5(a)为直链属藻细胞在800kHz超声波处理不同时间后在显微镜下的各细胞形态——完整、破碎、裂解所占比例随超声波处理时间变化曲线。直链属藻在前20min,细胞浓度维持在15~18×107cell/L,在30min时细胞浓度下降到9~10×107cell/L,因此在前20min可视为细胞浓度基本不变,细胞碎片较少。从图表中看出,10min后呈多细胞形态的连接完整的直链属藻细胞比例占所有细胞的6%,15min后显微镜视野里呈多细胞形态的直链属藻被全部破坏。连接完整细胞的比例下降而断裂细胞的直链属藻在前10min数量增加迅速,且破碎细胞数量在前10min增加不明显,这说明了在超声波破坏的初期,超声波的主要破坏部位在于藻细胞的连接处。在10min之后,长链的直链属藻已经基本断开,此时超声波破坏由细胞连接处转向细胞个体。此外,通过显微镜观察发现:超声波处理30min后,断裂细胞和破碎细胞所占比例相近。但与800kHz针杆藻破坏过程不同的是:针杆藻细胞浓度下降较快而直链属藻在超声处理30min时细胞浓度仅下降30%~40%;针杆藻在前10min内细胞破碎严重,而直链属藻在前10min细胞破碎比例维持在20%±5%,在10min后破碎细胞所占比例才开始明显增加。
图5(b)为直链属藻细胞在200kHz超声波处理不同时间后在显微镜下的各细胞形态——完整、破碎、裂解所占比例随超声波处理时间变化曲线。未处理的直链属藻,细胞浓度维持在17×107cell/L。在超声波处理5min时,低频的超声波将长链的细胞打断,并且伴随有部分细胞破碎。在5~15min时,断裂的细胞数目减少,而破碎的细胞数目增多,此阶段断裂的细胞被超声波进一步打碎。在15min之后,显微镜下各形态细胞比例基本不变。800kHz超声波对单细胞和多细胞的藻类处理效果差异较大,而200kHz下,两种超声波对藻细胞的破坏则比较类似。
相比于单细胞针杆藻,800kHz超声波对多细胞直链属藻的破坏效果并不明显,这是由于直链属藻藻细胞比表面积小,在超声波作用在更容易维持其形态。Purcell在实验中使用864kHz对四种不同类型的藻处理30min后发现,直链属藻处理效果最不好;这是因为直链属藻没有气囊,而高频的超声波对藻细胞的破坏主要针对气囊。此外,低频超声波具有很强的机械剪切效应,能够将硅质细胞壁打碎[15];而高频超声波的主要作用是将细胞连接处打碎[16]。因此,800kHz的高频率对多细胞的直链属藻的抑制效果并不佳,而200kHz的低频超声波强烈的机械振荡作用可以在15min将直链属藻细胞破碎。而超声波对直链属藻的破坏效果不如对针杆藻的破坏效果好,是由于细长的针杆藻抵抗剪切能力更弱,而圆柱形的直链属藻相比于针杆藻更短小,抵抗剪切能力更强,所以消耗的时间更长。从能量输出的角度看,800kHz超声波处理时间过长,能量输入较多,效率较低;200kHz超声波破坏效果较好,且细胞破碎后没有恢复能力。
2.2有机物的释放
2.2.1针杆藻有机物释放
通过显微镜观察在200kHz和800kHz频率下,超声波处理5min,针杆藻的破坏效果明显,其去除率分别达到83%和67%。图6是用200kHz和800kHz超声波处理15min内DOC的变化,从图线走向看出随着超声处理时间的增加,水样中的可溶解有机物浓度逐渐增高。在超声波处理前5min,200kHz明显比800kHz释放的有机物更多;这是由于在前5min,针杆藻细胞的破坏的比例200kHz比800kHz多16%,胞内有机物释放剧烈。而5min之后有机物释放速率明显降低的同时超声的去除效率也降低。10min之后80%以上的藻细胞已经受到严重破坏被打成空壳或者破碎,胞内有机物释放速率进一步减缓的同时去除效率降低。
在前5min,200kHz下,每个细胞释放的有机物为0.399×10-7mg/cell;800kHz下,每个细胞释放的有机物为0.597×10-7mg/cell。在5~10min,200kHz下,每个细胞释放的有机物为1.14×10-7mg/cell;800kHz下,每个细胞释放的有机物为1.39×10-7mg/cell。在200kHz,每去除单个细胞释放的有机物释放量小于800kHz;在前5min,去除单个细胞释放的有机物小于5~10min时单个细胞释放的有机物。因此,超声波处理时间不宜过长,否则一来藻细胞去除率没得到明显改善,会造成能量的浪费,二来会导致水样中有机物浓度增加,为后续水处理工艺带来风险。
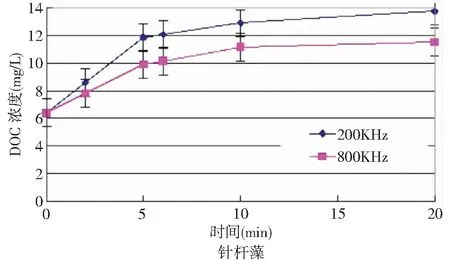
图6 不同超声处理时间下针杆藻DOC随时间变化Fig.6 The DOC of synedra concentration under different sonication time using the frequencies of 200kHz and 800kHz
2.2.2直链属藻有机物释放
图7是直链属藻在200kHz和800kHz下可溶解性有机物随超声波处理时间变化图。从图中数据可以看出,在800kHz超声波处理前10min内,可溶解性有机物浓度变化不大。这再一次证明在前10min内直链属藻受到的主要破坏是细胞连接处断裂,胞内有机物释放较少。随着超声处理时间增加,水样中的可溶解性有机物含量也增加;10min之后胞内物质逐步开始释放,单个藻细胞开始被破坏。而200kHz超声波处理过程中,前10min内DOC增加明显,这是由于强烈的机械振荡作用让细胞破碎,胞内物质释放,这进一步说明细胞连接处断裂和细胞个体的破坏几乎是同时发生的。
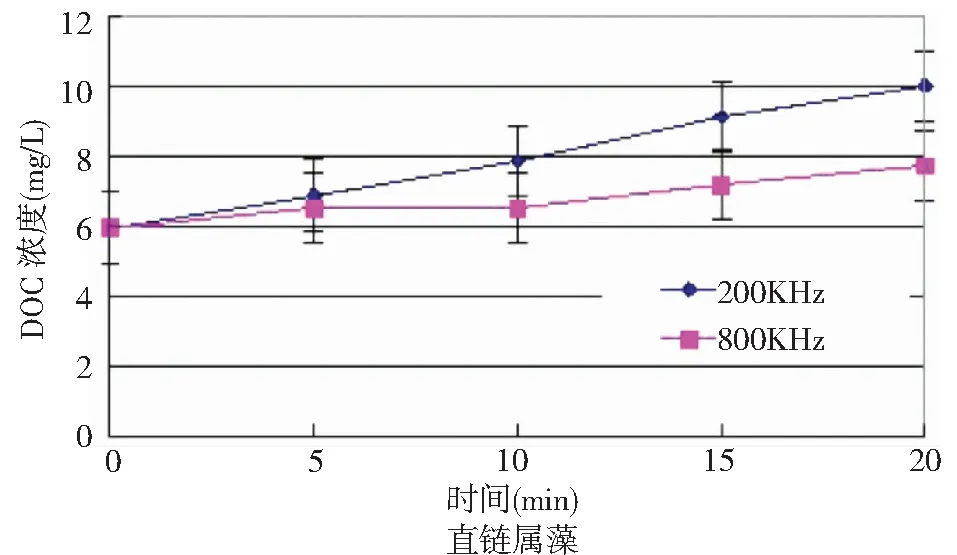
图7 不同超声处理时间直链属藻DOC随时间变化Fig.7 The DOC of molosira concentration under different sonication time using the frequencies of 200kHz and 800kHz
3 结 论
3.1在超声波处理的过程中,单细胞针杆藻受到攻击,细胞形态的完整性被破坏;800kHz对多细胞硅藻则是先连接处断裂,后单个细胞完整性被破坏;而200kHz对多细胞硅藻破碎则是细胞连接处和细胞个体断裂同时发生。
3.2不同频率的超声对硅藻细胞的破坏程度不同。由于硅藻细胞具有硅壳的保护,破坏硅藻需要更高的机械强度。随着超声频率增加,超声机械振荡作用减弱,超声对藻细胞破坏强度减少。通过实验,发现200kHz超声波对硅藻细胞破坏效果比800kHz破坏效果更明显。
3.3超声处理硅藻细胞造成胞内有机物释放,对水质安全造成影响。超声灭藻是一个渐变的过程,并不存在一个功率、频率或超声处理时间可以使藻细胞被破坏、而胞内有机物不释放。随着超声处理时间增加,胞内有机物的释放,对后续水处理工艺也会产生影响。因此,超声处理参数的设定非常重要。
3.4超声处理设定的参数选择应随硅藻细胞结构的不同而不同,多细胞超声波处理时间比单细胞超声波处理时间长。
[1]王敏,等, 嘉陵江出口段硅藻水华发生规律[J]. 环境科学研究, 2011, 24(2): 191-198.
[2]梁开学,等. 汉江中下游硅藻水华形成条件及其防治对策[J]. 环境科学与技术, 2012,(S2): 113-116.
[3]胡征宇,等. 三峡库区重庆段主要支流春季浮游植物调查[J]. 水生生物学报, 2006, 30(1):116-119.
[4]迟巍,等. 超声波除藻概述[J]. 三峡环境与生态, 2012, 34(6): 26-28.
[5]丁暘,等. 超声除藻的参数优化及其在太湖除藻中的应用[J]. 东南大学学报:自然科学版, 2009, 39(2): 354-358.
[6]郭蔚华,等. 嘉陵江出口段三类水体蓝绿硅藻优势种变化机理[J]. 生态环境学报, 2009, 18(1): 51-56.
[7]Hamm C E, Merkel R, Springer O, Jurkojc P, Maier C,Prechtel K, Smetacek V. Architecture and material properties of diatom shells provide effective mechanical protection[J]. Nature, 2003,421:841-843.
[8]刘广奇, 刘杰, 宋兰合. 给水处理除藻技术最新进展[J]. 净水技术, 2008,(2): 27-31.
[9]Henderson R K, et al. Characterisation of algogenic organic matter extracted from cyanobacteria, green algae and diatoms[J]. Water Research, 2008, 42(13): 3435-3445.
[10]张凤岭,王翠婷.生物技术[M]. 长春:东北师范大学出版社,1993.277-278.
[11]Kimura T,Sakamoto T, Leveque J.-M, Sohmiya H, Fujita M, Ikeda S, Ando T. Standardization of ultrasonic power for sonochemical reaction[J]. Ultrasonics Sonochemistry, 1996,(3): 157-161.
[12]Yao J J, Gao N Y, Li C, Li L, Xu B. Mechanism and kinetics of parathion degradation under ultrasonic irradiation[J]. Journal of Hazardous Materials, 2010,175: 138-145.
[13]Wu, X, Joyce E M, Mason T J. Evaluation of the mechanisms of the effect of ultrasound on Microcystis aeruginosa at different ultrasonic frequencies[J]. Water Research, 2012, 46(9): 2851-2858.
[14]Purcell D S,Parsons A, Jefferson B, The influence of ultrasound frequency and power, on the algal species[J]. Environmental Technology, 2013, 34(17): 2477-2490.
[15]陈龙甫,等. 超声波除藻的机制以及安全性研究进展[J]. 四川环境, 2014,(1): 150-153.
[16]Purcell D. Control of algal growth in reservoirs with ultrasound[D].UK:Cranfield University, 2009.
Study on Cell Integrity of Diatom by Ultrasonic Treatment
YAO Juan-juan,YANG Feng, HUANG Dong-hong,WANG Shun-fan, ZHANG Yong-xue, CHEN Long-fu
(MinistryofEducationKeyLaboratoryofThreeGorgesReservoirArea&EcologicalEnvironment,ChongqingUniversity,Chongqing400045,China)
Diatom water bloom has become an urgent problem to be solved in the Three Gorges reservoir area. TOC analyzer and microscope were used to study the metabolic cell viability of three kinds of diatom by ultrasonic treatment at different frequencies-200 kHz and 800 kHz. The results indicated that ultrasonic treatment at lower frequency-200kHz led to cell lysis, while at higher frequency-800kHz, it was not as effective as that at lower frequency.
Ultrasound; cell integrity; Synedra; Melosira sp; Fragilariaceae.
2014-10-14
国家自然科学基金青年基金(51108481);国家水体污染控制与治理科技重大专项(2012ZX07102001-003);中央高校基本科研业务费资助(CDJRC11210002、106112012CDJZR210027);污染控制与资源化国家重点实验室开放课题资助(PCRRF12021);重庆大学大型仪器设备开放基金资助。
姚娟娟(1982-),女,四川隆昌人,2010年毕业于同济大学市政工程专业,博士,讲师,研究方向为水处理理论与技术。
X172
A
1001-3644(2015)02-0001-06

