枯草芽孢杆菌与水体中U(Ⅵ)的作用机制
黄荣,聂小琴,董发勤,张东,亢武,杨杰,马佳林,周娴,龚运军,龚俊源
(1 西南科技大学核废物与环境安全国防重点学科实验室,四川 绵阳 621010;2 中国工程物理研究院核物理与化学研究所,四川 绵阳 621900)
引 言
在过去的几十年,伴随着核工业的迅速发展,大规模的铀矿开采和冶炼过程产生了大面积低浓度的铀污染水体,铀通过地表径流和地下渗透的方式进入到地表水和地下水,再经过生物链进入到身体,以其化学和放射性双重毒性对人类健康和环境安全造成潜在的危害[1-2]。针对这类铀污染水体,传统的化学沉淀、离子交换、蒸发等处理方法都存在成本高、易造成二次污染等问题。近二十年来,利用微生物高效原位地净化和修复铀污染水体已引起国内外研究学者的广泛关注。大量关于活体或死体细菌[1-3]、真菌[4-7]、微藻[8-10]、植物组织[11]吸附去除水体中U(Ⅵ)的报道,涉及到的作用机理包括物理化学吸附、氧化还原、离子交换、络合沉淀等[12-16]。最近一些研究表明[17-19],铀主要与微生物表面的磷酸基团发生作用,提供络合配位的主要位点,甚至在一些活体微生物表面沉淀矿化为片状或针状的磷-铀晶体,存在微生物体内部分有机磷被分解并从胞内释放出无机磷的可能。然而,关于微生物在与U(Ⅵ)作用过程中,磷的释放行为很少被关注。本文采用静态吸附-解吸实验,研究了枯草芽孢杆菌对水体中U(Ⅵ)的吸附热力学和动力学,同时考察了铀的解吸行为及菌体内 P 的释放过程,并利用SEM-EDS 和FTIR 对吸附机理进行了分析。本研究将有助于深入理解微生物与铀相互作用过程及其机制,以期为微生物原位修复铀污染水体的应用提供参考。
1 实验材料和方法
1.1 实验材料和设备
1.1.1 菌株和培养基 枯草芽孢杆菌(Bacillus subtilis)由西南科技大学生命科学与工程学院实验中心提供。菌种解冻后,接种到液体培养基中,在35℃、150 r·min-1的恒温培养箱中振荡24 h,得到活化菌体,通过平板划线法得到单个长势好的菌落,挑选茁壮的菌落接种到新的液体培养基中培养,重复此步骤2~3 次,得到长势好的枯草芽孢杆菌菌体。将活化后的枯草芽孢杆菌接入到液体培养基中,150 r·min-1恒温振荡培养箱中振荡培养48 h(35℃),离心,取沉淀的菌体,用0.9% 的生理盐水稀释为所需菌悬液(吸光度值OD600=0.5)。
培养基成分:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,蒸馏水1000 ml,pH:7.0~7.2。
1.1.2 铀溶液的配置 准确称取 2.1092 g UO2(NO3)2·6H2O,少量水溶解后,加入10 ml 硝酸,移入1000 ml 容量瓶中,用水稀释至刻度,摇匀,即为铀浓度为1 g·L-1的铀溶液。通过稀释得到实验所需的浓度。以去离子水体系作为对照。采用0.1 mol·L-1HNO3、10 g·L-1Na2CO3和5 g·L-1NaHCO3调节溶液pH。
1.1.3 分析测试仪器 电子天平(AL104),梅特勒-托力多仪器有限公司;真空干燥箱(BZF-50),上海博讯实业有限公司医疗设备厂;恒温水浴摇床(SHA-B),常州国华电器有限公司;pH 计(PHS-3C),上海雷磁仪器厂;离心机(LD5-2B),北京雷勃尔离心机有限公司;高压蒸汽灭菌锅(CL-32L),日本ALP 公司;紫外可见分光光度计(UV-1600),上海美谱达仪器有限公司;傅里叶变换红外光谱仪(FTIR),美国PE 仪器公司;场发射扫描电子显微镜系统(Ultra55),德国蔡司仪器公司;能谱仪(Oxford IE450),英国Oxford 公司。
1.2 实验方法
准确移取20 ml 一定浓度的铀溶液于50 ml 锥形瓶中,取20 ml 预培养好的菌悬液(OD600=0.5)离心(4000 r·min-1)10 min,将离心后的湿菌体(干重2.5~5.0 mg)分别加入上述50 ml 锥形瓶中(每组设置3 个平行样),置于摇床内恒温振荡吸附一定时间,离心,取5 ml 上清液利用偶氮胂Ⅲ分光光度法[20]测定残余铀浓度,参照文献[21]测定溶液中的磷浓度。离心后的菌体通过20 ml 饱和EDTA 解吸3 次,每次2 h,解吸出的铀被认为是在细胞表面吸附络合的U(Ⅵ)。通过式(1)、式(2)计算枯草芽孢杆菌对铀(Ⅵ)的吸附率R(%)和吸附量q(mg·g-1)。
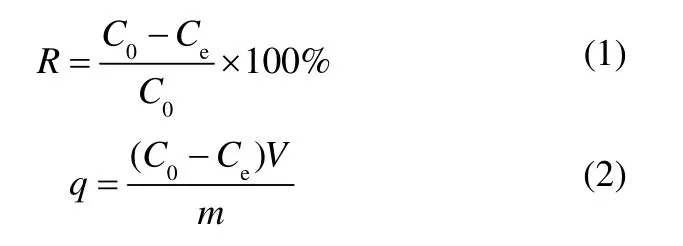
式中,C0为初始U(Ⅵ)浓度,mg·L-1;Ce为t时刻剩余U(Ⅵ)浓度,mg·L-1;V为溶液体积,L;m为枯草芽孢杆菌细胞干重,g。
将部分湿菌体用蒸馏水清洗3 次,离心、制成菌悬液,稀释,在盖玻片上点样,自然干燥,经2.5%戊二醛溶液固定10 h,再通过30%、50%、70%、90%、100%乙醇溶液逐级脱水(每次脱水20 min),自然晾干,备用。样品经过喷金处理后进行扫描电镜分析。
将清洗后的剩余菌体在65℃下烘至恒重,收集作为红外光谱分析样品。
2 实验结果与讨论
2.1 溶液pH 对枯草芽孢杆菌吸附U(Ⅵ)的影响
大量研究表明,pH 通过影响溶液中U(Ⅵ)的化学形态以及微生物表面电荷分布,从而影响微生物对U(Ⅵ)的吸附行为。
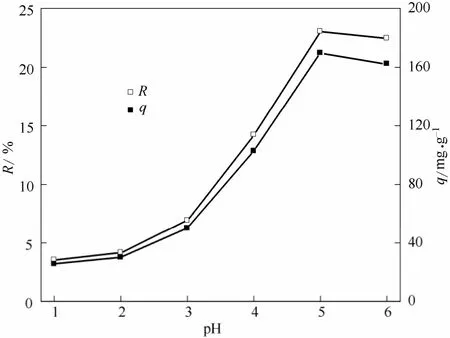
图1 pH 对枯草芽孢杆菌吸附U(Ⅵ)的影响Fig.1 Effect of pH on adsorption of U(Ⅵ) by Bacillus subtilis
由图1可以看出,在pH=1~5 时吸附率随pH增大而升高,在此pH 范围内,铀主要以UO22+形式存在,当pH>4 时,伴有少量的(UO2)2(OH)22+、UO2OH络合阳离子。因为枯草芽孢杆菌生长和存活最适宜的pH 在5 左右,此时细胞相对活性最高,也表现出最大的吸附率,当pH>5 时,UO22+水解加剧,形成大量的 UO2(OH)+、(UO2)2(OH)22+、(UO2)3(OH)5+,由于较大的离子半径,导致与细胞表面活性位点结合的空间位阻较大[5],引起吸附率下降。
2.2 加菌量对枯草芽孢杆菌吸附U(Ⅵ)的影响
由图2可知,吸附率与所加菌体量呈正相关,随菌体量增多,溶液中可参与吸附作用的活性位点增多[1],导致吸附率逐渐增大,而相应的吸附容量逐渐降低。在初始铀浓度为50 mg·L-1,pH=5,投加量为1.384 mg·L-1时,吸附率和吸附量分别为85.34%和308.31 mg·g-1(DW);当投加量增加至6.92 mg·L-1时,吸附率和吸附量分别为96.86%和70.01 mg·g-1(DW)。

图2 加菌量对枯草芽孢杆菌吸附U(Ⅵ)的影响Fig.2 Effect of bacteria content on adsorption of U(Ⅵ) by Bacillus subtilis
2.3 温度对枯草芽孢杆菌吸附U(Ⅵ)的影响
温度对枯草芽孢杆菌吸附U(Ⅵ)的影响如图3所示。在实验设定的温度范围内,枯草芽孢杆菌对U(Ⅵ)的吸附量随温度的变化不大。在温度低于303 K 时,吸附率与温度呈正线性关系,温度从288 K升高到303 K 时,吸附率增加17.51%,继续升高温度至313 K,吸附率基本保持不变,说明在288~303 K 温度范围内,升高温度有利于枯草芽孢杆菌对U(Ⅵ)的吸附,但温度对整体吸附过程的影响不太显著。
2.4 初始铀浓度对枯草芽孢杆菌吸附U(Ⅵ)的影响
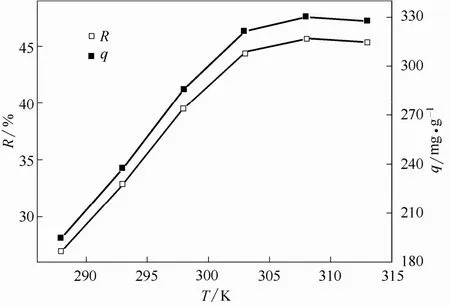
图3 温度对枯草芽孢杆菌吸附U(Ⅵ)的影响Fig.3 Effect of temperature on adsorption of U(Ⅵ) by Bacillus subtilis

图4 初始铀浓度对枯草芽孢杆菌吸附U(Ⅵ)的影响Fig.4 Effect of initial uranium concentration on adsorption of U(Ⅵ) by Bacillus subtilis
如图4所示,随着初始铀(Ⅵ)浓度的增加,枯草芽孢杆菌对铀(Ⅵ)的吸附率逐渐降低,吸附量呈 增加趋势,但铀(Ⅵ)浓度大于71.72 时吸附量有减少趋势。在本实验所设置的铀(Ⅵ)浓度范围内,吸附率在9.92%~84.24%之间,吸附量为57.82~319.62 mg·g-1;表明枯草芽孢杆菌更适宜处理浓度低于71.72 mg·L-1的含铀废水。
2.5 枯草芽孢杆菌对U(Ⅵ)的吸附热力学分析
2.5.1 吸附等温模型 Langmuir 等温吸附模型基于单层吸附理论,假定吸附剂上的吸附位点是均匀分布的并且溶质单层覆盖在吸附剂的表面,Freundlich 等温吸附方程假定吸附剂表面为不均匀的[10]。Langmuir 和Freundlich 线性表达式见式(3)和式(4)

式中,Ka是Langmuir 吸附等温模型的平衡常数,L·mg-1,表示吸附与解吸的比率;qm表示理论最大吸附量,mg·g-1;qe表示平衡吸附量,mg·g-1;Ce表示溶液中剩余铀浓度,mg·L-1;Kf是Freundlich 常数,表示吸附剂的吸附能力;1/n为经验常数,表示吸附强度。
枯草芽孢杆菌对水体中U(Ⅵ)的吸附等温模型拟合结果见表1和图5。
从表1和图5可以看出,在298 K、308 K 和318 K 时,Langmuir 方程拟合效果均好于Freundlich方程,R2在0.955~0.988 之间,Ka值在 0~1 范围内,吸附反应容易进行[10]。枯草芽孢杆菌对放射性核素铀(Ⅵ)的理论最大吸附量为344.82 mg·g-1,铀的吸附主要发生在特定活性位点的单层吸附。
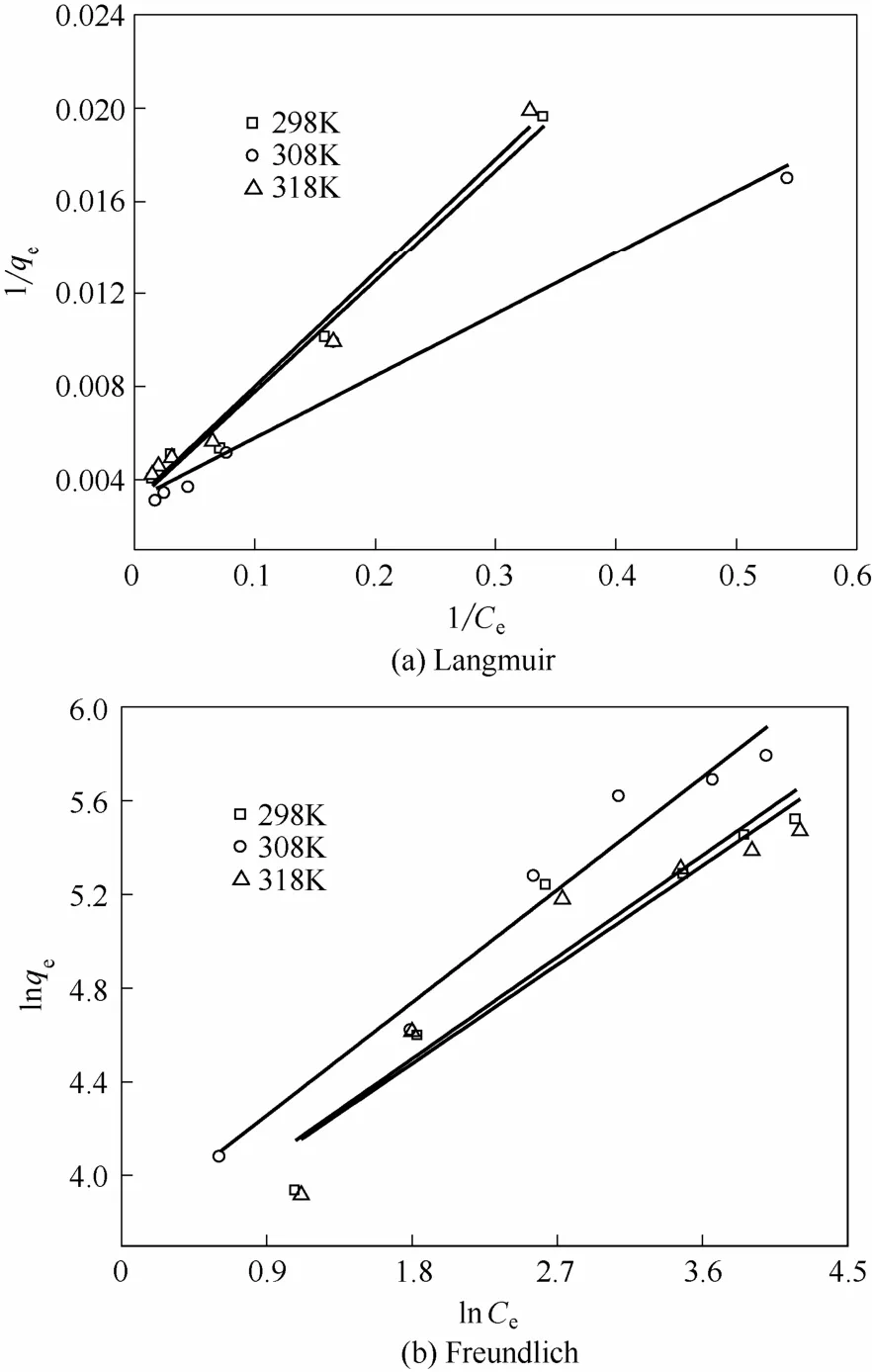
图5 枯草芽孢杆菌对U(Ⅵ)的吸附等温模型Fig.5 Isotherm model of uranium adsorption by Bacillus subtilis
2.5.2 吸附热力学 由式(5)、式(6)计算反应的焓变(ΔH°)、反应物和产物之间熵的变化(ΔSº)、Gibbs 自由能变化(ΔG),其中K=q/Ce,R=8.314 J·mol-1·K-1。ΔHº>0,为吸热反应,反之为放热反应;ΔSº>0 说明系统混乱度增加;ΔG<0 表明该吸附反应自发进行,反之该吸附反应不能自发进行。
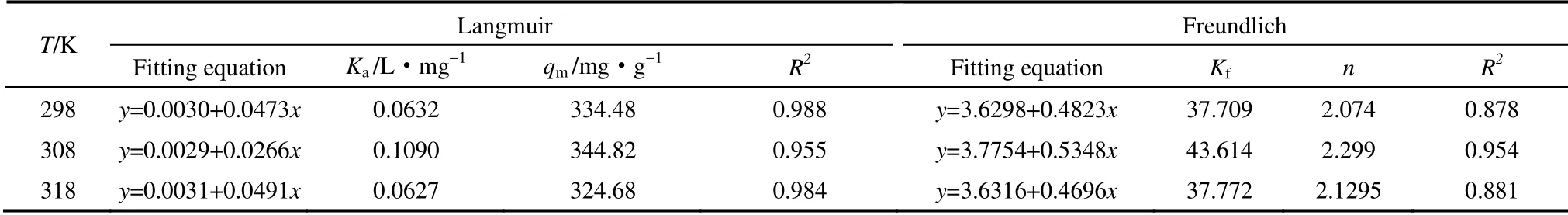
表1 枯草芽孢杆菌对U(Ⅵ)的吸附等温常数Table 1 Adsorption isotherm constants of uranium biosorption by Bacillus subtilis
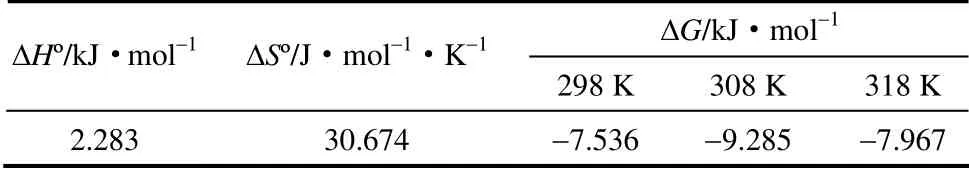
表2 枯草芽孢杆菌对U(Ⅵ)的吸附热力学参数Table 2 Thermodynamic parameters for uranium adsorption by Bacillus subtilis
枯草芽孢杆菌对U(Ⅵ)的吸附热力学常数见表2。结果表明枯草芽孢杆菌对U(Ⅵ)的吸附过程是吸热的,自发进行的,随着反应的发生系统混乱度增加。
2.6 枯草芽孢杆菌对U(Ⅵ)的吸附动力学
2.6.1 吸附与解吸 枯草芽孢杆菌对U(Ⅵ)的吸附及解吸随时间的变化如图6所示。
由图6可以看出,吸附是一个较迅速的过程,5 min 和2 h 时吸附率分别为61.66% 和 85.07%,吸附趋于平衡,在48 h 时平衡吸附率为 89.95%,吸附量为324.94 mg·g-1。而相应的解吸率逐渐降低,由5 min 的80.06% 降至48 h 的36.25%,推测初始阶段的快速吸附主要为物理静电吸附,表现为在初始阶段大部分吸附在枯草芽孢杆菌上的铀容易被EDTA 交换洗脱下来。随着吸附时间的延长,吸附在枯草芽孢杆菌表面的铀与菌体发生生物及化学作用,在活性位点络合配位,被还原及矿化,甚至穿透细胞壁膜进入细胞体内。
2.6.2 吸附动力学 根据上述吸附数据,本文对枯草芽孢杆菌吸附U(Ⅵ)的动力学过程进行了拟合,式(7)和式(8)分别为准一级动力学方程和准二级动力学方程的线性表达式
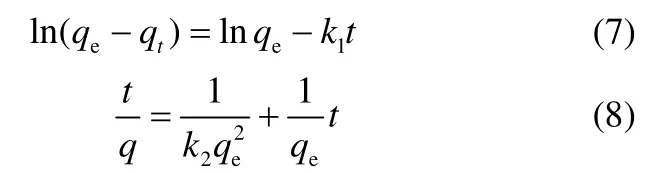
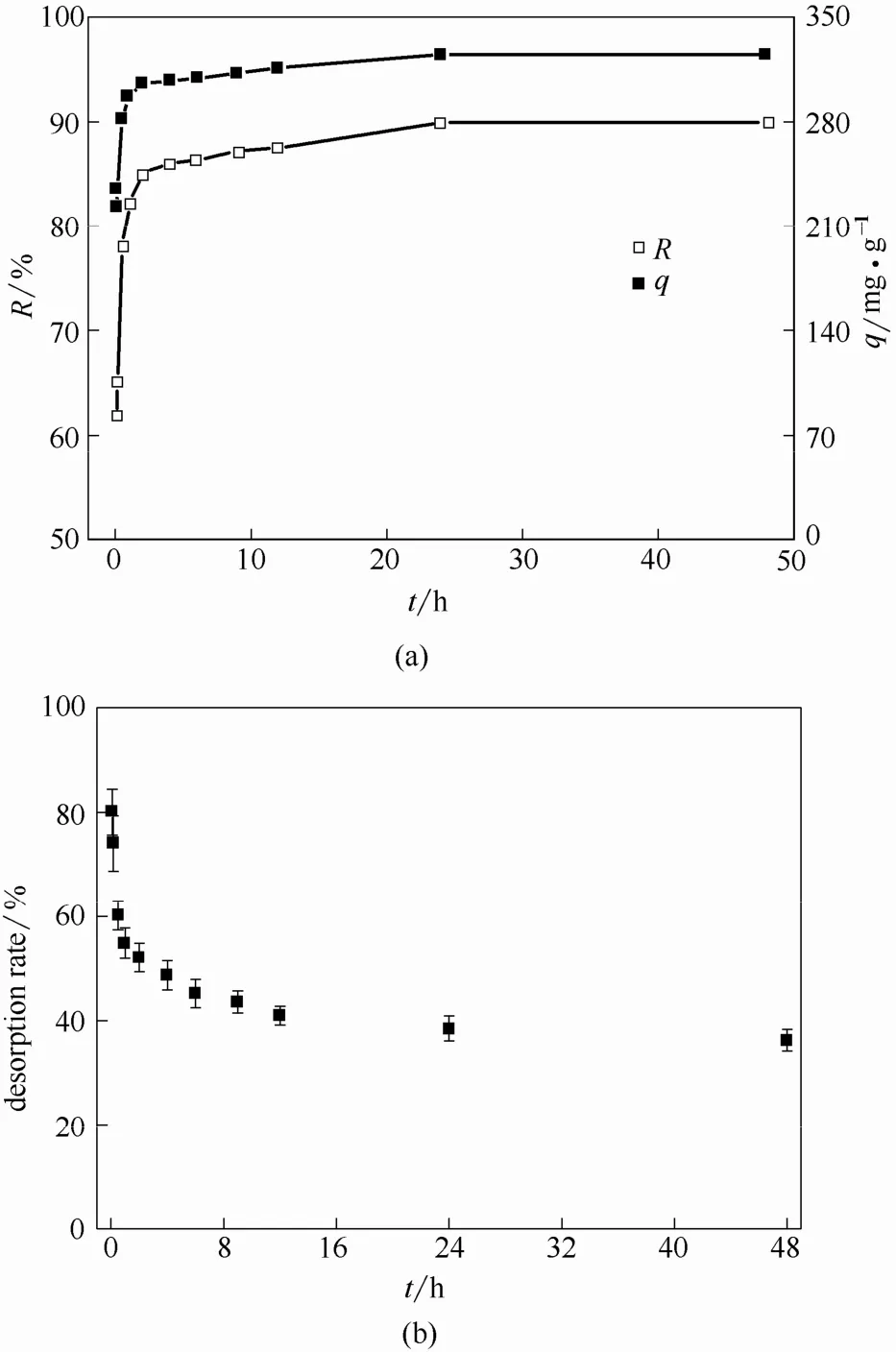
图6 时间对枯草芽孢杆菌吸附和解吸U(Ⅵ)的影响Fig.6 Effect of time on adsorption(a)and desorption(b)of U(Ⅵ) by Bacillus subtilis
式中,qe和qt分别为平衡吸附量及t时刻的吸 附量,mg·g-1;k1(h-1)和k2(g·mg-1·h-1)分别表示准一级和准二级动力学方程的速率常数。
枯草芽孢杆菌对U(Ⅵ)的吸附动力学拟合结果见表3和图7。
由表3和图7可知,准一级动力学和准二级动力学模型R2分别为0.9515 和0.990,准二级动力学模型得到的平衡吸附量为344.83 mg·g-1,与实验所得的饱和吸附量324.94 mg·g-1比较接近,表明准二级动力学吸附模型可以更好地描述枯草芽孢杆菌对U(Ⅵ)的吸附行为。

表3 枯草芽孢杆菌对U(Ⅵ)的吸附动力学参数Table 3 Kinetic constants of uranium adsorption by Bacillus subtilis
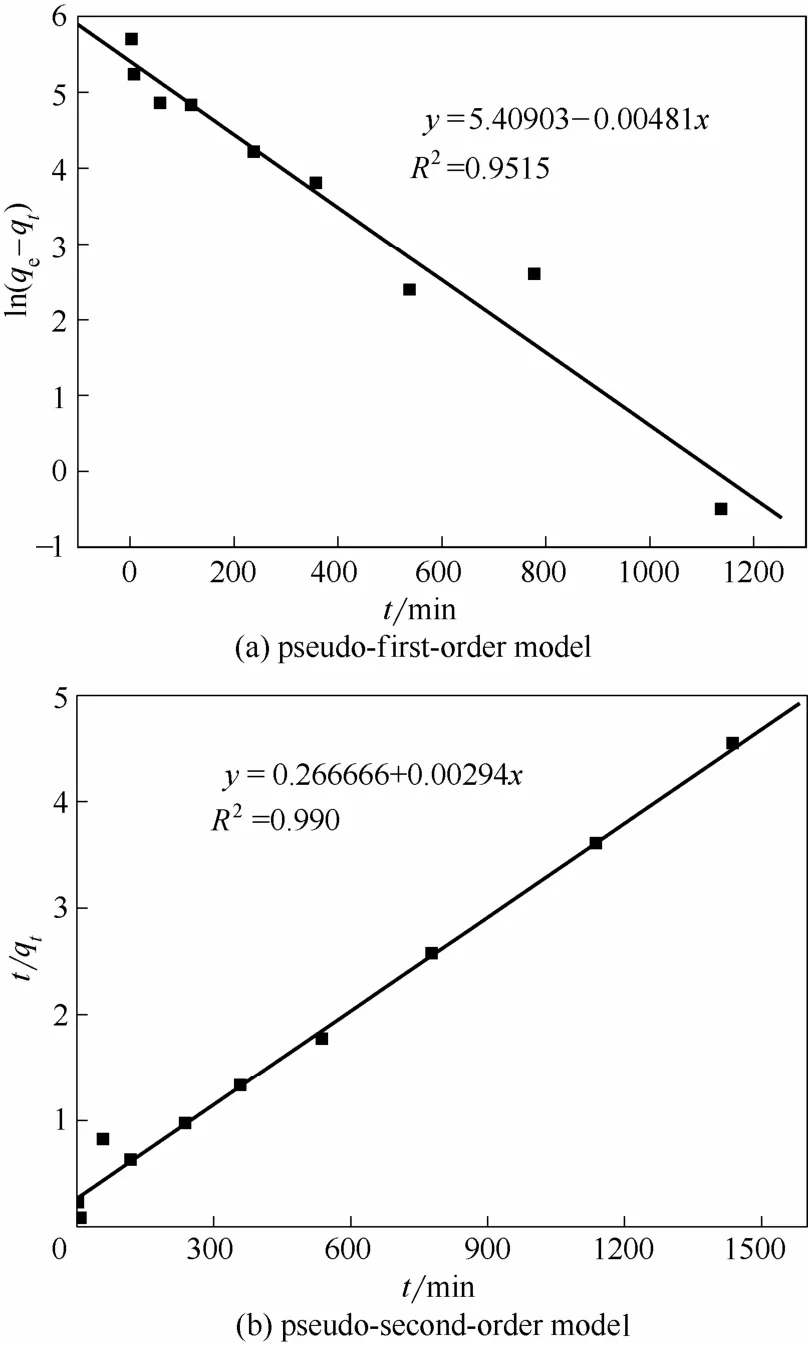
图7 枯草芽孢杆菌对U(Ⅵ)的吸附动力学模型Fig.7 Kinetics model of uranium adsorption by Bacillus subtilis
2.7 P 的释放
枯草芽孢杆菌在有铀和无铀条件下释放到溶液中P 的浓度与时间关系如图8所示。由图8可以看出,在无铀的溶液中48 h 后,枯草芽孢杆菌释放到溶液中的磷浓度为0.02 mg·L-1,而在50 mg·L-1的铀溶液中2 h 后,溶液中P 浓度从0 增加至0.12 mg·L-1,48 h 时,P 浓度增加至0.40 mg·L-1。这一现象与Jiang等[7]和Salome等[17]的研究结果相似。推测枯草芽孢杆菌在此条件下细胞受到了严重的胁迫,伴随体内自由基增加,代谢活动增强,促使ATP水解,壁膜破坏,磷脂分解的生理生化响应过程中,大量的P 从枯草芽孢杆菌体内释放到溶液中。然而 溶液中的U(Ⅵ)并未与释放到溶液中的P 直接作用,解吸过程证明大部分的铀是被吸附到枯草芽孢杆菌体内,而后面的SEM-EDS 结果表明吸附在菌体上的铀并未与无机P 结合生成U-P 晶体。
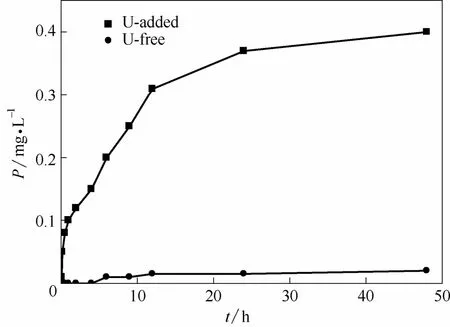
图8 枯草芽孢杆菌在有铀和无铀条件下释放到溶液中P 的浓度与时间的关系Fig.8 Time-dependence of P released from Bacillus subtilis in U-added exposure solution and in U-free solution
2.8 扫描电子显微镜(SEM)
枯草芽孢杆菌与50 mg·L-1铀溶液作用不同时间后的扫描电镜结果如图9所示。
由图9(a)可以看出,枯草芽孢杆菌在吸附前细胞处于饱满状态,细胞表面光滑,细胞结构完好,与铀作用后[图9(b)、(c)],细胞之间相互粘连并发生皱缩,菌体基本断裂呈短节状,菌体表面出现明显团状聚集物,EDS 结果表明团状聚集物和枯草芽孢杆菌表面均出现明显的U 峰,未见P 的峰。尖锐的Si 可能是菌体底部的盖玻片。与对照相比,同时出现明显的N 峰。文献[6-7,17,19]报道的酵母菌与铀作用过程中在菌体表面产生纳米U-P 结晶矿化体,本研究表明枯草芽孢杆菌与铀作用机制与酵母菌明显不同。
2.9 红外光谱(FTIR)
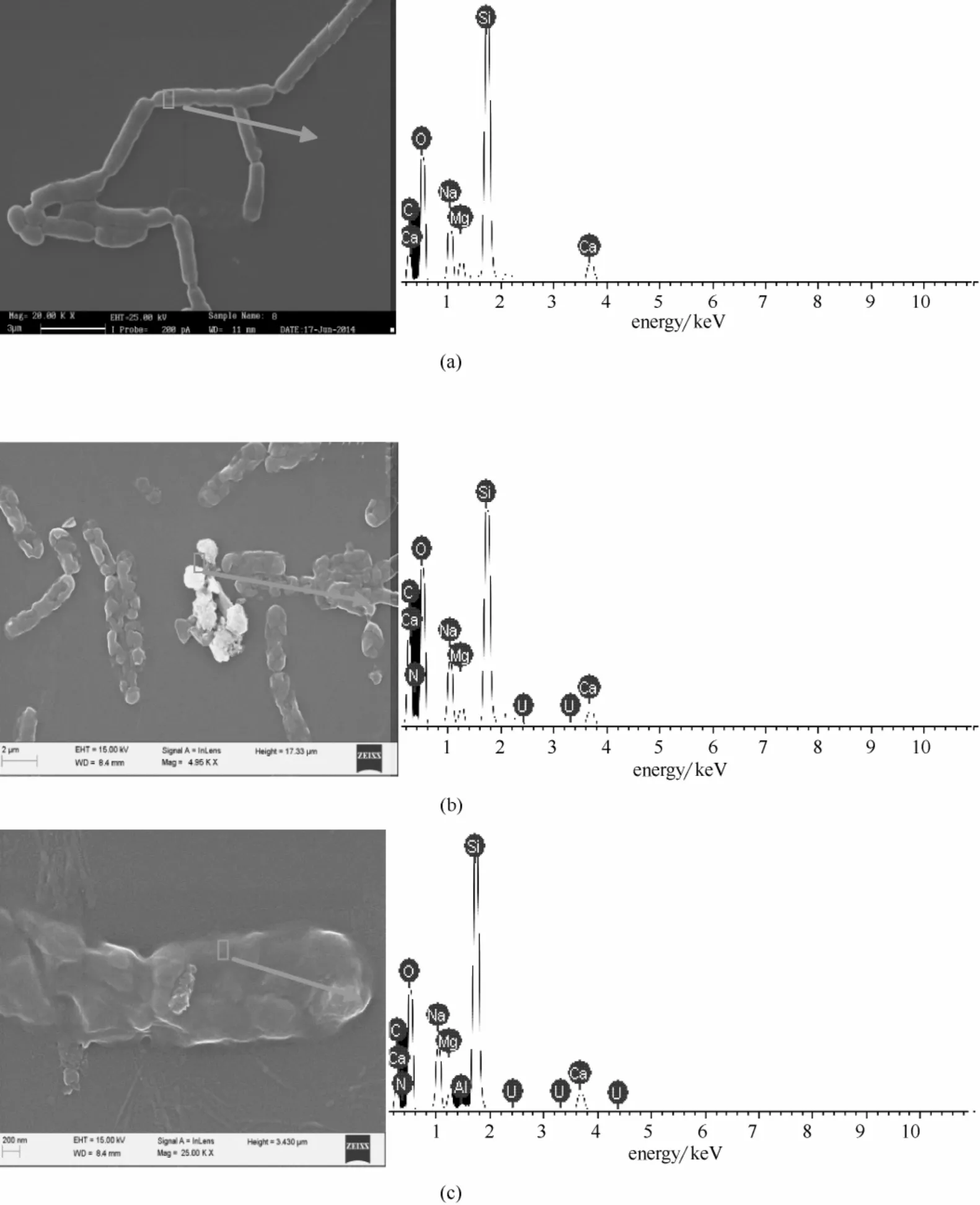
图9 枯草芽孢杆菌对铀吸附前后SEM 图Fig.9 SEM images of Bacillus subtilis before(a)and after 24 h(b)and 48 h(c)adsorption uranium
图10为枯草芽孢杆菌与初始浓度为 200 mg·L-1U(Ⅵ),pH=5 的铀溶液作用前后FTIR 谱图。其中,3433.97 cm-1左右存在一个强而宽的谱带,该处为羟基O—H 对应的伸缩振动吸收峰,2927.43 cm-1是C—H 伸缩振动吸收峰;1630.10 cm-1和1404.71 cm-1附近分别归属为酰胺Ⅰ带特征吸收峰和蛋白质分子肽键中的C—N 键的伸缩振动峰,1048.65 cm-1附近的吸收峰主要来自于纤维素糖链和半纤维素中C—C、C—O 和C—O—C 键的吸收峰[4,22]。613.65 cm-1和538.65 cm-1均为PO43-的面外弯曲振动峰。由此可以推断,枯草芽孢杆菌体内含有较多蛋白质、酰胺化合物和纤维素,主要有氨基、羟基、羧基、磷酸基等活性基团。从枯草芽孢杆菌与U(Ⅵ)作用后的FTIR 光谱图可以看出,O—H 和C—H 伸缩振动峰基本未变,酰胺Ⅰ带特征吸收峰和C—N 键的伸缩振动峰在与U(Ⅵ)作用后分别向左和右移动了6 cm-1和20 cm-1,PO43-在与U(Ⅵ)作用后向左移动了75 cm-1,峰强明显减弱,表明氨基、磷酸基参与了枯草芽孢杆菌对U(Ⅵ)的吸附。枯草芽孢杆菌与铀作用后,在2973.16 cm-1出现了不对称甲基振动吸收峰,在905.31 cm-1出现了UO22+的反对称伸缩振动吸收特征峰[23]。
3 结 论
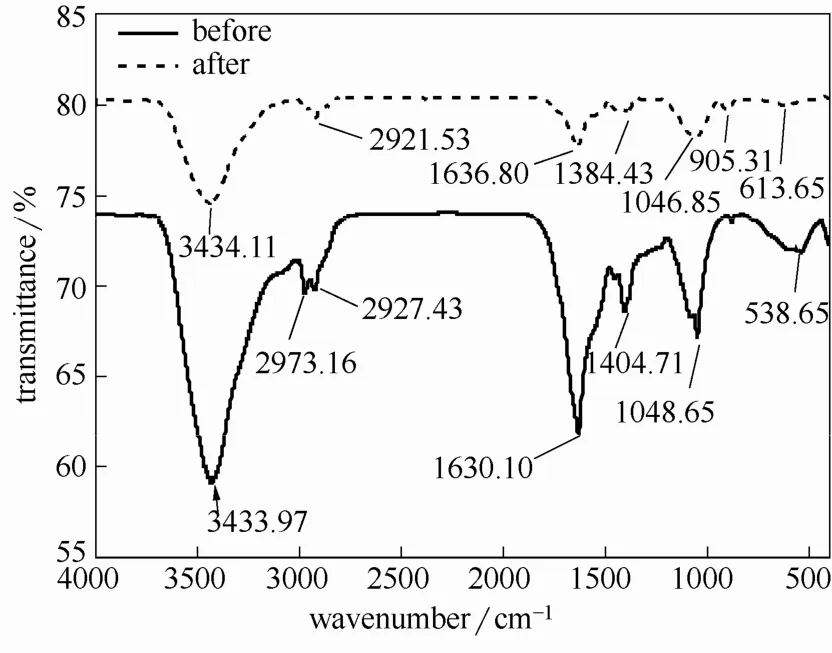
图10 枯草芽孢杆菌吸附铀前后的红外光谱图Fig.10 FTIR spectra of Bacillus subtilis before and after uranium adsorption
在初始铀浓度为50 mg·L-1,pH0=5.0,0.06 mg(DW)活体枯草芽孢杆菌在初始阶段对铀吸附较快,在2 h 时的铀的去除率达85.07%,主要通过静电吸引和表面络合吸附在菌体,解吸率为52.13%。随着时间延长至48 h,吸附率和吸附量缓慢增加至89.95%和324.94 mg·g-1,解吸率下降至36.25%,部分铀进入到菌体内,同时大量磷从菌体内释放出来,溶液中P 的浓度达到0.4 mg·L-1。枯草芽孢杆菌对 U(Ⅵ)的吸附更符合 Langmuir 等温模型和准二级动力学方程,吸附过程是吸热、自发进行的,随着反应的发生系统混乱度增加。SEM-EDS 结果表明U 出现在菌体表面和周围,部分以无规则形状的团聚物形式存在,菌体内部断裂呈短节状。FTIR 表明菌体表面氨基、磷酸基参与了铀的吸附,吸附后出现明显的UO22+特征峰。
[1]Lovley D R,Phillips E J P,Gorby Y A,Landa E R.Microbial reduction of uranium [J].Nature,1991,350:413-416
[2]Alessi D S,Lezama-Pacheco J S,StubbsJ E,Janousch M,Bargar J R,Persson P,Bernier-Latmani R.The product of microbial uranium reduction includes multiple species with U( Ⅳ)-phosphate coordination [J].Geochim.Cosmochim.Acta,2014,131:115-127
[3]Lovley D R.Bioremediation.Anaerobes to the rescue [J].Science,2001,293(5534):1444-1446
[4]Liu M X,Dong F Q,Yan X Y,Zeng W M,Hou L Y,Pang X F.Biosorption of uranium bySaccharmyces cerevisiaeand surface interactions under culture conditions [J].Bioresour.Technol.,2010,101:8573-8580
[5]Peng Guowen(彭国文),Ding Dexin(丁德馨),Hu Nan(胡南),Yang Yushan( 杨 雨 山),Wang Xiaoliang( 王 晓 亮).Adsorption aharacteristics of uranium bySaccharomyces cerevisiaeby chemical modification [J].CIESC Journal( 化工学报),2011,62(11):3201-3206
[6]Toshihiko O,Takuo O,Takahiro Y,Fuminori S,Naofumi K,Eiichi W,Arokiasamy J F,Haruyuki I.Mechanisms of uranium mineralization by the yeastSaccharomyces cerevisiae[J].Geochimica et Cosmochimica Acta,2005,69(22):5307-5316
[7]Jiang M Y,Ohnuki T,Tanaka K,Kozai N,Kamiishi E,Utsunomiya S.Post-adsorption process of Yb phosphate nano-particle formation bySaccharomyces cerevisiae[J].Geochimica et Cosmochimica Acta,2012,93:30-46
[8]Acharya C,andwadkar P,Apte S K.Interaction of uranium with a filamentous,heterocystous,nitrogen-fixing cyanobacteriumAnabaena torulosa[J].Bioresour.Technol.,2012,116:290-294
[9]Rashmi V,Shylajanaciyar M,Rajalakshmi R,D'Souza S F,Prabaharan D,Uma L.Siderophore mediated uranium sequestration by marine cyanobacteriumSynechococcus elongatusBDU 130911 [J].Bioresour.Technol.,2013,130:204-210
[10]Khani M H,Keshtkar A R,Ghannadi M,Pahlavanzadeh H.Equilibrium,kinetic and thermodynamic study of the biosorption of uranium ontoCystoseria indica algae[J].J.Hazard.Mater.,2008,150(3):612-618
[11]Nie Xiaoqin(聂小琴),Dong Faqin(董发勤),Liu Mingxue(刘明学),Liu Ning(刘宁),Zhang Wei(张伟),Yang Xueying(杨雪颖).Characteristics of U(Ⅵ) biosorption by biological adsorbent ofPlatanusleaves [J].Spectroscopy and Spectral Analysis(光谱学与光谱分析),2013,33(5):1290-1294
[12]Campbell K M,Veeramani H,Ulrich K U,Blue L Y,Giammar D E,Bernier-Latmani R,Stubbs J E,Suvorova E,Yabusaki S,Lezama-Pacheco J S,Mehta A,Long P E,Bargar J R.Oxidative dissolution of biogenic uraninite in groundwater at old rifle,CO [J].Environ.Sci.Technol.,2011,45(20):8748-8754
[13]Stylo M,Alessi D S,Shao P P Y,Lezama-Pacheco J,Bargar J,Bernier-Latmani R.Biogeochemical controls on the product of microbial U (VI) reduction [J].Environ.Sci.Technol.,2013,47:12351-12358
[14]McCrate O A,Zhou X,Reichhard C,Cegelski L.Sum of the parts:composition and architecture of the bacterial extracellular matrix [J].J.Mol.Biol.,2013,425:4286-4294
[15]Li J,Zhang Y.Remediation technology for the uranium contaminated environment:a review [J].Procedia.Environmental Sciences,2012,13:1609-1615
[16]Xia Liangshu(夏良树),Tan Kaixuan(谭凯旋),Deng Chang’ai(邓昌爱),Wang Meng( 王孟).Synergistic aeration treatment of uranium-contained wastewater bySaccharomyces cerevisiae-activated sludge [J].Chemical Engineering(China)(化学工程),2009,37(3):5-9
[17]Salome K R,Green S J,Beazley M J,Webb S M,Kostka J E,Taillefert M.The role of anaerobic respiration in the immobilization of uranium through biomineralization of phosphate minerals [J].Geochim.Cosmochim.Acta,2013,106:344-363
[18]Bargar J R,Williams K H,Campbell K M,Long P E,Stubbs J E,Suvorova E I,Lezama-Pacheco J S,Alessi D S,Stylo M,Webb S M,Davis J A,Giammar D E,Blue L Y,Bernier-Latmani R.Uranium redox transition pathways in acetate-amended sediments [J].Proc.Natl.Acad.Sci.USA,2013,110:4506-4511
[19]Beazley M J,Martinez R J,Sobecky P A,Webb S M,Taillefert M.Uranium biomineralization as a result of bacterial phosphatase activity insight from bacterial isolates from a contaminated subsurface [J].Environ.Sci.Technol.,2007,41:5701-5707
[20]Savvin S B.Analytical use of Arsenazo Ⅲ:determination of thorium,zirconium,uranium and rare earth elements [J].Talanta,1961,8(9):673-685
[21]Mckelviei D,Peat D M W,Worsfold P J.Techniques for the quantification and speciation of phosphrous on natural water [J].Analytical Proceedings Including Analytical Communications,1995,32:437-445
[22]Kushwaha S,Sreedhar B,Padmaja P.XPS,EXAFS,and FTIR as tools to probe the unexpected adsorption coupled reduction of U(Ⅵ) to U(Ⅴ)and U(Ⅳ) onBorassus flabelliferbased adsorbents [J].Langmuir,2012,28:16038-16048
[23]Gorman-Lewis D,Skanthakumar S,Jensen M P,Mekki S,Nagy K L,Soderholm L.FTIR characterization of amorphous uranyl-silicates [J].Chemical Geology,2008,253(3/4):136-140

