单级SBR厌氧/好氧/缺氧处理中期垃圾渗滤液深度脱氮
李忠明,王淑莹,苗蕾,曹天昊,张为堂,刘文龙,彭永臻
(北京工业大学北京市水质科学与水环境恢复工程重点实验室,北京100124)
引 言
卫生填埋具有处理方式简单、处理费用低等优点,它是国内外城市生活垃圾主要处置手段。其主要缺点是产生大量的垃圾渗滤液。根据垃圾填埋时间的不同,垃圾渗滤液可以分为早期、中期和晚期垃圾渗滤液。垃圾渗滤液是一种成分非常复杂的高浓度有机废水,高氨氮和高有机物是其重要的水质特征,它的高色度、强烈的刺激性以及大量的无机化合物均为渗滤液处理带来困难[1]。随着排放标准的愈加严格,高效处理垃圾渗滤液深度脱氮显得更加重要。
生物法由于经济、高效的特点,被广泛应用于垃圾渗滤液脱氮过程。传统的生物脱氮包括硝化和反硝化过程。反硝化过程往往是将硝化液与进水混合,利用进水碳源进行反硝化(即“前置反硝化”);或者在好氧硝化反应后的缺氧池中投加外碳源进行反硝化(即“后置反硝化”[2])。前置反硝化利用进水中碳源反硝化,减少去除有机物所需曝气,降低了能耗。其缺点是大量好氧区硝化液回流产生的运行成本、脱氮不完全等,尤其在处理垃圾渗滤液这类高氨氮废水过程中将使得出水不能达标排放。后置反硝化需要在后置缺氧段投加外碳源(甲醇等)作为反硝化碳源,然而这一做法不仅增加了运行成本还会使出水中有有机物。可见,如何利用原水中的有机物进行反硝化深度脱氮是经济、高效解决废水生物脱氮问题的关键。孙洪伟等[3]在缺氧段投加碳源的情况下采用单级SBR 好氧/缺氧运行方式实现了稳定的短程硝化和91.7%的TN 去除率。朱如龙等[4]采用3 次等量进水的脉冲式SBR 处理高氨氮实际垃圾渗滤液,在无外加碳源的情况下出水TN稳定在13.89~36.27 mg·L-1。王凯等[5]针对中期垃圾渗滤液,采用SBR 法交替曝气和搅拌至硝化结束,然后在不添加任何外碳源的条件下以充分缺氧搅拌至内源反硝化结束的方式使得出水TN<40 mg·L-1。PHAs、糖原作为聚糖菌(GAOs)和聚磷菌(PAOs)生理活动中的中间胞内产物,具有生物降解速率慢等特点,能被作为反硝化碳源[6]。SBR法AOA 运行方式下,利用PAOs 储存糖原作为缺氧段反硝化处理富含磷的实际市政污水脱氮除磷的研究已有报道[6-7]。Zhang 等[8]采用SBR 法AOA 运行方式在低曝气量、低负荷下形成了好氧颗粒污泥,在PAOs 的参与下以O2、NOx为电子受体,在好氧颗粒内部实现了氮、磷的同步去除。而在无外加碳源的情况下采用SBR 法AOA 运行方式,通过强化同步硝化反硝化和后置反硝化作用实现实际低磷废水深度脱氮的研究鲜有报道,尤其是对垃圾渗滤液深度脱氮过程的研究。
基于上述背景,本试验采用SBR 法“厌氧-好氧-缺氧”运行方式处理中期低磷垃圾渗滤液,探索在无外加碳源的情况下实现垃圾渗滤液的深度脱氮的可行性,研究其脱氮机理,力求建立一种经济、高效、简单的处理渗滤液的新技术。
1 材料和方法
1.1 试验装置和材料
本试验所采的SBR 反应器由聚乙烯塑料制成,内径20 cm,高为50 cm,有效体积为10 L。设在反应器底部的曝气头通过气体流量计与空气压缩机连接。采用鼓风曝气,电磁式空气压缩机(ACO-318,浙江)通过泵管依次通过气体流量计、多孔扩散器供给溶解氧。该反应器安置Multi340i 型便携式多功能测定仪,通过DO、pH、ORP 探头在线测定反应过程中的pH、DO 浓度、氧化还原电位(ORP)。采用转速可调的机械搅拌,温度由带有温度控制系统的加热棒调节,整个试验过程控制的反应器温度为(25±1)℃。
1.2 试验水质和接种污泥
本试验所采用的垃圾渗滤液取自北京六里屯填埋场。渗滤液呈黑褐色,有明显臭味,具体水质指标如表1所示,具有典型的中期垃圾渗滤液的特征。
SBR 反应器接种污泥取自本实验室处理晚期垃圾渗滤液的短程硝化污泥。运行期间MLSS=(9200±500) mg·L-1,MLVSS=(7000±450) mg·L-1,SRT 为25~30 d,温度控制在(25±1)℃,好氧阶段曝气量为120 L·h-1,好氧段DO 浓度在1 mg·L-1以下。
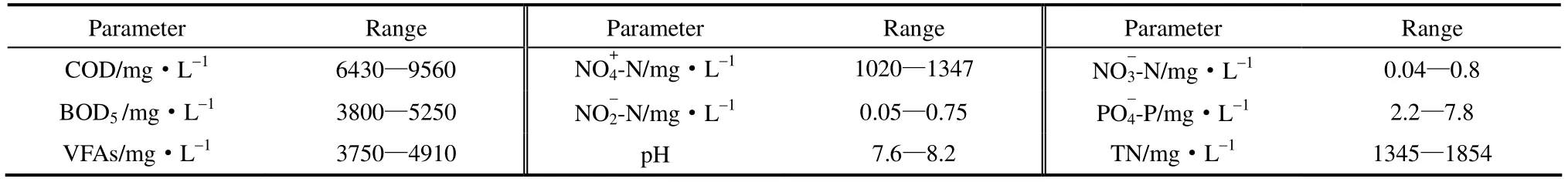
表1 垃圾渗滤液水质Table 1 Characteristics of landfill leachate
1.3 试验运行方法
为实现垃圾渗滤液深度脱氮,本试验运行分为两个阶段:启动阶段(start-up phase)和稳定运行阶段(stable phase)。采用图1所示运行方法进行运行。试验采用SBR 工艺厌氧(Ana)/好氧(Ox)/缺氧(Ano)交替的运行方式,排水比10%,每天运行一个周期。为了使接种污泥适应进水负荷,启动阶段进水分别由垃圾渗滤液用自来水稀释4 倍(0~14 d)、2 倍(15~28 d)所得,第29 d 以后进水都是未经稀释的垃圾渗滤液。在启动阶段,为了避免由于反硝化不完全破坏下个运行周期的厌氧环境,每周期排水结束后投加1~2 g乙酸钠作为外碳源反硝化剩余的亚硝酸盐、硝酸盐;当缺氧段搅拌16 h 后反硝化完全,出水基本没有NO-2-N 和NO-3-N,指示启动阶段结束,进入稳定阶段。启动阶段、稳定阶段采用实时控制(real-time control)策略通过DO 和pH 的变化判定硝化终点,稳定阶段通过ORP 和pH的变化判定反硝化终点[3,9]。
1.4 检测指标和测定方法
COD(指溶解性COD,重铬酸钾法),NH+4-N(纳氏试剂光度法),NO-2-N[N-(1-萘基)-乙二胺光度法],NO-3-N(麝香草酚法),MLSS 和MLVSS(滤纸重量法),磷酸盐(钼锑抗分光光度法),pH、DO、ORP 在线测定(WTW pH 340i、WTW DO 340i、WTW ORP 340i),TOC、TN 通过TOC/TN 分析仪(Multi N/C3000,德国耶拿)测定。活性污泥中的PHAs 采用气相色谱测定(采用Agilent 6890N 型气相色谱以及Agilent DB-1 型气相色谱柱),糖原采用蒽酮法测定,VFAs 采用气相色谱测定(Agilent6890N 型气相色谱及DB-WAXter 型色谱柱)。
1.5 计算方法
(1)NO-3-N、NO-2-N 以NO-3-Nequ为等价物的计算方法
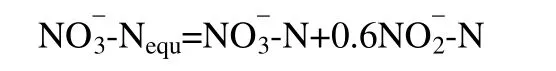
其中,NO-3-N、NO-2-N 为硝态氮、亚硝态氮质量浓度。
(2)平均反硝化速率为
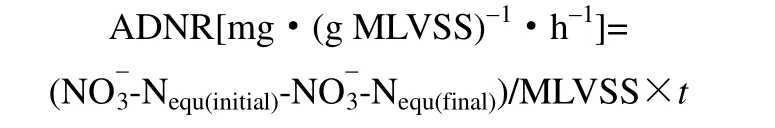
其中,NO-3-Nequ(initial)、NO-3-Nequ(final)为测量段的起始和最终NO-3-Nequ浓度。
2 结果和讨论
2.1 SBR 法厌氧/好氧/缺氧运行下实现垃圾渗滤液深度脱氮可行性分析
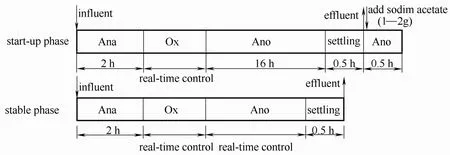
图1 启动阶段和稳定阶段的运行方式Fig.1 Operational mode of start-up phase and stable phase
在生物强化除磷(EBPR)系统中,聚糖菌(GAOs)的过度繁殖往往被认为是系统除磷效果恶化的主要原因[10]。GAOs 的代谢途径与PAOs 相似,仅能量来源不同,其主要特点是可以进行糖类的累积[11]。在厌氧条件下,GAOs 降解糖原为VFAs合成PHAs 提供所需的能量和还原力,而在随后的好氧条件下GAOs 能够氧化胞内PHAs 并促使微生物的生长繁殖和糖原再生。一般认为,厌氧/好氧运行方式下,进水中有限的P 元素或者较低的P/C 的比率有利于GAOs 的富集[12-13]。本试验中垃圾渗滤液的水质COD/P>800,属于低P 废水,利于GAOs的富集。Zhu 等[14]、Vocks 等[15]根据试验现象,推测了GAOs 的反硝化能力。Wang 等[16]、Zeng 等[17]已经证实了具有反硝化能力GAOs 的存在。胞内储存的 PHAs/糖原能作为反硝化的碳源已有报道[7,14,18-19]。在好氧条件下处理高氨氮垃圾渗滤液,氨氮能被氧化为硝态氮、亚硝态氮,若采用厌氧/好氧/缺氧运行方式,不仅有利于聚糖菌的生长,还能利用聚糖菌的反硝化能力去除氮素。
2.2 SBR 厌氧/好氧/缺氧运行方式下的碳源转化及脱氮途径
经过54 d 的驯化后,启动阶段完成。稳定运行超过90 d,进水COD、NH+4-N、TN 浓度分别为6430~9372 mg·L-1、1025.6~1327 mg·L-1、1345.7~1853.9 mg·L-1,出水COD、NH+4-N、TN浓度能达到525~943 mg·L-1、1.2~4.2 mg·L-1、18.9~38.9 mg·L-1,去除率分别达到了87.5%、99.4%、94.8%以上,出水水质达到垃圾渗滤液氮的排放标准。
为了探究厌氧(Ana)/好氧(Ox)/缺氧(Ano)运行方式下的脱氮途径,选取了第115 d 进行了全周期试验。反应器中MLSS=9430 mg·L-1,MLVSS=6708 mg·L-1,进水COD、NH+4-N、TN 浓度分别为6914.8、1213.6 和1885.8 mg·L-1,但由于10%的进水进入反应器后的混合稀释,混合液起始COD、NH+4-N、TN 分别为1431.0、123.6、234.1 mg·L-1。反应周期内氮素和正磷酸盐的变化如图2所示,在整个反应周期内的浓度一直保持在比较低的水平,并没有明显的释磷和吸磷的过程。由此可以断定,在此过程中并没有聚磷菌的参与。
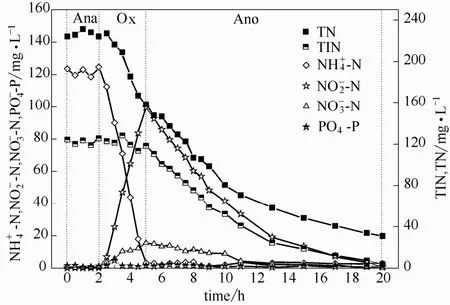
图2 典型周期内氮素和磷酸盐的变化Fig.2 Variations of nitrogen and orthophosphate in a typical cycle of anaerobic/aerobic/anoxic process
2.2.1 厌氧段底物吸收与碳源储存 图3给出了“厌氧/好氧/缺氧”SBR 厌氧段底物及胞内碳源的变化情况。可以看出,2 h 的厌氧运行条件下,COD降低,与此同时胞内的糖原、PHAs 的含量分别出现了降低和升高趋势,然而氨氮、亚硝态氮、硝态氮、总氮等并没有发生明显的变化。说明SBR 长期在该运行方式下,选择出的微生物种群在底物很充足的情况下具有很强的PHA 储存能力和较低的生长速率。经过对底物的分析发现,进水挥发性脂肪酸(VFAs)含量为4425.41 mg COD·L-1,其中乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸含量分别为1845.60、1311.27、108.15、11.30、106.41、17.72 mg·L-1,约占进水COD 中的64.0%。厌氧段的2 h 内,VFAs、COD 的降低均呈现出先快后慢的现象,乙酸、丙酸为垃圾渗滤液中VFAs 的主要成分,丙酸的吸收速率大于乙酸的吸收速率。混合液中COD 降低447.4 mg·L-1,其中VFAs基本被吸收完(415.26 mg COD·L-1),占降低COD 的92.8%,说明VFAs 为厌氧底物吸收过程中的主要有效成分,除此之外也有少数其他种类碳源被储存。
表2进一步给出了以实际垃圾渗滤液为底物的厌氧底物吸收与碳源储存情况,与文献[21-22]给出的聚糖菌的厌氧底物吸收规律较一致,在没有明显磷释放的情况下,随着PHAs 的增加,底物碳源被吸收。由于本试验采用的污泥浓度(MLSS)高达9430 mg·L-1,所以在高浓度进水下,底物吸收仅12.2 mg C·(g MLSS)-1,而PHAs 仅增量5.6 mg·(mg MLSS)-1。在PHAs 的3 种主要成分(PHB、PHV、PH2MV)中,以实际垃圾渗滤液为底物储存的产物以PHV(74.7%)和PHB(25.3%)为主,并未检测到明显的PH2MV 含量。
2.2.2 好氧段碳源和氮素的变化 如图4所示,随着曝气开始,COD 由983.5 mg·L-1随着好氧反应进行不断降低(2~4.5 h),第4.5 h 之后COD 并没有降低(4.5~5 h),氨氧化结束时COD 为750.6 mg·L-1。可见,可生物降解COD 在厌氧阶段未完全被储存利用,从另一方面证实了聚糖菌厌氧储存碳源对可生物降解有机物具有选择性。在曝气阶段,随着PHAs 的降解,胞内糖原含量呈现回升的趋势,分别达到778.6 mg COD·L-1和1560.9 mg COD·L-1。
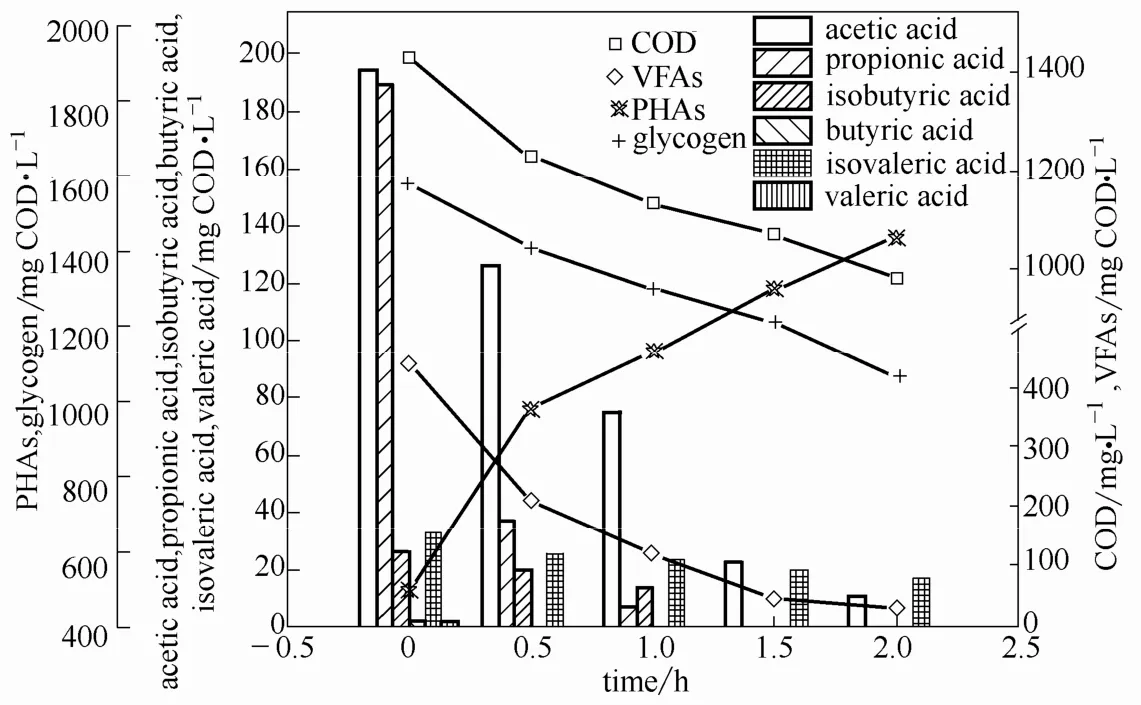
图3 厌氧底物吸收及储存性碳源的变化Fig.3 Anaerobic substrate uptake and variations of stored carbon source
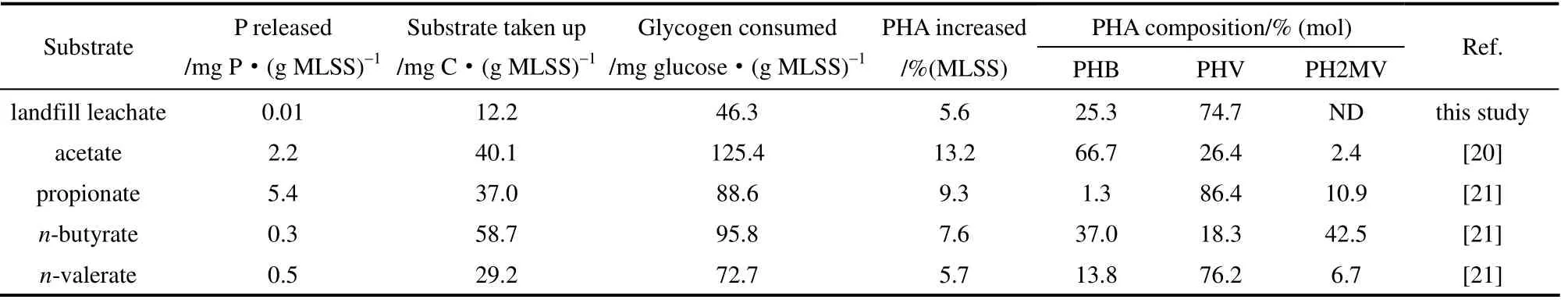
表2 厌氧/好氧/缺氧运行方式下厌氧底物吸收及碳源转化Table 2 Anaerobic substrate uptake and carbon storage in anaerobic/aerobic/anoxic process
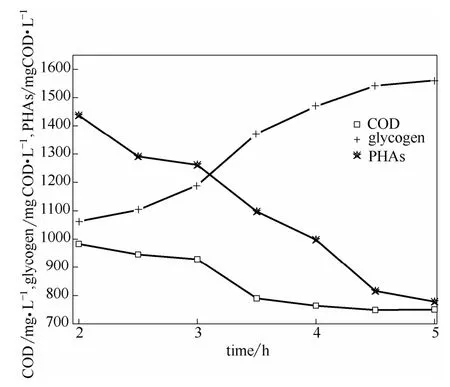
图4 好氧阶段COD 及储存性碳源的变化Fig.4 Variations of COD and stored carbon source in aerobic stage
如图2所示,在降解有机物的同时,NH+4-N 不断被转化为亚硝态氮和硝态氮,浓度由曝气开始时224.7 mg·L-1降为3.2 mg·L-1,此时硝态氮浓度为15.6 mg·L-1,而亚硝态氮浓度为99.6 mg·L-1,亚硝态氮积累率为86.5%。这说明反应器过程中亚硝酸盐氧化菌(NOB)的活性受到抑制,反应过程已稳定维持短程生物脱氮。由此阶段 TN 的变化可知在好氧情况下发生了同步硝化反硝化(SND),系统 TN 浓度由曝气开始时234.1 mg·L-1降为硝化结束时158.7 mg·L-1,共减少了75.4 mg·L-1,在不考虑微生物生长所需要的氮以及中间产物 NO、N2O等逸出所造成的氮损失,可以认为这部分氮是通过同步硝化反硝化去除的。低DO 环境下,硝化反应能被一定程度地抑制而反硝化反应加强[22]。本试验好氧阶段溶解氧保持在1 mg·L-1以下,这也为同步硝化反硝化反应提供了局部缺氧环境,而其反硝化碳源可能来源于好氧阶段减少的COD(降低232.89 mg·L-1)及储存性碳源PHAs 和糖原。
2.2.3 缺氧/反硝化氮变化规律 如图2、图5所示,缺氧段的COD 浓度在720 mg·L-1左右,并没有明显的变化,而TN 由曝气结束时的158.67 mg·L-1降低到30.84 mg·L-1,出水TIN 为3.74 mg·L-1,达到了氮的排放标准。说明这部分难降解有机物并不能被微生物反硝化所利用,在缺氧反硝化过程中,水中的有机物并没有提供碳源,而储存性碳源PHAs 和糖原能成为促进反硝化的碳源。而Smolders等[23]、Murnleitner 等[24]认为PHAs 在曝气过程中会消耗完而不能成为反硝化碳源。主要原因可能在于厌氧阶段PHAs 储存量以及好氧结束剩余PHAs 含量不同。如图2所示,系统有机氮(TON=TN-TIN)在缺氧区没有明显的变化,TN 的下降趋势与TIN的下降趋势较一致,可以通过NO-3-Nequ的变化来表征反硝化速率(图5)。从NO-3-Nequ的变化和储存性碳源的变化趋势发现在t=10 h 时出现了变化拐点:t=5~10 h,PHAs 呈下降趋势而糖原下降趋势并不明显,平均反硝化速率(ADNR)为1.24 mg NO-3-N·h-1·(g MLVSS)-1;t=10~20 h,PHAs 含量稳定而糖原呈现下降趋势,平均反硝化速率(ADNR)为0.50 mg NO-3-N·h-1·(g MLVSS)-1。

图5 缺氧段NO-3-Nequ 和碳源的变化趋势Fig.5 Variations of NO-3-Nequ and carbon source in anoxic stage
从图5中NO-3-Nequ的变化趋势可以看出,本试 验反硝化过程中至少存在PHAs 和糖原两种碳源,虽然PHAs 的含量低于糖原,但是PHAs 仍是更容易利用的反硝化碳源。当PHA 不能被利用后(t=10 h),微生物则利用另一种碳源糖原,平均反硝化速率也大大降低。研究发现以PHAs 为碳源DNR 为1.12~10.8 mg NO-3-N·h-1·(g MLVSS)-1[25],而以胞内糖原为碳源的 DNR 为 0.19 ~1.10 mg NO-3-N·h-1·(g MLVSS)-1[6],与本试验得出的结果相近。
2.3 以DO、ORP 和pH 作为脱氮过程控制参数的可行性验证
SBR 系统中,硝化反硝化过程中pH、DO、ORP的变化与溶解性COD 降解以及与NH+4-N、NO-2-N、NO-3-N 转化具有相关性,以pH、DO、ORP 作为SBR 法处理废水生物脱氮过程控制参数也是可行的[9]。然而,无外加碳源情况下,厌氧/好氧/缺氧运行下脱氮过程的控制参数有待证实。本试验采用该过程控制参数实时控制,在上述典型周期内,pH、DO、ORP 的变化如图6所示,当NH+4-N 全部降解完时,pH 曲线、DO 浓度曲线分别出现了“氨谷(ammonia valley)”和“DO 突跃点(DO break point)”;而反硝化结束时,pH 曲线、ORP 曲线分别出现了“亚硝酸盐膝(nitrite knee)”和“亚硝酸盐肘(nitrite apex)”。可见,硝化反硝化反应的过程与反应器内pH、DO 和ORP 的变化规律具有很好的相关性,通过实时控制pH、DO 和ORP 曲线上的特征点,可以判定好氧氨氧化终点和反硝化终点。
3 结 论
采用SBR 工艺,以厌氧/好氧/缺氧运行方式,处理实际中期垃圾渗滤液,好氧段DO 低于1 mg·L-1,在稳定运行阶段可以得出以下主要结论:
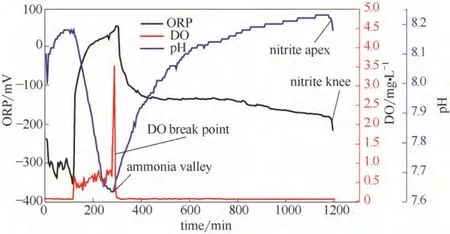
图6 SBR 典型周期内脱氮过程DO、pH、ORP 的变化规律Fig.6 Typical variations of DO,pH and ORP during SBR process
(1)采用单级SBR“厌氧/好氧/缺氧”运行方式处理中期垃圾渗滤液,能够通过同步硝化反硝化和后置缺氧反硝化两种途径深度脱氮,出水TN<40 mg·L-1;好氧段去除TN 约占总去除量的1/3;缺氧后置反硝化去除的TN 占总去除量的2/3。
(2)该过程实现了具有反硝化能力聚糖菌的富集,储存的碳源(PHAs、胞内糖原)在缺氧段能作为反硝化的碳源。
(3)至少存在PHAs 和糖原这两种后置反硝化碳源。当PHAs 为主要碳源,平均反硝化速率(ADNR)为1.24 mg NO-3-N·h-1·(g MLVSS)-1;以糖原为主要碳源,平均反硝化速率(ADNR)为0.50 mg NO-3-N·h-1·(g MLVSS)-1。
(4)厌氧储存PHAs 是形成良好脱氮效果的关键。垃圾渗滤液中高含量的挥发性脂肪酸(VFAs)是形成较高PHAs 储存量和胞内糖原的重要原因。
[1]Wang Baozhen (王宝贞),Wang Lin (王琳).Treatment and Disposal of Landfill Leachate from Municipal Solids Waste (城市固体废物渗滤液处理与处置) [M].Beijing:Chemical Industry Press,2005
[2]Grady C P L,Daigger G T,Lim H C.Rotating Biological Contactor [M].New York:Marcel Dekker,1999
[3]Sun Hongwei(孙洪伟),Wang Shuying(王淑莹),Wang Ximing(王希明),Shi Xiaoning(时晓宁),Peng Yongzhen(彭永臻).Advanced nitrogen removal from landfill leachate with highly concentrated ammonia nitrogen via nitrite in SBR [J].CIESC Journal(化工学报),2009,60(7):1806-1811
[4]Zhu Rulong(朱如龙),Wang Shuying(王淑莹),Li Jun (李军),Wang Kai (王凯),Miao Lei (苗蕾),Peng Yongzhen(彭永臻).Advanced nitrogen removal of landfill leachate in single stage oxic pulsed SBR process [J].CIESC Journal(化工学报),2012,63(10):3262-3268
[5]Wang Kai (王凯),Wang Shuying(王淑莹),Zhu Rulong(朱如龙),Miao Lei (苗蕾),Peng Yongzhen(彭永臻).Startup and realization of advanced nitrogen removal of landfill leachate by modified SBR [J].Journal of Southeast University:Natural Science Edition(东南大学学报:自然科学版),2013,43(2):386-391
[6]Coats E R,Mockos A,Loge F J.Post-anoxic denitrification driven by PHA and glycogen within enhanced biological phosphorus removal [J].Bioresource Technology,2011,102:1019-1027
[7]Winkler M,Coats E R,Brinkman C K.Advancing post-anoxic denitrification for biological nutrient removal [J].Water Research,2011,45:6119-6130
[8]Zhang H M,Dong F,Jiang T,Wei Y,Wang T,Yang F L.Aerobic granulation with low strength wastewater at low aeration rate in A/O/A SBR reactor [J].Enzyme and Microbial Technology,2011,49:215-222
[9]Yang Q,Gu S B,Peng Y Z,Wang S Y,Liu X H.Progress in the development of control strategies for the SBR process [J].CLEAN-Soil,Air,Water,2010,38(8):732-749
[10]Wang Y Y,Lu W M,Yang J,et al.A metabolic model and impact factors based on competition between glycogen accumulating organisms and phosphorus accumulating organisms in wastewater treatment [J].Acta Scientiae Circumstantiae,2009,29(6):1131-1138
[11]Mino T,Liu W,Kurisu F,Matsuo T.Modelling glycogen storage and denitrification capability of microorganisms in enhanced biological phosphate removal processes [J].Water Science and Technology,1995,31(2):25-34
[12]Filipe C,Daigger G T,Grady C.pH as a key factor in the competition between glycogen-accumulating organisms and phosphorus-accumulating organisms [J].Water Environment Research,2001,73(2):223-232
[13]Liu W,Nakamura K,Matsuo T,Mino T.Internal energy-based competition between polyphosphate-and glycogen-accumulating bacteria in biological phosphorus removal reactors—effect of PC feeding ratio [J].Water Research,1997,31(6):1430-1438
[14]Zhu R L,Wang S Y,Li J,Wang K,Miao L,Ma B,Peng Y Z.Biological nitrogen removal from landfill leachate using anaerobic-aerobic process:denitritationviaorganics in raw leachate and intracellular storage polymers of microorganisms [J].Bioresource Technology,2013,128:401-408
[15]Vocks M,Adam C,Lesjean B,Gnirss R,Kraume M.Enhanced post-denitrification without addition of an external carbon source in membrane bioreactors [J].Water Research,2005,39(14):3360-3368
[16]Wang X L,Zeng R,Dai Y,Peng Y Z,Yuan Z G.The denitrification capability of clusterDefluviioccus vanus-related glycogen-accumulating organisms [J].Biotechnology and Bioengineering,2008,99(6):1329-1336
[17]Zeng R,Lemaire R,Yuan Z,Keller J.A novel wastewater treatment process:simultaneous nitrification,denitrification and phosphorus removal [J].Water Science & Technology,2004,50(10):163-170
[18]Chen H B,Yang Q,Li X M,Wang Y,Luo K,Zeng G M.Post-anoxic denitrificationvianitrite driven by PHB in feast-famine sequencing batch reactor [J].Chemosphere,2013,92(10):1349-1355
[19]Wang K,Wang S Y,Zhu R L,Miao L,Peng Y Z.Advanced nitrogen removal from landfill leachate without addition of external carbon using a novel system coupling ASBR and modified SBR [J].Bioresource Technology,2013,134:212-218
[20]Liu W,Mino T,Nakamura K,Matsuo T.Glycogen accumulating population and its anaerobic substrate uptake in anaerobic-aerobic activated sludge without biological phosphorus removal [J].Water Research,1996,30(1):75-82
[21]Liu W,Mino T,Nakamura K,Matsuo T.Role of glycogen in acetate uptake and polyhydroxyalkanoate synthesis in anaerobic-aerobic activated sludge with a minimized polyphosphate content [J].Journal of Fermentation and Bioengineering,1994,77(5):535-540
[22]Meng Q J,Yang F L,Liu L F,Meng F G.Effects of COD/N ratio and DO concentration on simultaneous nitrifcation and denitrifcation in an airlift internal circulation membrane bioreactor [J].Journal of Environmental Sciences,2008,20(8):933-939
[23]Smolders G,Vandermeij J,Vanloosdrecht M,Heijnen J J.A structured metabolic model for anaerobic and aerobic stoicchiometry and kinetics of the biological phosphorus removal process [J].Biotechnology and Bioengineering,1995,47(3):277-287
[24]Murnleitner E,Kuba T,Vanloosdrecht M,Heijnen J J.An integrated metabolic model for the aerobic and denitrifying biological phosphorus removal [J].Biotechnology and Bioengineering,1997,54(5):434-450
[25]Carvalho G,Lemos P C,Oehmen A,Reis M.Denitrifying phosphorus removal:Linking the process performance with the microbial community structure [J].Water Research,2007,41(19):4383-4396

