安徽省奶牛养殖场粪便中甾体雌激素污染特征研究
张梦涛,郑 溪,曹 飞,袁守军,2*
(1.合肥工业大学土木与水利工程学院,安徽合肥 230009;2.南京大学污染控制与资源化国家重点实验室,江苏南京 210046)
天然甾体雌激素是人及哺乳动物排泄的内源雌激素,主要包括雌酮(Estrone,E1)、17α-雌二醇(17α-estradiol,17α-E2)、17β-雌二醇(17β-estradiol,17β-E2)和雌三醇(Estriol,E3)[1]。水体环境中,ng/L级的雌激素即表现出较强的环境风险,如导致雄鱼的雌化[2-4]。畜禽粪便是环境中天然甾体雌激素的重要来源之一[5-6],而根据 Lange 等[7-8]的统计资料,禽畜粪便中雌激素的含量又以奶牛场废弃物中所占比例最大。近年来,随着人们对乳肉制品需求量的增加,全国奶牛养殖业有了长足发展。据《2011年中国奶业统计摘要》统计,2009年安徽省内奶牛存栏量达6.83万头。而目前,除了少量大型养殖场外,安徽省内奶牛养殖场中几乎无标准的污水处理系统和沼气利用系统;奶牛粪便的处置方式大多为收集后倒至空旷地,经堆放后作为肥料使用。
安徽省含长江和淮河两大重要水系,其中长江水系安徽段还包括我国第五大淡水湖巢湖。在沿江、沿湖地带,露天堆置的牛粪受雨水冲刷,极易造成对地表水体的污染[9],同时也可能通过渗流等作用污染地下水[10-12]。而目前,关于安徽省奶牛养殖废弃物中甾体雌激素的污染现状尚不清楚;开展相关的调查工作,阐明奶牛粪便中雌激素的含量特征,可为安徽省奶牛养殖场的科学管理及甾体雌激素的有效去除提供技术参考。
1 材料与方法
1.1 仪器与试剂 气相色谱质谱仪(QP2010S型,日本岛津,带AOC-20i自动进样器);恒温振荡器(THZ-82型,常州市国华电器有限公司);台式高速冷冻离心机(5810R型,德国Eppendorf公司);保温箱(AS2200,平湖美嘉保温容器有限公司);冷冻干燥机(Bench Top 2K型,美国VirTis公司);旋涡混合器(QL-861型,江苏海门其林贝尔仪器制造有限公司);循环水式多用真空泵(SHB-ⅢG型,郑州长城科工贸有限公司);超声波清洗器(KQ-100E,昆山市超声仪器有限公司);氮吹仪(HSC-12A型,天津市恒奥科技发展有限公司);固相萃取仪(Visiprep DL,美国Supelco公司);玻璃纤维滤膜(GF/F,Ø47 mm,美国 Whatman 公司);固相萃取(SEP)柱(ENVI-18,6 ml,500 mg,美 国 Supelco 公 司);dSPE 柱(Mg2SO4150 mg,PSA 50 mg,2 ml,上海安谱公司)。
E1、17β-E2-d3、17α-E2 和 17β-E2(纯度均 >98%)购自于美国Sigma-Aldrich公司,E3(USP)购自aladdin公司,N,O-双(三甲基硅烷)三氟乙酰胺(BSTFA,99%)购自美国REGIS公司,乙腈(GC级)、甲醇(GC级)、乙酸乙酯(GC级)和N,N-二甲基甲酰胺(DMF)均购自上海安谱科学仪器有限公司,丙酮(HPLC级)购自美国Tedia试剂公司,乙醚(AR)购自上海试一化学试剂有限公司。
1.2 样品采集 牛粪样品采自安徽省6个典型的集中式奶牛养殖场(图1),各奶牛养殖场基本信息如表1所示。采样过程中,分别采集青年期(12~24月)、干奶期(产犊前的2个月)和泌乳期[13](从产犊开始直至停止产奶,一般10个月左右)的奶牛粪便;为保证所取样品具有代表性,每个样品采集时,在畜棚内随机选取6个采样点,在每个采样点采集约500 g新鲜牛粪,然后充分混合,加入2 mol/L的H2SO425 ml进行酸化处理后,放入保温盒中,于24 h内进行后续处理、分析样品中雌激素的含量。
为了评估规模化奶牛养殖场对养殖场附近环境的影响,在b养殖场牛粪堆积场附近分别采集土样(地面以下5~10 cm)及地表水样。土样采集方法同牛粪样品;水样采集时,在水面以下约0.5 m处随机选择3个采样点,每点采集1 L样品,用5 ml 2 mol/L的H2SO4溶液酸化,至实验室后进行混合。所有样品采集后均放入保温箱,并尽快运至实验室,在24 h内进行后续处理、分析样品中雌激素的含量。

表1 各采样点详情
1.3 样品前处理
1.3.1 固体样品前处理。将奶牛粪便及土样放入冷冻干燥机,冻干后研碎。称取0.50 g置于50 ml具塞离心管中,加入10 ml去离子水,并用盐酸调节pH=2,涡旋混合1 min,然后加入10 ml乙醚,加盖振荡20 min,在10 000 r/min条件下离心5 min,重复以上操作3次。将提取液转移至50 ml血清瓶中,用轻柔氮气吹干,然后采用1 ml乙腈溶解,并转移至1.5 ml的dSPE柱中手动振荡4 min,10 000 r/min离心3 min后,取0.6 ml上清液至GC样品瓶中,以轻柔氮气吹干,待衍生化处理。
1.3.2 水样前处理。取500 ml水样,采用玻璃纤维膜过滤以去除悬浮杂质,然后用1 mol/L的HCl调节pH=2.0,以15 ml/min的流速通过SPE柱(SPE柱在使用前分别用3 ml的乙酸乙酯/丙酮溶液(V∶V=1∶1)、3 ml的甲醇和 3 ml pH=2的水活化)。用5 ml的甲醇/水(V∶V=4∶6)清洗SPE 柱,真空干燥1 h,最终以8 ml乙酸乙酯/丙酮(V∶V=1∶1)洗脱样品。洗脱液以轻柔氮气吹干,然后采用1 ml乙腈定容,并转移至GC样品瓶中,以轻柔氮气吹干,待衍生化处理。
1.4 衍生化 采用硅烷化试剂BSTFA作为衍生化试剂。向待衍生化样品中加入0.100 ml BSTFA,然后加入0.400 ml DMF,加盖密封,在室温条件下反应24 h,然后采用GC-MS测定样品中的雌激素浓度。
1.5 气相色谱-质谱条件 色谱柱为SHRX-5MS毛细管柱(0.25 μm ×0.25 μm ×30 m,美国 J&W 科技公司);柱温采用一阶升温程序控制:起始柱温为80℃,并保持1 min,然后以20℃/min的速度使最终柱温达到310℃,并保持6 min;载气为高纯氦气,载气线速度为30.0 cm/s,采用分流进样,分流比为1,进样口温度为260℃;电离源为离子源,电子能量为70 eV,离子源温度为220℃,传输线温度为250℃,溶剂延迟时间为3 min。利用全范围扫描(Scan)和选择性离子模式(Selected Ion Monitoring,SIM)来进行质谱分析。根据Scan谱图扫描的结果(m/z为50~510),确定各化合物的特征离子。对于17α-E2和17β-E2衍生化后的产物,质荷比m/z=416;对于E1衍生化后的产物,质荷比m/z=342;对于E3衍生化后的产物,质荷比m/z=504;对于17β-E2-d3衍生化后的产物,质荷比m/z=419。雌激素的衍生化产物的质谱图如图2所示。
1.6 方法有效性验证 对粪便样品和水样进行梯度加标试验,粪便样品加标量分别为100、400和1 600 μg/kg,水样加标量分别为100、400和1 000 ng/L。方法重现性通过加标回收率的相对标准偏差(RSD)来评估(n=3~6)。各加标水平下,固体样品的RSD为4.5% ~25.9%,液体样品的RSD为3.2% ~21.9%。检出限(LOD)和定量限(LOQ)分别为3倍和10倍信噪比对应的浓度。在10~2 000 μg/kg(对应水样的浓度为10~2 000 ng/L)浓度范围内,设备线性良好。相关方法有效性验证参数如表2所示。
2 结果与分析

表2 方法有效性验证参数
2.1 甾体雌激素含量特征 分别对6个奶牛养殖场中青年期、干奶期和泌乳期奶牛粪便中甾体雌激素含量进行测定分析,结果如图3所示。与Hanselman等[14]的研究结果一致,奶牛粪便均监测到E1、17α-E2和17β-E2。除了在养殖场a的青年期奶牛和养殖场e的干奶期奶牛和泌乳期奶牛样品中检测到E3外,其余样品均未检测到E3。E3主要分布于奶牛的尿液中[15],所以养殖场a和e中测得的E3可能是由于牛粪样品中混入尿液引起的。
处于不同生理阶段的奶牛的雌激素排泄量存在显著性差异(P=0.000 14<0.01)。青年期奶牛粪便中雌激素的浓度最低,平均为 432.90 μg/kg(RSD=20.05%);干奶期奶牛次之,为1 114.51 μg/kg(RSD=23.88%);泌乳期奶牛最高,为1 540.13 μg/kg(RSD=30.25%),这一结论与我国东北地区所得数据类似[16]。除养殖场e和f牛粪中E1所占比例较高外,各种雌激素(主要是 E1、17α-E2和17β-E2)所占比例也较为相近。可见,不同养殖场中,相同生理时期的奶牛,雌激素的排放总量和比例均较为相似。
2.2 奶牛养殖场雌激素的污染潜力分析 由于不同雌激素的活性不同,试验中采用17β-E2活性当量(EEQ)来表征样品中总雌激素当量浓度,如式(1)所示。
式中,EEQ为样品中总雌激素的17β-E2当量值,μg/kg;EEFi为不同雌激素的17β-E2活性当量系数,其中E1、17α-E2和17β-E2 的EEFi值分别为 0.15、0.03 和 1.00[17-18];ci为各雌激素平均浓度,μg/kg。
奶牛的最佳经济效益周期一般为6年[19],其中,青年期以前(0~12个月)雌激素排放量较少,可忽略不计;12~24个月处于青年期,此后4年每年两个月处于干奶期,10个月处于泌乳期(即4年中奶牛有0.67年处于干奶期,3.33年处于泌乳期)。安徽省奶牛存栏量为6.83万头,单头奶牛日排泄粪便约4.51 kg[20]。结合上述雌激素浓度等数据,可计算出安徽省奶牛养殖场雌激素排泄当量,结果如表3所示。
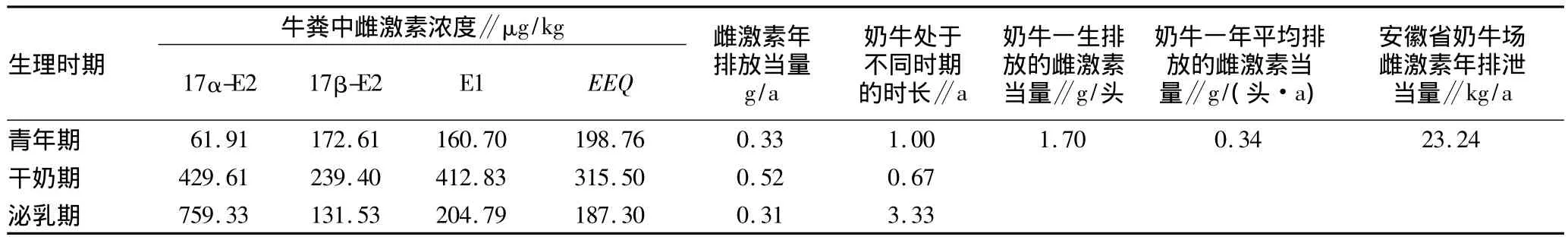
表3 安徽省奶牛养殖场奶牛粪便雌激素排泄当量计算
由表3可知,奶牛通过粪便年平均排放的雌激素当量为0.34 g/(头·a),即日平均排放的雌激素当量为931.51 μg/(头·d)。安徽省奶牛场牛粪中雌激素年排泄当量为23.24 kg/a。因此,若处置不当,奶牛粪便中大量雌激素进入环境,则会对周边水体及土壤环境造成严重危害。由表1可知,安徽省奶牛养殖场粪便大多数采用自然堆置,部分采用厌氧发酵处理;而研究表明[21-23],厌氧工艺对雌激素的去除率低下。因此,合理的奶牛粪便管理措施及高效的雌激素处理工艺的开发显得尤为迫切。
2.3 奶牛养殖场周边环境中雌激素污染特征 奶牛养殖场附近地表水体和粪便堆积场土样中雌激素浓度如图4所示。水样和土样中雌激素当量浓度分别为1 252.02 ng/L和1 424.21 μg/kg。不同于粪便样品,在地表水样和堆积场土壤样品中雌激素主要为17β-E2(分别占雌激素总量的91.88%和94.23%)。而研究表明[24-25],奶牛尿液中通常含有较高浓度雌激素17β-E2。可见,除了奶牛粪便以外,尿液中雌激素的污染潜力也不容忽视。另外,粪便及尿液中以结合态存在的雌激素对环境也存在一定污染,在微生物作用下,结合态雌激素转化为活性更高的游离态雌激素[26-27],并在径流和入渗等过程进入环境,从而对周边水体及土壤造成污染。
3 结论
通过对安徽省主要集约化奶牛养殖场粪便中甾体雌激素调查发现,养殖场粪便中甾体雌激素主要以E1、17α-E2和17β-E2 3种形式存在;不同采样点牛粪中雌激素总量和及各单一雌激素比例无明显差异。
调查结果显示,奶牛日排泄雌激素当量值为931.51 μg/(头·d),安徽省奶牛经由粪便的年雌激素排泄当量为23.24 kg/a。若处置不当,奶牛养殖场将会对周边水体及土壤环境造成严重危害。
奶牛养殖场附近水体和土样中雌激素的当量浓度分别为 1 252.02 ng/L 和 1 424.21 μg/kg。若受污染的水流入附近水系或者堆积场土样中雌激素随降水渗入地下水,则会对周边环境带来严重的生态环境风险。因此,对于集约化奶牛养殖场需要采取更为科学合理的管理方法,妥善处理及回用养殖场废弃物,最大程度降低养殖场粪便中甾体雌激素的环境风险。
[1]TERNES T A,KRECKEL P,MUELLER J.Behaviour and occurrence of estrogens in municipal sewage treatment plants——II.Aerobic batch experiments with activated sludge[J].The Science of the Total Environment,1999,225(1/2):91 -99.
[2]ORN S,HOLBECH H,MADSEN T H,et al.Gonad development and vitellogenin production in zebrafish(Danio rerio)exposed to ethinylestradiol and methyltestosterone[J].Aquatic Toxicology,2003,65(4):397 -411.
[3]SANTOS L H,ARAJO A,FACHINI A,et al.Ecotoxicological aspects related to the presence of pharmaceuticals in the aquatic environment[J].Journal of Hazardous Materials,2010,175(1):45 -95.
[4]张照斌,胡建英,赛思翔,等.青鳉鱼ERRα的克隆、序列分析、组织表达及其对不同 EDCs暴露的响应[J].环境科学,2008,29(11):3153-3158.
[5]LIU S,YING G G,ZHANG R Q,et al.Fate and occurrence of steroids in swine and dairy cattle farms with different farming scales and wastes disposal systems[J].Environmental Pollution,2012,170:190 -201.
[6]刘姝芳,李艳霞,张雪莲,等.东北三省畜禽养殖类固醇激素排放及其潜在污染风险[J].环境科学,2013,34(8):3180 -3187.
[7]JOHNSON A C,WILLIAMS R J,MATTHIESSEN P.The potential steroid hormone contribution of farm animals to freshwaters,the United Kingdom as a case study[J].Science of the Total Environment,2006,362(1/3):166-178.
[8]LANGE I G,DAXENBERGER A,SCHIFFER B,et al.Sex hormones originating from different livestock production systems:fate and potential disrupting activity in the environment[J].Analytica Chimica Acta,2002,473(1):27-37.
[9]YANG Y Y,GRAY J L,FURLONG E T,et al.Steroid hormone runoff from agricultural test plots applied with municipal biosolids[J].Environmental Science & Technology,2012,46(5):2746 -2754.
[10]STEINER L D,BIDWELL V J,DI H J,et al.Transport and modeling of estrogenic hormones in a dairy farm effluent through undisturbed soil lysimeters[J].Environmental Science & Technology,2010,44(7):2341 -2347.
[11]ARNON S,DAHAN O,ELHANANY S,et al.Transport of testosterone and estrogen from dairy-farm waste lagoons to groundwater[J].Environmental Science & Technology,2008,42(15):5521 -5526.
[12]BARTELT-HUNT S,SNOW D D,DAMON-POWELL T,et al.Occurrence of steroid hormones and antibiotics in shallow groundwater impacted by livestock waste control facilities[J].Journal of Contaminant Hydrology,2011,123(3/4):94 -103.
[13]NU'ÑEZ-DOMÍNGUEZ R,CUNDIFF L,DICKERSON G,et al.Lifetime production of beef heifers calving first at two vs three years of age[J].Journal of Animal Science,1991,69(9):3467 -3479.
[14]HANSELMAN T A,GRAETZ D A,WILKIE A C.Manure-borne estrogens as potential environmental contaminants:A review[J].Environmental Science & Technology,2003,37(24):5471 -5478.
[15]ERB R E,RANDEL R D,MELLIN T N,et al.Urinary estrogen excretion rates during pregnancy in the bovine[J].Journal of Dairy Science,1968,51(3):416 -419.
[16]HAN W,LI Y X,YANG M,et al.Presence and determination of manureborne estrogens from dairy and beef cattle feeding operations in northeast China[J].Bulletin of Environmental Contamination and Toxicology,2011,86(5):465 -469.
[17]邵晓玲.城市水循环中环境激素的变化规律与KMnO4控制效能研究[D].哈尔滨:哈尔滨工业大学,2009:42 -43.
[18]吴世闽,贾瑷,彭辉,等.辽东湾海水中甾体雌激素的检测及生态风险评价[J].中国环境科学,2011,31(11):1904 -1909.
[19]NUNEZ-DOMINGUEZ R,CUNDIFF L V,DICKERSON G E,et al.Lifetime production of beef heifers calving first at two vs three years of age[J].Journal of Animal Science,1991,69(9):3467 -3479.
[20]HAYNES R J,WILLIAMS P H.Nutrient cycling and soil fertility in the grazed pasture ecosystem[J].Advances in Agronomy,1993,49:119 -199.
[21]ZHENG W,LI X,YATES S R,et al.Anaerobic transformation kinetics and mechanism of steroid estrogenic hormones in dairy lagoon water[J].Environmental Science & Technology,2012,46(10):5471 -5478.
[22]YANG Y Y,BORCH T,YOUNG R B,et al.Degradation kinetics of testosterone by manure-borne bacteria:Influence of temperature,pH,glucose amendments,and dissolved oxygen[J].Journal of Environmental Quality,2010,39(4):1153 -1160.
[23]COMBALBERT S,HERNANDEZ-RAQUET G.Occurrence,fate,and biodegradation of estrogens in sewage and manure[J].Applied Microbiology and Biotechnology,2010,86(6):1671 -1692.
[24]ZHANG H,SHI J,LIU X,et al.Occurrence and removal of free estrogens,conjugated estrogens,and bisphenol A in manure treatment facilities in East China[J].Water research,2014,58:248 -257.
[25]ZHANG H,SHI J,LIU X,et al.Occurrence of free estrogens,conjugated estrogens,and bisphenol A in fresh livestock excreta and their removal by composting in North China[J].Environ Sci Pollut Res,2014,21(16):9939-9947.
[26]KUMAR V,NAKADA N,YASOJIMA M,et al.The arrival and discharge of conjugated estrogens from a range of different sewage treatment plants in the UK[J].Chemosphere,2011,82(8):1124 -1128.
[27]TERNES T A,STUMPF M,MUELLER J,et al.Behavior and occurrence of estrogens in municipal sewage treatment plants——I.Investigations in Germany,Canada and Brazil[J].The Science of the Total Environment,1999,225(1/2):81-90.

