甲状腺乳头状癌中KAI1的表达及意义
王晓明 卢秀波 吕金锋
1)河南省焦作市焦作煤业(集团)有限责任公司中央医院普外科 焦作 454000 2)郑州大学第一附属医院 郑州 450052
Dong JT[1]于1995年首先报道了位于人染色体11P11.2位点的基因,认为它对前列腺癌转移的抑制具有特异性,而对肿瘤原发病灶的生长没有影响,并命名为KAI1。目前研究发现,KAI1 蛋白表达的下调或缺失与多种人体肿瘤的病程进展密切相关:肿瘤病程越晚,其表达就越低[2]。近年来,甲状腺癌发病率有上升趋势,其中甲状腺乳头状癌(papillary thyroid cancer,PTC)占绝大多数,而针对KAI1 在甲状腺癌中的研究资料甚少。本研究通过检测PTC、甲状腺腺瘤和正常甲状腺组织中KAI1 的表达,探讨KAI1 与甲状腺乳头状癌发生发展的关系。
1 材料与方法
1.1 标本来源 收集2006 -01—2008 -12 间我院手术切除的PTC58例、甲状腺腺瘤30例和瘤旁正常甲状腺组20例作为实验标本,并把PTC 分为淋巴结转移组22例和无淋巴结转移组36例。伴淋巴结转移的PTC 病例中:男10例,女12例;年龄23~92 岁,平均48.1 岁。无淋巴结转移的PTC 病例中:男19例,女17例;年龄21~78 岁,平均46.9 岁。每例病例均经病理复查证实,所有病例术前均未曾给予放疗和(或)化疗。
1.2 试剂 试验所用试剂均购自武汉博士德生物工程有限公司,包括兔抗人KAI1 多克隆抗体、SABC 免疫组化试剂盒和DAB显色试剂盒。
1.3 实验方法及步骤 对所有实验石蜡包埋标本均进行连续4 μm厚切片,每例至少4 张。
1.3.1 对试验切片进行常规HE 染色。
1.3.2 KAI1 免疫组化染色(SABC 法) 采用前列腺组织为阳性对照,而以PBS 代替一抗作为阴性对照。试验切片经常规脱蜡至水,并进行微波抗原修复,具体操作步骤按试剂盒说明书进行,之后经DAB 显色,苏木素复染,脱水及透明,最后中性树胶封片。
1.4 结果判断 判定标准:KAI1 蛋白阳性染色呈棕褐色细小颗粒状着色,定位于细胞胞浆和细胞膜。染色强度评分标准:无着色记为0 分,淡黄色记为1 分,棕黄色记为2 分,棕褐色记为3分。阳性细胞比例评分标准:<5%记为0 分,5%~25%记为1分,26%~50%记为2 分,51%~75%记为3 分,>75%记为4分。根据染色强度评分与阳性细胞比例评分之和所得分数进行染色阳性分级:≥3 分为阳性,≤2 分为阴性。定量标准均以高倍镜下针对每张切片随即选取5个不同视野(×200),同时应用CCD 成像并结合图像分析系统对kai1 蛋白的表达进行平均灰度值测定,平均灰度值越小(说明染色强度越强及透光度越弱),蛋白表达量越高,反之则说明其表达量越低。
1.5 统计学方法 所有数据均录入SPSS 13.0 统计软件包,计量资料以±s 表示,并对结果进行方差分析和t 检验,以P <0.05为差异具有统计学意义。
2 结果
KAI1 蛋白阳性表现为位于细胞浆和细胞膜的棕黄色颗粒。KAI1 在PTC 中的表达呈阳性或强阳性(如图1),在甲状腺腺瘤中呈阳性或弱阳性,在正常甲状腺组织中呈弱阳性或阴性(如图2)。KAI1 蛋白在PTC 中的表达显著高于甲状腺腺瘤和正常甲状腺组织,差异均有统计学意义(P <0.01)。而KAI1 蛋白在甲状腺腺瘤中的表达虽然高于正常甲状腺组织,但差异无统计学意义(P >0.05),见表1。另外,KAI1 蛋白的表达在伴淋巴结转移的PTC 中显著低于无淋巴结转移的PTC,差异有统计学意义(P <0.01),见表2。
表1 KAI1 在各组中的表达(±s)

表1 KAI1 在各组中的表达(±s)
注:* P <0.01 VS PTC 组,■P <0.01 VS PTC 组,▼P >0.05 VS 甲状腺腺瘤组
分组例数 KAI1 表达(灰度值)PTC 58 63.31 ±6.52甲状腺腺瘤 30 117.53 ±7.67*正常甲状腺 20 123.71 ±8.49■▼
表2 KAI1 在不同PTC 中的表达(±s)

表2 KAI1 在不同PTC 中的表达(±s)
注:▲P <0.01 VS 无转移的PTC 组
分组例数 KAI1 表达(灰度值)无转移的PTC 22 47.68 ±7.49转移的PTC 36 83.23 ±8.27▲
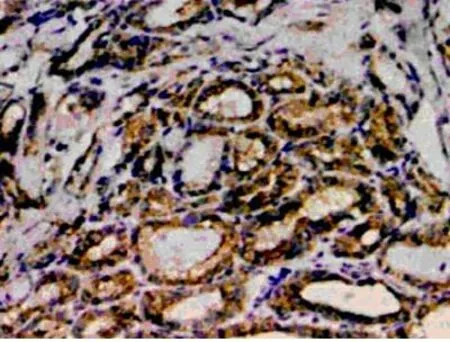
图1 KAI1 在甲状腺乳头状癌阳性表达
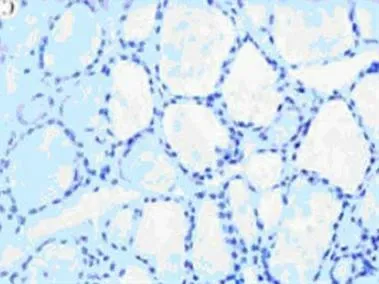
图2 KAI1 在正常甲状腺组织阴性表达
3 讨论
近年来,我国甲状腺癌的发病率呈现逐年上升的趋势,而其中80%为PTC[3]。作为最常见的内分泌系统恶性肿瘤之一的PTC,不但起病隐匿,而且临床表现及其生物学特征复杂多变,同时存在较高的隐性颈部淋巴结转移率[4]。目前有关其发病及转移机制尚未清楚。随着分子生物克隆技术的逐渐发展,肿瘤转移抑制基因是近年来发现的一类与肿瘤转移相关的基因。它对肿瘤浸润及转移起负向调控的作用越来越受到人们的重视。研究表明[5],肿瘤转移抑制基因在非转移肿瘤组织中表达较高,而在有淋巴结转移的肿瘤组织中表达较低,由此,认为它与抑制肿瘤的浸润和转移密切关。
KAI1 是1995年首先由Dong 等[1]从人前列腺癌杂交细胞AT6.1 中所克隆出的转移抑制基因,是穿膜四超家族(transmembrane 4 super-family,TM4SF)成员之一,其生物学结构为细胞膜糖蛋白,主要影响细胞间及细胞与细胞外基质间的信号传导,同时参与细胞增生的调节。早期的研究认为KAI1 基因只是前列腺癌的特异性的转移抑制基因,在目前已知的与肿瘤转移相关的基因中,KAI1 基因是较为明确的抑癌基因。在人类其他肿瘤中如肺癌[6]、乳腺癌[7]、胃癌[8]、肝癌[9]、胰腺癌[10]、卵巢癌[11]、子宫内膜癌[12]等多种恶性肿瘤的体内或体外实验大都表明,其表达缺失或下降与分化程度、临床进程以及淋巴结转移密切相关。肿瘤分化程度越低,临床进程越晚,KAI1 蛋白的表达就越少。本研究显示,KAI1 蛋白在PTC 中的表达,显著高于甲状腺腺瘤及正常甲状腺组织(P 均<0.01),这也可能与甲状腺乳头状癌具有恶性程度较低和预后较好的生物学行为有关。
PTC 中颈部淋巴结转移较常见,本研究结果表明,KAI1 蛋白在无淋巴结转移的PTC 组织中阳性或弱阳性表达,而在淋巴结转移的PTC 组织中呈弱阳性或阴性表达。KAI1 蛋白的表达在伴淋巴结转移的PTC 中显著低于无淋巴结转移的PTC(P <0.01),这也更加明确了KAI1 是一个肿瘤转移抑制基因,它与肿瘤的淋巴结转移有一定关系。既往已有的证据也表明,KAI1 基因表达降低在肿瘤进展转移过程中起着重要作用,它可通过调节肿瘤细胞的运动、增殖、分化和信号转导等发挥作用,进而抑制肿瘤细胞的转移能力[13-16]。因此,KAI1 促进PTC 转移的机制可能是KAI1 的低表达使肿瘤组织细胞功能进一步减弱或丧失,导致肿瘤细胞间黏附力减弱、而移动性增强、同时细胞分化降低,进而增强其侵袭性,最终发生淋巴结转移。PTC 在颈部淋巴结转移过程中KAI1 低表达所起的作用及作用的大小,以及发生这种淋巴结规律性转移的具体机制目前仍不明确,需进一步研究证实。
综上所述,本实验结果显示KAI1 的表达异常可能与PTC 的发生、发展以及淋巴结转移密切相关,临床上通过检测PTC 中KAI1 的表达,对判断肿瘤的恶性程度、转移潜能以及预后均具有重要的指导意义。
[1]Dong JT,Lamb PW,Rinker-Schaefer CW,et al.Kall a metastasis suppressor gene for prostate cancer on human chromosome 11P11.2[J].Science,1995,268(5):884 -886.
[2]Cristian M Sloug,Gregory W Randolph. Workup of well differentiated thyroid carcinoma [J]. Cancer Control,2006,13(2):99 -105.
[3]孙咏梅,刘韶平,马赫,等. 骨桥蛋白在乳头状甲状腺癌中的表达及意义[J].中国现代普通外科进展,2009,12(1):24 -28.
[4]李春生.甲状腺乳头状癌组织E -cadherin 蛋白表达及其与颈部淋巴结转移相关性研究[J]. 中华肿瘤防治杂志,2011,18(2):102 -104.
[5]Liu WM,Zhang XA.KAI1/CD82,a tumor metastasis suppressor[J].Cancer Lett,2006,240(2):183 -194.
[6]Jee BK,Park KM,Surendran S,et al. Kal1/CD82 suppresses tumor invasion by MMP9 Inactivation via TIMPI up -regulation in the H1299 human lung carcinoma cell line[J]. Biochem Biophys Res Commun,2006,342(2):655 -661.
[7]Malik FA,Sanders AJ,Jones AD,et al. Transcriptional and translational modulation of KAI1 expression in ductal carcinoma of the breast and the prognostic significance[J].Int J Mol Med,2009,23(2):273 -278.
[8]Zheng HC,Wang MC,Li JY,el a1.Expression of maspin and kail and their clinicopathological significance in carcinogenesis and progression of gastric cancer[J].Chin Med Sci J,2004.J9(3):193 -198.
[9]Si SH,Yang JM,Peng ZH. el a1. Effects of KAI1 gene Oil growth and invansion of human hepatocellular carcinoma MHCC97 - H cells[J]. World J Gastroenterol,2004,10(14):2019 -2023.
[10]Xin Shi,Helmut Friess,Fumiaki Ozawa,et al. Pancreatic cancer:factors regulating tumor development,maintenance and metastasis[J]. Pancreatology,2001,1 (5):517 -524.
[11]K Shigemasa,N Nagai,K Ohama,et al. Clinical implications of mRNA expression of KAI1 in ovarian cancer with or without metastasis[J]. International Journal of Clinical Oncology,1999,4(6):343 -347.
[12]Liu FS,Jin TD,Jung TC,et al.Kall/CD82 metastasis suppressor protein is down-regulated during the progression of human endomertrial cancer[J].Clinical Cancer Res.2003,(9):1393-1398.
[13]Lazo PA. Functional implications of tetraspanin proteins in cancer biology[J].Cancer Sci,2007,98(11):1 666 -1 677.
[14]Malik FA,Sanders AJ,Jiang WG.KAI-1/CD82,the molecule and clinical implication in cancer and cancer metastasis[J].Histol Histopathol,2009,24(4):519 -530.
[15]Miranti CK. Controlling cell surface dynamics and signaling:how CD82/KAI1 suppresses metastasis[J]. Cell Signal,2009,21(2):196 -211.
[16]Yánez - Mó M,Barreiro O,Gordon - Alonso M,et al. Tetraspanin - enriched microdomains:a functional unit in cell plasma membranes[J].Trends Cell Biol,2009,19(9):434 -446.

