反应-蒸馏合成双丙酮醇工艺研究
田红丽,刘荣杰,李 平
(银川能源学院 石油化工学院,宁夏 银川 750105)
0 引言
双丙酮醇又名二丙酮醇,化学名称为4-甲基-4-羟基-2-戊酮,分子为:CH3COCH2C(CH3)2OH.它是一种精细化工产品,沸点为164 ℃,熔点为-54 ℃,比重为0.938 5,电阻率小,导电性好.其纯品为无色透明的易燃液体,具有薄荷香味[1].
双丙酮醇具有一系列特殊性能,在化工各行业得到广泛应用,如被用作光亮剂、洗涤剂、抗冻剂、清洗剂、着色剂、防腐剂等[2].
目前,国内对双丙酮醇需求量很大,但由于生产能力有限,该产品大多依靠进口,因此寻求双丙酮醇的制备工艺就显得尤为重要.双丙酮醇是由丙酮在催化剂的作用下缩合而得[3],由于该反应为可逆反应,所以双丙酮醇的产率受到了极大的限制.目前,针对合成双丙酮醇的研究侧重两个方面:一是开发研制新型有效的催化剂和相应的助催化剂;二是探寻新的合成工艺.虽然国内外的研究者已研究出多种合成双丙酮醇催化剂,主要有Ba(OH)2、NaOH、KOH、具有固体碱性质的硬白土、离子交换树脂.但该方法存在:催化剂不能回收、反应速度慢、污染大和转化率很低等缺点[4].为了突破可逆反应的限制, 本研究以丙酮为原料,选用大孔阴离子交换树脂为催化剂[5],采用反应-蒸馏技术进行双丙酮醇的循环工艺合成研究,进行了工艺条件的优化,并获得了比较满意的实验结果[6-8].
1 实验部分
1.1 反应机理
双丙酮醇是以丙酮为原料,经Aldol condension 反应(醇醛缩合反应)制得的.
2CH3COCH3CH3COCH2C(CH3)2OH
此反应可被酸催化,但大多数采用碱性催化剂.其反应机理如下:首先,催化剂吸引羰基的α-氢使得丙酮生成阴离子的烯醇.反应式如下:

第二步是阴离子烯醇与另一个丙酮分子发生羰基反应,同时质子又与催化剂分裂生成β-羰酮,即双丙酮醇.反应式如下:

该反应为放热反应,降低温度双丙酮醇的收率升高,温度越低,越有利向生成双丙酮醇方向进行.
1.2 实验装置与原料
1.2.1 实验装置
实验装置见图1[9-10].

图1 实验流程示意图Fig.1 The experimental process diagram
1.2.2 实验原料
丙酮,分析纯,西安试剂厂;大孔型阴离子交换树脂,上海树脂有限公司.
1.3 合成方法与步骤
本实验以丙酮为原料,采用催化缩合反应-蒸馏的方法[11-13].将原料丙酮由塔顶加入,经催化剂床层于一定温度下进行反应,生成的双丙酮醇流入塔釜,并从塔釜流出.未反应的丙酮则不断由塔釜上升至塔身,从而使反应区的丙酮浓度增加而双丙酮醇的浓度减小.这样在不断加料、不断出料的连续操作状态下,系统将达到一个稳定状态.产物不断从反应体系中移走,反应物留下继续反应,使反应原料持续不断地向生成双丙酮醇的方向进行,从而使得丙酮的转化率和双丙酮醇的产率大大提高.
反应缩合所得到的产物中主要成分为丙酮和双丙酮醇,本实验采用GC-800气相色谱测定双丙酮醇的含量.
2 结果与分析
采用反应精馏合成双丙酮醇,主要的影响因素有进料流量、反应时间、反应温度,对这些因素进行了单因素实验和正交试验,以确定该反应的最佳工艺条件.
2.1 单因素实验
2.1.1 物料流量的影响
实验条件:调整进料流量,固定反应时间为2 h,反应温度为25 ℃,所得实验结果见表1.

表1 原料流量对反应的影响
由表1可以看出,随着丙酮量的增加,双丙酮醇的收率先增加后减少,但减少的幅度不大,所以流量在1.58 mL/min时,双丙酮醇的收率较高.
2.1.2 温度的影响
实验条件:固定物料流量为1.58 mL/min,反应时间2 h,调整不同反应温度,实验结果见表2.

表2 温度对反应的影响
由表2可以看出,并不是反应温度越高越好,由于反应温度的升高促使反应向着副反应的方向进行而导致生成的副产物增多,而双丙酮醇的收率也随着温度的升高先增加再减小.所以最适宜温度是25 ℃.
2.1.3 反应时间的影响
实验条件:固定物料流量为1.58 mL/min,反应温度25 ℃,调整不同的反应时间,实验结果见表3.
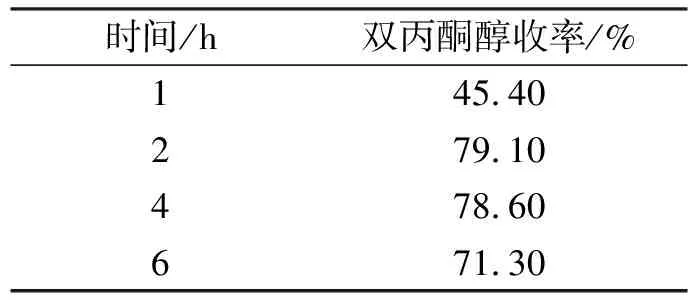
表3 反应时间对反应的影响
由表3可以看出,并不是反应时间越长越好,随着反应时间的加长,双丙酮醇收率随时间的增长先增加后减少,所以适宜反应时间为2 h.
2.2 正交试验
大孔型阴离子交换树脂对反应温度的选择比较苛刻.反应器的床层高度不变,丙酮在反应器内的停留时间取决于进料流量的大小.另外,我们考虑到本实验为循环工艺研究.因此,以反应温度(A)、循环时间(B)、进料量(C)为3种因素,各因素分别选择3个水平.假定不考虑因素间的交互作用,则选择L9(34)正交表,正交试验设计见表4.

表4 正交试验因素水平表
利用3因素不同水平对双丙酮醇收率的实验结果、影响的直观分析见表5.

表5 正交试验结果表Tab.5 The orthogonal experiment result table
从极差R值可见,RC>RB >RA.因此,本实验中各因素作用的主次顺序为:C>B>A,即进料流量>循环时间>反应温度.
将以上实验收率结果作数据处理,方差分析结果见表6.

表6 方差分析表(信度a=0.05)
方差分析表明:均方(C)>均方(B)>均方(A).因素C为主要因素.由以上直观分析和方差分析得出A2B1C1(25 ℃,2 h,1.58 mL/min)为最佳工艺条件.为了考察正交试验结果,本实验在最佳工艺条件下进行3次平行实验,以验证以上分析的准确性,实验结果见表7.
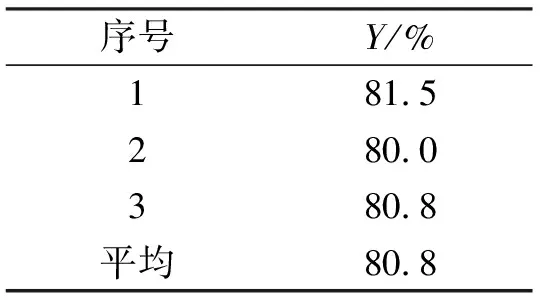
表7 重现性实验
3 结论
本实验以大孔型阴离子交换树脂为催化剂进行丙酮的缩合反应,最佳工艺条件为:反应温度25 ℃,反应时间2 h,进料流1.58 mL/min,双丙酮醇的收率可达80%.

