竹叶黄酮类物质的抗氧化性能研究
陈 宇,董映雪,郑 璐,卢智城
(莆田学院 环境与生物工程学院,福建 莆田 351100)
近年来,人们对人工合成的抗氧化剂越来越不信任而转向对具备高效、无毒、安全等特点的天然抗氧化剂的开发和研究上.竹子,在中国是最主要的植物之一,有着漫长的药、食两用的历史,在开发中医药和保健品方面有很高的价值.竹子资源丰富,但我国现今对其开发利用的情况较差[1].竹叶含有大量的黄酮类化合物,另外还含有生物多糖、氨基酸、活性肽等微量元素[2-3].有研究表明竹叶提取物具有显著的抗氧化、抗疲劳、降血脂等作用[4-7].所以在未来的市场发展中,竹叶黄酮类物质的应用将占据极大的市场优势,极大的市场开发潜力.本文以莆田学院校园内的竹子叶片为材料,测定竹叶黄酮的抗氧化性能,为竹子的综合开发利用提供参考.
1 材料与方法
1.1 供试材料
将“佛肚竹”的竹叶(采自莆田学院芳名湖畔)清洗干净,于50.0℃的烘箱中烘干.置于绞碎机中绞碎后,经80目筛子过筛,称取5.0000g的竹叶粉末,滤纸包好.在料液比为1:20(60%的乙醇溶液),温度为60.0℃的水浴条件下加热4h,得到竹叶的浸取液.60℃旋转蒸发对竹叶浸取液进行浓缩,接着用石油醚对浓缩液进行萃取以除去叶绿素,将除去叶绿素的浓缩液定容成50mL,过滤,留待备用[8].
用乙醇溶液(同上提取竹叶提取液所用的溶剂)配制0.200mg·mL-1的芦丁溶液.称取5.0000g的NaNO2于100mL的容量瓶中用蒸馏水定容,配成5%的NaNO2溶液.称取8.8000g的Al(NO3)3于100mL的容量瓶中用蒸馏水定容,配成5%的Al(NO3)3溶液.称取10.0000g的NaOH于100mL的容量瓶中用蒸馏水定容,配成10%的NaOH溶液,备用.
根据陈宇等[9]前期实验基础得到竹叶提取液的黄酮类物质的总浓度C=0.0224g·L-1.称取0.2240g的抗坏血酸和BHT,以60%的乙醇溶液为溶剂将其定容到100mL的容量瓶中,配成浓度C=2.24g·L-1的溶液,使用时稀释100倍.
1.2 主要试剂与仪器
1.2.1试剂
邻苯三酚、盐酸、1,10-菲啰啉、三羟甲基胺基甲烷(Tris)、过氧化氢、氢氧化钠、硫酸亚铁、硝酸铝、2,6二叔丁基对甲酚、抗坏血酸、亚硝酸钠、石油醚、无水乙醇等均为分析纯.DPPH为生物试剂,芦丁标准品(99%,郑州荔诺生物科技有限公司).
1.2.2 主要仪器
BS224S电子天平(赛多利斯科学仪器(北京)有限公司);722型分光光度计(上海光谱仪器有限公司制造);RE52CS-2旋转蒸发仪(上海亚荣生化仪器厂);SHB-III循环水式多用真空泵(郑州长城科工贸有限公司);DGH-9246电热鼓风干燥箱(上海精宏实验设备有限公司);恒温水浴锅(国华电器有限公司);PHS-25酸度计(上海伟业仪器厂).
1.3 测定项目与方法
1.3.1 对有机自由基(DPPH)的清除能力的实验
用无水乙醇配制浓度为 0.26mmol·L-1的DPPH溶液,在冰箱中避光保存.实验时稀释至6.5×10-5mol·L-1的 DPPH溶液[10].
分别取 6.5×10-5mol·L-1的 DPPH乙醇溶液5mL+乙醇1mL、5mL的DPPH溶液+竹叶黄酮提取 液(100μL、200μL、400μL、600μL、800μL)、5mL乙醇+100μL竹叶黄酮提取液于试管中,定容混合均匀后室温避光反应10min后于517nm处测其吸光度,分别记为 A0、Ai、Aj.用抗坏血酸和 2,6-二叔丁基-4-甲基苯酚(BHT)作比较.所有测定平行进行三次.
所得的吸光度代入下式计算提取液对有机自由基(DPPH)的清除率.
清除率=1-(Ai-Aj)/A0
1.3.2 对羟基自由基清除能力的实验
本实验采用Fenton反应分光光度比色法来测定.参照罗宇倩的方法略有改动[11].
配制1.5mmol·L-1的邻二氮菲溶液、磷酸盐缓冲溶液 PBS(pH=7.24)、1.5mmol·L-1的硫酸亚铁溶液、0.02%的过氧化氢溶液,备用.
取5只比色管,分别标记为损1、未损1、空参1、样1、样参1.分别在损1、未损1和样1中加入1 mL的邻二氮菲和1mL的硫酸亚铁溶液;接着在各个试管中加入2mL的PBS;在样1和样参1中分别加入200μL的竹叶提取液;最后分别量取1mL的过氧化氢加到损1和样1中,蒸馏水定容.摇匀,静置一段时间后,在536nm处测其吸光度.分别记为 A样、A损、A未损.
同理分别测定当竹叶提取液加入的量不同(0.2mL、0.5mL、1mL、2mL)时的吸光度.
所得的吸光度代入下式计算提取液对羟基自由基的清除率.
清除率=(A样-A损)/(A未损-A损)
1.3.3 对超氧阴离子自由基清除能力的实验
根据李鹏婧等[12]的方法略做改动.配制Tris-HCl溶 液 (50mmol·L-1,pH分 别 为 7.24、8.15、9.19),Tris溶液(50mmol·L-1,pH为 10.23),3mmol·L-1的邻苯三酚溶液,备用.
取四支试管,分别标记为空7.24、空参7.24、样7.24、样参7.24.先在四支试管中加入pH=7.24的Tris-HCl溶液各5mL;在空7.24试管中加入1.5mL的蒸馏水,空参7.24试管中加入2mL,样7.24试管中加入1.3mL的蒸馏水,空参7.24试管中加入1.8mL的蒸馏水;接着在样7.24和样参7.24试管中分别加入0.2mL的竹叶提取液,摇匀,静置一段时间.然后在空7.24和样7.24分别迅速加入0.5mL的邻苯三酚,计时,摇匀,每30s测定吸光度.分别记为A空、A样.
不同pH值的Tris-HCl溶液(pH分别为7.24、8.15、9.19、),Tris溶液(pH为 10.23)步骤同上,测定吸光度.
确定最佳的pH值的Tris-HCl溶液,配制溶液并同理分别测定当竹叶提取液加入的量不同(0.00mL、0.03mL、0.05mL、0.10mL、0.15mL、0.20mL)时的吸光度.
所得的吸光度代入下式计算提取液对超氧阴离子自由基的清除率.
清除率=(A空-A样)/A空
2 结果与分析
2.1 竹叶黄酮类物质对DPPH自由基的清除能力
2.1.1 不同抗氧化剂对DPPH自由基的清除效果的影响
由图1可以看出随着抗氧化剂加入量的增加,溶液的吸光度总体的趋势都是降低的.其中竹叶提取液即竹叶黄酮类化合物对DPPH自由基的清除作用是最明显的.从图1还可以看出的是竹叶黄酮类化合物的加入量在0.2mL的时候就已经有显著的清除效果,随着竹叶黄酮类化合物的加入量的增多,溶液的吸光度A趋向于0.3;并且加抗坏血酸的溶液的吸光度是随着其加入量的增加而减少,即其清除作用是随着抗坏血酸的加入量的增加而加强;而BHT的抗氧化性总体上是随着BHT的加入量的增多而加强.比较图1的三条曲线可以看出竹叶黄酮类物质对DPPH自由基的清除效果明显会比抗坏血酸的好,抗坏血酸对DPPH自由基的清除效果又会比BHT的清除效果来的好,即少量的竹叶黄酮类化合物便能对DPPH自由基的清除作用达到很好的效果,而抗坏血酸和BHT对DPPH自由基的清除作用相对没有竹叶黄酮类物质的好.并且抗坏血酸对DPPH自由基的清除作用是随着加入量的增加而增大并且逐渐趋向于0.6;竹叶黄酮类物质对DPPH自由基的清除作用则是在竹叶提取液加入量为0.2mL的时候便达到了74.73%,之后随着其加入量的增加清除率缓慢上升,即竹叶黄酮类物质的抗氧化效果会优于抗坏血酸和BHT.
2.1.2 不同反应时间竹叶提取液对DPPH自由基的清除效果的影响
由图2可以看出竹叶提取液对DPPH自由基有很好的清除能力.当竹叶的提取液加到0.2mL的时候竹叶黄酮类物质对DPPH自由基的清除率达到了73.53%.由此可以看出竹叶黄酮类物质对DPPH自由基的清除作用,只需要加入少量的提取液便可达到很好的抗氧化作用.随着竹叶提取液的加入量的增加,其对DPPH自由基的清除作用增加,并逐渐趋向于1.
比较图2和图3同样可以看出随着竹叶提取液即竹叶黄酮类化合物的用量的增加,其对DPPH自由基的清除作用增加,并且放置15min后测定的清除率都稍高于即时测定的.
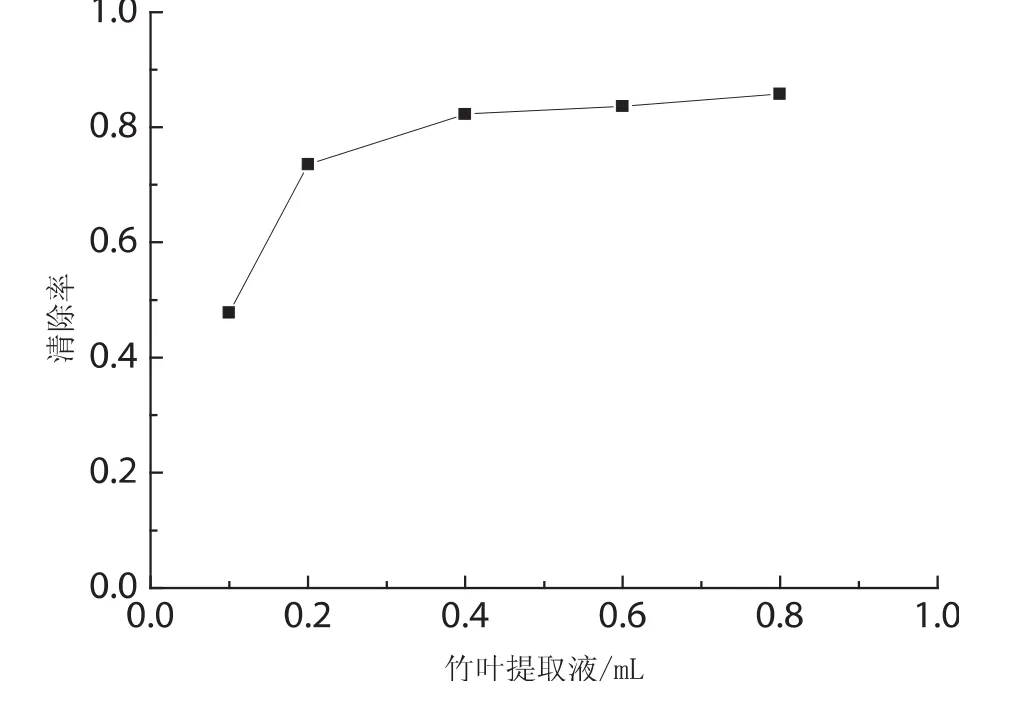
图2 竹叶提取液用量对DPPH自由基的清除率(t=0min)
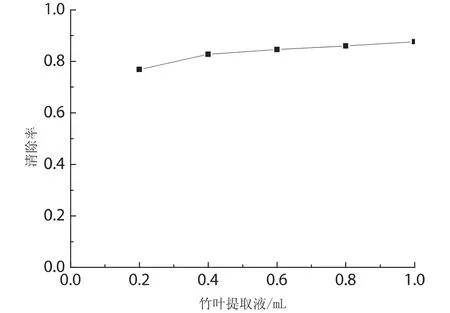
图3 竹叶提取液用量对DPPH自由基的清除率(t=15min)
2.2 竹叶黄酮类物质对羟基自由基的清除能力
由图4可以看出随着提取液加入量的增加其对羟基自由基的清除效果逐渐提升.由此可以证明竹叶黄酮类物质具有良好的抗氧化性能.
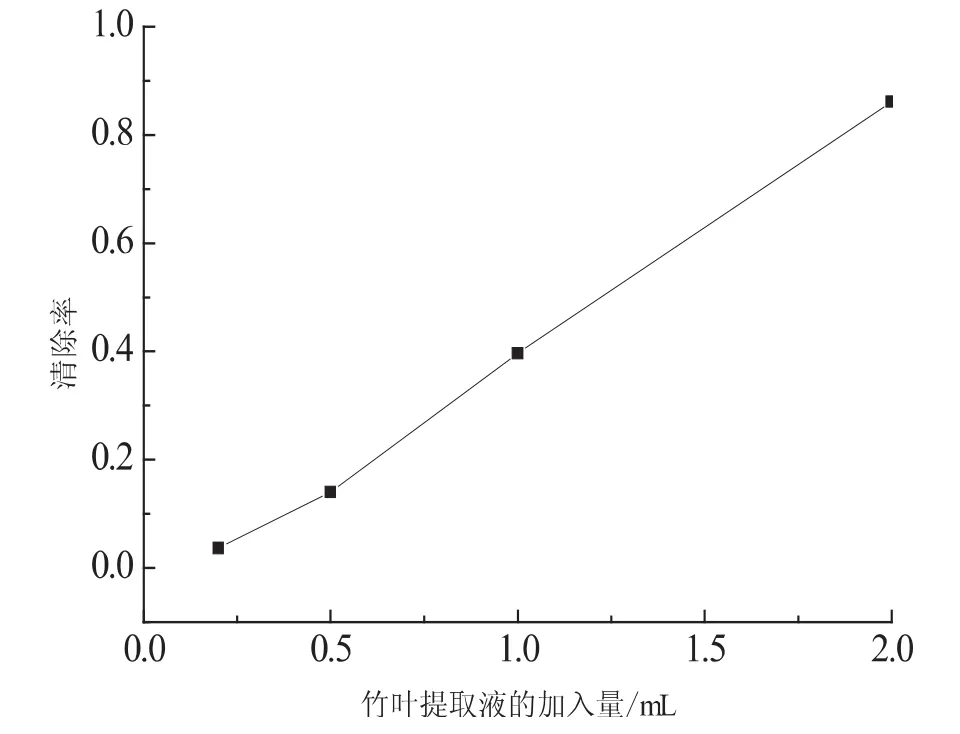
图4 竹叶提取液的用量对羟基自由基的清除率
2.3 竹叶黄酮类物质对超氧阴离子自由基的清除能力
2.3.1 pH对黄酮类物质清除超氧阴离子自由基的影响
由图5-1可以看出加提取液的溶液的吸光度与未加提取液的溶液的吸光度都随着反应时间的增长,溶液的吸光度有微弱的上升.这表明溶液在中性的条件下只能使邻苯三酚发生微弱的自氧化反应产生有色的中间产物,使溶液的吸光度有微弱的上升.加提取液的溶液的吸光度会稍小于未加提取液,其部分原因是颜色中和的结果.
由图5-2可以看出加提取液的溶液的吸光度的上升幅度比未加提取液的溶液的吸光度的上升的幅度小,但都有明显的上升趋势.这说明Tris-HCl的pH=8.15的时候,邻苯三酚发生自氧化反应,产生有色的中间产物使溶液的吸光度上升,加竹叶黄酮类物质后,抗氧化剂和超氧阴离子很快的进行反应,使吸光度减少.所以加提取液的溶液的吸光度会比未加提取液的溶液的吸光度低,加提取液的溶液的吸光度的上升趋势会比未加提取液溶液的小.
由图5-3可以看出在Tris-HCl的pH=9.19的时候,未加提取液的溶液的吸光度随反应时间的增长而增大,且在200s的时候趋于0.4,而加提取液的溶液的吸光度的上升幅度较小,且在90s的时候溶液的吸光度已经接近0.15,清除速度过快,不适于实验观察.
由图5-4可以看出未加提取的溶液的吸光度随反应时间的增长增大,且趋向于0.35,而未加提取液的溶液则是随反应时间的增长其吸光度缓缓没有大的变化,其在60s的时候已接近对超氧阴离子的清除完全.这表明在Tris的pH=10.23的溶液也不适于实验观察.
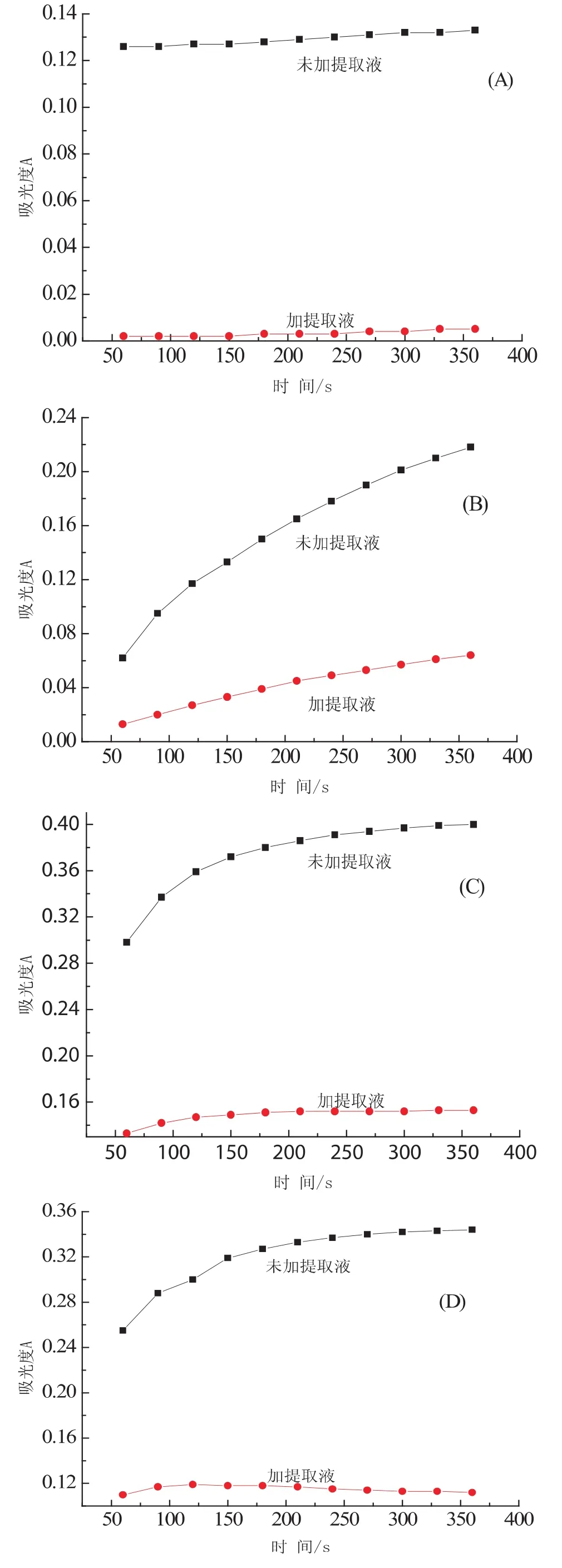
图5 不同pH值的竹叶提取液对超氧阴离子的清除率(A:pH=7.24;B:pH=8.15;C:pH=9.19;D:pH=10.23)
总之,由图5可以得到在Tris-HCl的pH=8.15左右的时候是最适于实验研究的.即与文献查到的在Tris-HCl溶液的pH=8.20中进行实验研究是相符的[10,11,12].
2.3.2 黄酮类物质用量对清除超氧阴离子自由基的影响
由图6可以看出随着竹叶提取液的加入量的增加,竹叶黄酮类物质对超氧阴离子的清除率是随之增大的,其清除率从开始的快速上升到逐渐趋向于1.
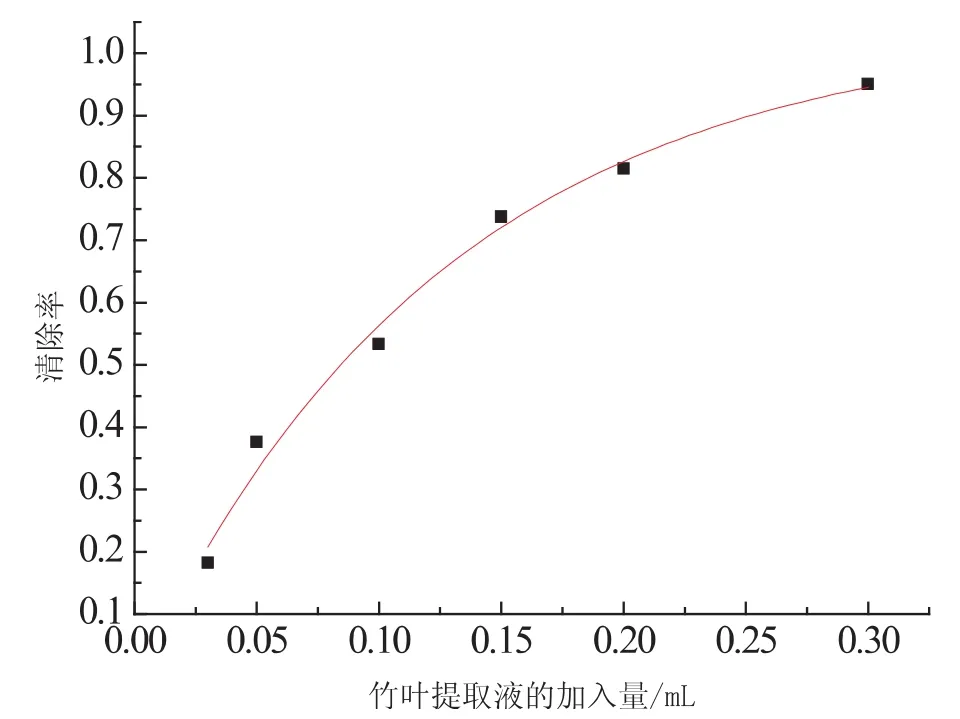
图6 竹叶提取液的用量对超氧阴离子的清除率(t=420s)
3 讨论
本文研究竹叶黄酮类物质的抗氧化性能是通过对DPPH自由基、羟基自由基、超氧阴离子自由基的清除作用来验证的.
李安林等[13]研究结果表明对DPPH自由基的清除作用是随着黄酮的用量成正比.王乃馨等[14]研究结果表明野马追类黄酮的浓度与其对DPPH自由基清除活性间存在量效关系,并且野马追类黄酮对DPPH自由基的清除效果大体的趋势是:前5min较快,之后变缓,30-50min达平缓.王毅红等[15]研究对比车前草黄酮类化合物与相同浓度下的VC和VE清除DPPH自由基的效果,结果表明黄酮类物质的抗氧化性能会显著高于相同浓度下的VC和VE.与本文研究结果是相一致的,即相同浓度下,竹叶黄酮类物质的清除效果会优于抗坏血酸和BHT;并且随着提取液的浓度的增加其清除效果逐渐提升.
蔡为荣[16]的研究结果表明对羟基自由基的清除率与荷叶黄酮的用量存在量效关系.陆海峰等[17]的研究表明蒲公英的黄酮提取液对羟基自由基具有清除作用,其清除能力是随着提取液的浓度的增加而增大的.
李利华[18]的研究结果表明在试验的范围内,黄酮类化合物对羟基自由基、超氧阴离子自由基的清除作用与其用量呈正相关.李颖畅等[19]的研究结果也表明清除作用与浓度间的关系,即随着黄酮的用量的增加,黄酮对羟基自由基、超氧阴离子自由基的清除作用就越强.
潘娜[10]研究发现浓度为100mg·mL-1的竹叶黄酮对超氧阴离子的清除率为24%,当浓度为l000 mg·mL-1时对超氧阴离子的清除率为94%;竹叶黄酮对羟基自由基的清除率为30.7%,对应的浓度是5μg·mL-1,当竹叶黄酮对羟基自由基的清除率为84.5%,对应的竹叶黄酮的浓度是25μg·mL-1;对DPPH自由基的清除作用也是同样的,即随着浓度的增大,清除作用就越好.李鹏婧等[14]研究结果同样验证了黄酮用量与清除率之间的关系,即黄酮的浓度越大,抗氧化效果就越好.本实验得出的结论是随着竹叶提取液即竹叶黄酮类物质的加入量的增加,竹叶黄酮类物质对三者的清除作用是逐渐增强的,与文献的结果是相符的.
4 结论
竹叶黄酮类物质对DPPH自由基的清除效果随竹叶提取液的加入量的增加而增大,且实验具有良好的重现性.随着反应时间的增加,竹叶黄酮类物质对DPPH自由基的清除效果就越佳.竹叶黄酮类物质对DPPH自由基的清除效果显著,其次是抗坏血酸对DPPH自由基的清除效果,再次是BHT,由此说明竹叶黄酮类物质的抗氧化性能优于抗坏血酸和BHT.
竹叶黄酮类物质对羟基自由基的清除效果与竹叶提取液的加入量呈量效关系.由此也验证了竹叶黄酮类物质的抗氧化性能.
竹叶黄酮类物质在Tris-HCl的pH=8.15的时候对超氧阴离子自由基有明显的清除效果,与文献一致.竹叶黄酮对超氧阴离子的清除作用随反应时间的增加其吸光度的变化逐渐减少,并且随着竹叶提取液的加入量的增加,其对超氧阴离子的抑制作用增强.
〔1〕竹类综合利用课题组.竹子研究汇刊[J].1991,10(1).
〔2〕唐莉莉,徐榕榕,丁霄霖.竹叶多糖对小鼠移植瘤的抑制作用 [J].无锡轻工大学学报,1998,17(3):62-65.
〔3〕张英.天然功能性添加剂-竹叶提取物[J].精细与专用化学品,2002(7):20-22.
〔4〕岳永德,操海群,汤锋.竹提取物的化学成分及其利用研究进展[J].安徽农业大学学报,2007,34(3):328-333.
〔5〕张英.竹叶黄酮的生理与药理活性[J].世界竹藤通讯,2004,2(2):1211.
〔6〕许宝泉,吴水英,宋秋华.竹叶黄酮的生理功能研究进展[J].江西林业科技,2006(1):37-39.
〔7〕张英,吴晓琴,俞卓裕.竹叶和银杏叶总黄酮含量及其抗自由基活性的比较研究[J].中国中药杂志,2002,27(4):254-257.
〔8〕陶文亮,吴钰娟.竹叶黄酮提取分析方法的研究及其新进展[J].贵州化工,2009,34(3):15-18.
〔9〕陈宇,邓金木,林丽丽,等.竹叶总黄酮提取工艺研究[J].莆田学院学报,2012,19(2):38-41.
〔10〕潘娜.竹叶黄酮的抗氧化性及对油炸薯条中丙烯酰胺抑制作用的研究 [D].北京林业大学,2010.
〔11〕罗宇倩,郭辉,胡林福,等.竹叶黄酮的抗氧化活性研究[J].食品科技,2011,36(7):201-203.
〔12〕李鹏婧,柳旭光,龙海荣,等.超声波辅助提取菱角壳总黄酮及抗氧化性研究 [J].食品科技,2011,36(1):167-171.
〔13〕李安林,熊双丽.接骨木茎总黄酮的提取及DPPH自由基清除活性[J].中国食品添加剂,2010(5):113-116.
〔14〕王乃馨,王卫东,郑义,等.野马追类黄酮清除DPPH自由基活性研究 [J].中国食品添加剂,2010(6):84-87.
〔15〕王毅红,方玉梅,谭萍,等.车前草黄酮类化合物清除DPPH自由基的作用[J].贵州农业科学,2010,38(8):50-52.
〔16〕蔡为荣.微波提取荷叶黄酮及其清除羟基自由基的研究[J].食品科学,2004,25(9):112-115.
〔17〕陆海峰,罗建华,蒙春越,等.蒲公英总黄酮提取及对羟自由基清除作用 [J].广州化工,2009,37(3):101-103.
〔18〕李利华.柑橘皮中总黄酮的含量测定及体外自由基清除作用研究 [J].西北药学杂志,2009,24(5):361-363.
〔19〕李颖畅,吴笳笛,孙建华,等.化学发光法测定蓝莓叶黄酮提取物对氧自由基的清除作用[J].中国调味品,2009,34(12):102-105.

