不同产地黄药子中黄独乙素的含量测定
沈雄荣,董建勇
(温州医科大学药学院药学系,温州 325035)
黄药子为薯蓣科植物黄独(Dioscorea bulbiferaL.)的块茎,随着其被广泛应用于临床而且在治疗某些顽疾过程中有独特的疗效,黄药子毒性引起国内学者广泛关注,有文献报道黄药子及其制剂相关的安全性[1-9]。黄药子的肝脏毒性成分目前尚不清楚,一般认为主要是薯蓣皂苷元和薯蓣毒皂苷元,但近几年研究[10-13]发现,其所含二萜内酯类成分是黄药子药理作用的主要有效成分和毒性成分,其中黄独乙素为主要物质。笔者在本实验中选取不同产地黄药子,采用高效液相色谱(HPLC)法测定黄药子中黄独乙素含量,以期为安全用药提供实验依据。
1 仪器与试药
1.1 仪器 美国Waters高效液相色谱系统(515泵,996DAD检测器,Empower2色谱系统);Kromasil-C18柱(4.6mm ×250mm,5 μm);日本 AND GH-202 电子分析天平(日本AND公司)。
1.2 试药 乙腈(色谱纯,Merck公司);甲醇(色谱纯,Merck公司);水(自制超纯水);醋酸(分析纯,上海强顺化学试剂有限公司)。黄独乙素对照品购于四川省维克奇生物科技有限公司,含量≥98%;黄药子:产地广西,购自浙江省湖州市狮象龙大药房;产地四川,购自浙江省湖州市宝芝林大药房;产地浙江,购自浙江省湖州市慕韩斋药业有限公司;产地河北,购自广州市大参林药店;产地江苏,购自南京市同仁堂药店。经浙江省湖州市药品检验所陈敏中药师鉴定为薯蓣科植物黄独(Dioscorea bulbiferaL.)的干燥根茎。
2 方法与结果
2.1 检测波长的确定 用DAD二极管阵列检测器分析黄独乙素对照品色谱峰和黄药子样品中所测成分相应色谱峰的紫外光谱,结果紫外光谱基本一致,均在210 nm处有最大吸收,故确定检测波长为210 nm。
2.2 色谱条件 流动相:乙腈∶水(0.1%醋酸)=34∶66,流速为 1.0mL·min-1,检测波长 210 nm,柱温35℃,在此色谱条件下,黄独乙素标准品的HPLC图见图1,供试品HPLC图见图2。
2.3 对照品溶液的制备 取黄独乙素对照品6.50 mg精密称定,置25mL量瓶,加甲醇溶解,稀释至刻度,得260 μg·mL-1对照品储备液,4℃冰箱放置。
2.4 供试品溶液的制备 取不同产地黄药子粉末各5.0 g精密称定,装入小布袋,缝合,用纱布包裹,一煎加水500mL,浸泡0.5 h,煎煮 1 h,二煎 300mL,煎煮0.5 h,合并水煎液放置至室温,定容250mL,取少许,经孔径0.45 μm微孔滤膜滤过,滤液作为供试品溶液。

1,2.溶剂;3.黄独乙素图1 黄独乙素标准品的HPLC图1,2.solvent;3.diosbulbin BFig.1 HPLC chromatogram of diosbulbin B standard

1.黄独乙素图2 黄药子供试品HPLC色谱图1.diosbulbin BFig.2 HPLC Chromatogram of dioscorea bulbifera L.sample
2.5 标准曲线的绘制 精密量取黄独乙素对照品储备液1.0,2.0,3.0,5.0mL 分别置 10mL 量瓶,分别加甲醇至刻度,摇匀,使浓度依次为26,52,78,130 μg·mL-1。分别取稀释液和储备液各 20 μL,进样,记录峰面积。以峰面积为纵坐标,以浓度为横坐标进行线性回归,得黄独乙素的标准曲线:Y=17 850X+5 378.2,r=0.999 9,线性范围:26.0 ~130.0 μg·mL-1。
2.6 精密度实验 分别精密吸取同一份对照品溶液(黄独乙素浓度为130 μg·mL-1),分别进样6次,每次20 μL,记录黄独乙素峰面积,计算RSD。结果RSD为0.84%,表明该方法精密度良好。
2.7 重复性实验 按“2.4”项制备产地为河北黄药子水煎液6份,每份进样3针,计算黄独乙素的含量,含量平均值为2.917 mg·g-1,结果 RSD 为1.73%,表明该方法重复性良好。
2.8 稳定性实验 分别取同一份水煎液(产地河北)供试品溶液,分别于 0,2,4,6,8,12,24 h 精密吸取40 μL注入高效液相色谱仪,记录峰面积,考察其稳定性。根据黄独乙素含量,计算RSD为0.26%,表明供试品溶液在24 h内稳定性良好。
2.9 加样回收率实验 采用加样回收法,取适量已知含量(2.938 mg·g-1)的产地河北的黄药子粉末6份精密称定,精密加入黄独乙素对照品适量,按“2.4”项方法制备水煎液6份,作为供试品溶液,测定和计算回收率。平均回收率100.0%,RSD为0.50%。结果见表1。
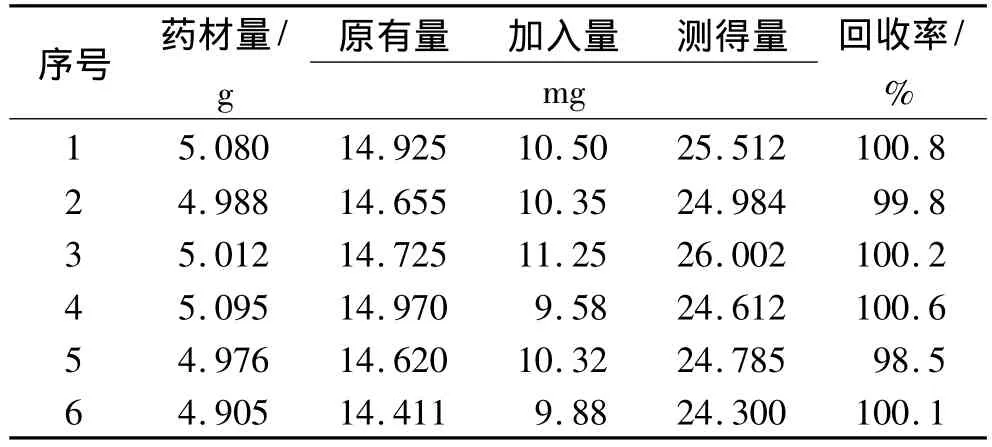
表1 黄独乙素加样回收率结果Tab.1 Recovery of Diosbulbin B n=6
2.10 样品含量测定 分别取5个不同产地烘至恒重的黄药子粉末5.000 g精密称定,按“2.4”项制备供试品溶液,精密吸取每个供试品溶液40 μL,进样3次,以3次测得的平均值计,用标准曲线法计算各供试品中黄独乙素的含量。结果见表2。
3 讨论
笔者在本实验采用二次水煎、合并水煎液直接定容的方法。该法简单方便,也和中药饮片水煎和含黄药子中成药冲水服用的方法一致,能更好地定量其中黄独乙素含量。笔者采用将黄药子粉末装入小药袋封口,再用纱布轻轻包裹后水煎,水煎液清澈,几乎无杂质,用纱布滤过一次不会有废渣堵住漏斗口,原液量几乎无浪费,不同批次间含量测定稳定,数据可靠。
笔者做预实验测定浙江产黄药子中黄独乙素含量时,刚开始选用的色谱条件为:乙腈∶水(0.1%醋酸)=40∶60,25℃,出峰时间约9min,经峰纯度检验不纯。后来流动相为乙腈∶水(0.1%醋酸)=34∶66,25℃,两物质能基线分离,但分离度不好,T1=13.718,T2=14.194。最后选定乙腈∶水(0.1%醋酸)=34∶66,35℃,出峰时间适当,分离度良好,峰1出峰时间与黄独乙素标准品出峰时间接近,为黄独乙素,后面的峰经光谱分析,和黄独乙素光谱图极其相似,笔者推测为黄独乙素的类似物。

表2 不同产地黄药子中黄独乙素含量Tab.2 Diosbulbin B content in Dioscorea bulbifera L.from different habitats
不同产地黄独乙素含量测定的结果(除浙江产地外)为2 ~3 mg·g-1,与文献[14-15]报道一致,但也有差异,黄独乙素平均含量:河北>广西>江苏>四川>浙江,这可能与黄药子产地、炮制方法、不同批次等有关。假设浙江产黄药子中黄独乙素类似物以黄独乙素含量来计算,两者加起来含量2~3 mg·g-1。有关黄独乙素类似物的临床药理和毒性鲜见报道,有待进一步关注和研究。
笔者选取不同产地黄药子,测定其中有效成分且同为毒性成分黄独乙素的含量,为黄药子临床量-效-毒关系研究以及效-毒的最优划界点提供一定帮助,为临床用药提供参考。
[1]蒋兆芬.黄药子引起药物性肝炎17例报告[J].中医杂志,1981,22(2):37.
[2]程芳.黄独致中毒性肝炎8例报告[J].江苏中医,1995,16(7):91.
[3]王志雄.黄药子致肝损害2例[J].浙江中西医结合杂志,2005,15(3):193-194.
[4]张利平,周慧萍.黄药子致死亡1例[J].医药导报,2009,28(8):1097.
[5]李维昌,杨军,李惠文,等.黄药子致药物性肝病1例[J].临床合理用药,2009,2(15):79.
[6]赵文艳.白蚀丸致药物性肝炎2例[J].齐齐哈尔医学院学报,2004,25(7):766.
[7]李琪.兆誉隆抑亢丸致黄疸性肝炎[J].药物不良反应杂志,2006,8(3):216,168.
[8]张俊忠.增生平片致肝损害[J].药物不良反应杂志,2007,9(3):215.
[9]蒋萌,熊宁宁 刘沈林,等.复方黄药子制剂临床实验不良反应及其处理[J].中国循证医学杂志,2004,4(4):255-257.
[10]苏钰文,江振州,王欣之,等.黄药子水提物的肝毒性及其毒性物质基础研究[C].南京:中国药学会,2012:1-12.
[11]蒋永福,张焜,赵肃清,等.黄药子肝脏毒性成分的筛选研究[J].中药材,2009,32(1):107-109.
[12]张海谋,袁金玉.黄药子的药理和毒理研究进展[J].医药导报,2009,28(4):490-492.
[13]MA M,JIANG Z Z,RUAN J L,et al.Toxicity of a Diterpene lactone isolated fromDioscoreabulbiferaon hepatocytes[J].Chin J Nat Med,2011,9(4):280-285.

