大剂量甲氨蝶呤治疗成人急性淋巴细胞白血病的药物代谢研究△
李园 王迎 林冬 周春林 刘兵城 魏辉 李巍 刘凯奇 魏述宁 宫本法 王津雨张广吉 刘云涛 赵邢力 弓晓媛 李艳 顾闰夏 秘营昌 王建祥
中国医学科学院血液病医院白血病中心,天津 300020
大剂量甲氨蝶呤治疗成人急性淋巴细胞白血病的药物代谢研究△
李园 王迎#林冬 周春林 刘兵城 魏辉 李巍 刘凯奇 魏述宁 宫本法 王津雨张广吉 刘云涛 赵邢力 弓晓媛 李艳 顾闰夏 秘营昌 王建祥
中国医学科学院血液病医院白血病中心,天津 300020
目的研究大剂量甲氨蝶呤(HD-MTX)治疗成人急性淋巴细胞白血病时的药物代谢作用及不同解救方案的价值。方法回顾性分析2003至2010年收治的124例成人患者(共190例次HD-MTX治疗)的临床和实验室资料。结果190例次患者的甲氨蝶呤血药浓度降至0.1μmol/L以下的中位时间是72 h(48~342 h),76例次(40%)发生延迟排泄;延迟排泄组患者的不良反应显著增高(P<0.05),其体质指数和甲氨蝶呤治疗第7日的血清肌酐水平均显著高于正常排泄组(分别为P=0.046和P<0.001)。甲酰四氢叶酸钙联合左旋门冬酰胺酶解救不优于单用亚叶酸钙(P=0.849)。缩短甲氨蝶呤输注时间并提前亚叶酸钙的解救时机不能改善甲氨蝶呤的延迟排泄,但可减轻血液学不良反应。结论体质指数、血清肌酐水平影响甲氨蝶呤的代谢。适度缩短甲氨蝶呤输注时间和提前亚叶酸钙的解救时机或能改善甲氨蝶呤的排泄和不良反应。
急性淋巴细胞白血病;甲氨蝶呤;血药浓度;延迟排泄
Oncol Prog,2015,13(1)
甲氨蝶呤(methotrexate,MTX)是治疗儿童和成人急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)的常用化疗药物,由于其在体内的分布、生物转化和排泄均存在很大的个体差异[1],且这些差异可影响药物的疗效和毒性作用,因此监测MTX的血药浓度并根据血药浓度进行甲酰四氢叶酸钙(calcium leucovorin,CF)解救方案的调整和MTX下次用药的调整是十分必要的。本研究主要以成人ALL患者为主,观测MTX持续静脉输注后的血药浓度变化和毒性反应,尝试给予CF联合左旋门冬酰胺酶(L-asparaginase,L-asp)解救方案,对既往MTX延迟排泄患者的再次用药进行调整,探讨在相应用量下患者的药物代谢情况、影响因素和解救措施,为合理应用MTX治疗成人ALL提供参考数据。
1 资料与方法
1.1 一般资料
入组2003年11月至2010年7月我院白血病诊疗中心连续收治的124例ALL患者,其中男性73例,女性51例,均处于完全缓解期,应用大剂量MTX(high dosemethotrexate,HD-MTX)巩固治疗190例次(表1)。ALL的诊断及分型依据文献标准[2]。
1.2 治疗方案
MTX的给药剂量为3.0 g/(m2·d),持续输注24 h。具体给药方式为:先给总量的1/3,即1.0 g/(m2·d),在第1个小时内静脉输注;然后给余量,即2.0 g/(m2·d),静脉持续输注23 h;同时给予3000 m l/(m2·d)的水化治疗和5%碳酸氢钠100 m1/(m2·d)的碱化治疗,使尿液的pH值大于6.5。MTX给药结束12 h后(即MTX开始后36 h)开始给予CF解救治疗,剂量为MTX用量的7.5%,分6~8次静脉输注,每6小时1次(首剂为50mg),直至MTX的血清浓度小于0.1μmol/L时停止CF解救。部分例次在MTX开始后第3日和第4日接受L-asp治疗,剂量为6000 u/(m2·d)。治疗前,患者及(或)法定监护人均签署知情同意书。
1.3 标本采集与MTX浓度的测定
从MTX开始输注后的24 h(MTX输注结束)、36 h、48 h、72 h,分别采取静脉血2m l,之后每隔24 h采血1次,直至患者的MTX血清浓度小于0.1μmol/L为止。若患者72 h的MTX血药浓度大于等于0.1μmol/L,则被诊断为MTX延迟排泄[3]。采用荧光偏振免疫分析仪(购自美国雅陪公司)测定MTX血药浓度。在MTX治疗前1日、MTX治疗开始的第4日及第7日,分别检测患者的血常规和肝肾功能。
1.4 分组方法
为探讨解救方案中加用L-asp对MTX排泄的影响,本研究将患者分为单用CF解救组和CF联合L-asp解救组。对于曾发生MTX延迟排泄者,我们将MTX输注时间缩短至12 h,并将CF解救治疗的初始时间提前到MTX开始输注的20 h后(共21例次)。为探讨解救治疗初始时间对MTX排泄的影响,患者被分为正常解救组和提前解救组。
1.5主要观察指标
对比各分组患者的MTX中位剂量、MTX血药浓度降至<0.1μmol/L的中位时间、MTX血药浓度持续≥1μmol/L的中位时间、各主要时间节点MTX血药浓度的中位值、MTX开始治疗前1日及治疗第7日血清肌酐中位值、体质指数(body mass index,BM I)及MTX相关的不良反应。
1.6 统计学分析
应用SPSS 16.0软件进行统计学处理,计量资料以中位数表示,采用秩和检验比较,计数资料用率表示,应用卡方检验。以P<0.05为差异有统计学意义。
2 结果
2.1 MTX的监测及其不良反应结果
76例次(40.0%)患者出现MTX延迟排泄,114例次(60%)患者为MTX正常排泄,两类患者BM I的中位值分别为21.93(16.14~32.35)kg/m2和21.69(14.60~34.26)kg/m2,MTX开始治疗第7日的血清肌酐中位值分别为71.80(2.42~711.90)μmol/L和57.00(23.00~96.00)μmol/L,差异均具有统计学意义(PBMI=0.046和P血清肌酐<0.001);但身高、体重、肝功能、内生肌酐清除率等均无统计学意义(均P>0.05)。MTX延迟排泄患者的不良反应,如3级以上贫血、口腔黏膜炎或溃疡、恶心及呕吐、蛋白尿,均重于MTX正常排泄患者(均P<0.05)。190例次ALL患者主要监测节点的MTX血药浓度及不良反应详见表2。
2.2 联合L-asp解救对患者MTX排泄的影响
单用CF解救组与CF联合L-asp解救组患者的MTX延迟排泄率、BM I、血药浓度达到0.1μmol/L以下的中位时间均无统计学意义(下页表3,均P>0.05),提示CF联合L-asp方案的解救价值并不优于单用CF方案。CF联合L-asp解救组患者粒细胞缺乏、血小板减少、口腔黏膜炎和恶心呕吐等不良反应事件的发生情况与单用CF解救组患者相比均无统计学意义(均P>0.05)。
2.3 解救时间对MTX排泄和不良反应的影响
提前解救组患者的MTX血药浓度持续≥1μmol/L的中位时间低于正常解救组患者的(下页表4)。提前解救组患者出现白细胞减少(71.4%vs 90%,P=0.012)、粒细胞减少(52.4%vs 76.8%,P=0.015)、贫血(42.9%vs73.7%,P=0.003)的发生率均低于正常解救组患者的,两组患者口腔黏膜炎、恶心和呕吐等非血液学不良反应事件的发生率均无统计学意义(P>0.05)。
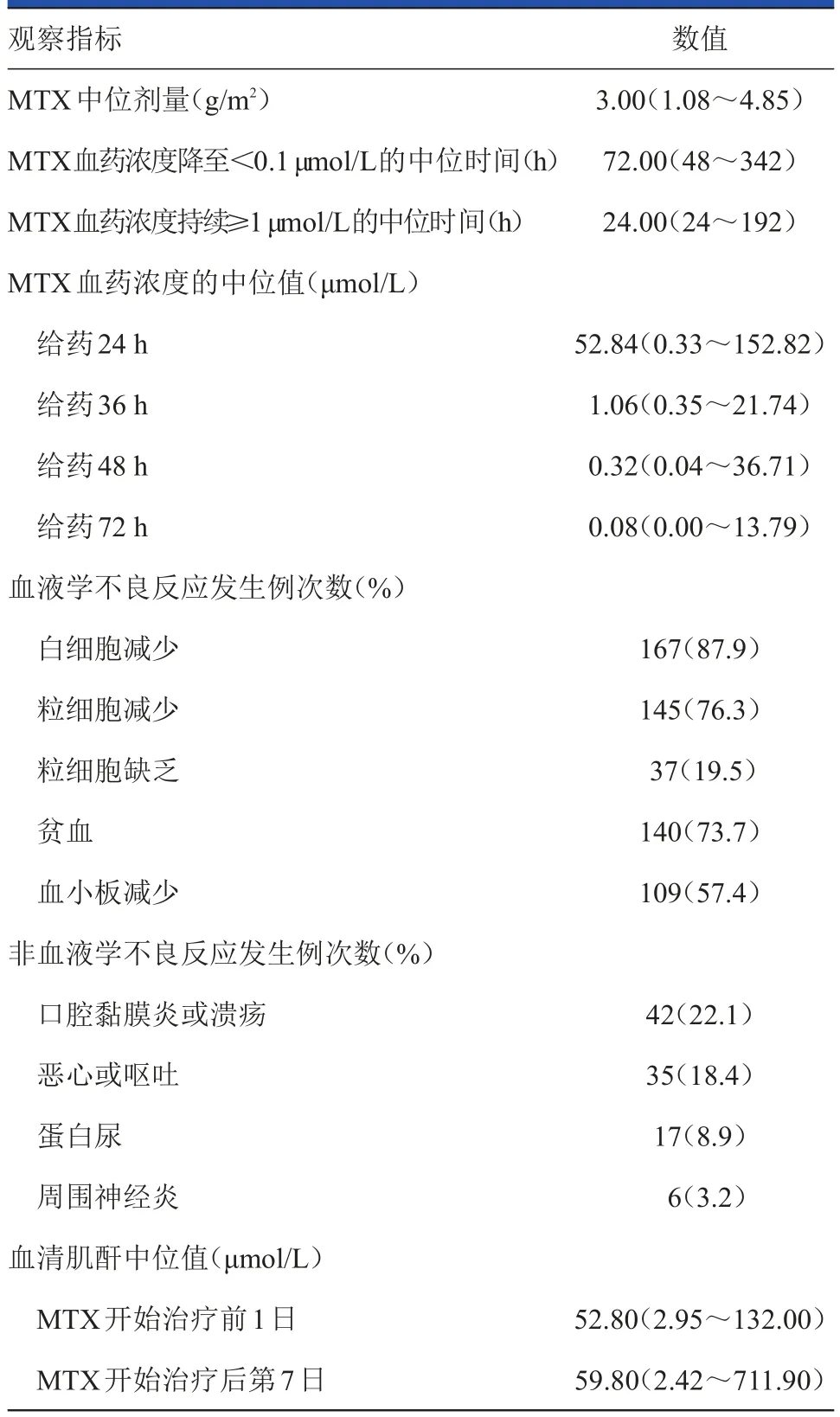
表2 190例次ALL患者主要观察时点的MTX血药浓度及不良反应
3 讨论
HD-MTX治疗ALL已有近50年的历史,但其用于治疗成人ALL的循证医学证据较少,临床方案的制定仍以医生经验为主。目前,MTX持续输注24 h的即刻血药浓度被普遍认为是稳态浓度。细胞形成MTX多聚谷氨酸盐衍生物(methotrexate polyglutamate,MTXPG)能力的不同和叶酸代谢途径基因表达的多态性可能导致稳态浓度的差异。儿童ALL的相关研究[4-5]结果显示,MTX延迟排泄和高浓度事件更易见于体型肥胖(BM I高)的患者。Oudol等[3]认为这可能与药物的表观容积分布有关。
MTX及其代谢物主要经过肾脏排泄,并且MTX及其代谢物7-OH-MTX的水溶性低,在酸性环境下更易形成结晶并沉积在肾小管内。Xu等[6]和Dem iana等[7]的研究肯定了血清肌酐浓度对MTX血药浓度有显著影响。在本研究中,MTX延迟排泄患者的血清肌酐水平高于MTX正常排泄患者,下降速度低于MTX正常排泄患者组,说明MTX排泄与肌酐水平的下降是一致的。

表3 单用CF解救方案与CF联合L-asp解救方案对部分观察指标的影响
MTX的细胞毒性主要与组织所暴露的血药浓度和暴露时间有关,也与CF解救的时机和解救方案有关。缩短MTX静脉输注时间、尽早开始给予CF解救、延长CF的给药时间或加量,是减轻MTX毒性作用的常用措施[8]。M ikkelsen等[9]的研究证明,缩短MTX输注时间可缩短暴露于治疗浓度(1μmol/L)的时间。Brugieres等[10]也观察到,缩短MTX输注时间并接受CF提前解救组患者发生4级血液学不良反应的频率低于其他组患者(64%vs 79%,P<0.001)。本研究结果也表明,缩短MTX输注时间和提前CF解救时间可能减轻MTX的延迟排泄,降低了MTX的血液学毒性作用;与儿童肿瘤研究结果类似[9-10]。这或为降低了组织的MTX暴露浓度和暴露时间所致,但医生应注意缩短MTX输注时间可能会影响其疗效,应在疗效和不良反应间寻找平衡。
L-asp可以减少细胞内MTXPG的形成和促进细胞内游离MTX的外排,从而降低MTX的毒性作用[11]。既往的体外实验和临床资料均证实了L-asp的有效性。但在本研究中,在CF基础上联用L-asp的解救治疗方案并未缩短MTX血药浓度达到0.1μmol/L以下的中位时间,更未降低MTX延迟排泄的比例和MTX的毒性作用;也许扩大研究的样本量,并同步测定MTXPG的浓度,可以更真实地明确L-asp在该联合解救治疗方案中的角色。
综上所述,BM I、血清肌酐水平影响了MTX的代谢,MTX延迟排泄时的毒性作用增大,为了改善排泄和降低其毒性所致的不良反应,适度缩短MTX输注时间和提前CF解救时机是可行的,而CF联合L-asp方案的解救价值还需更多研究予以进一步验证。

表4 正常解救组和提前解救组部分观察指标的比较
[1]Kodidela S,Suresh Chandra P,Dubashi B.Pharmacogenetics of methotrexate in acute lymphoblastic leukaem ia: why still at the bench level?[J].Eur J Clin Pharmacol, 2014,70(3):253-260.
[2]张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2007.
[3]Odoul F,Guellec CL,Lamagenere JP,et al.Prediction of methotrexate elimination after high dose infusion in children w ith acute lymphoblastic leukemia using a pupolation pharmaeokinetic approach[J].Fundam Clin Pharmacol,1999,13:595-604.
[4]Jonsson P,Skärby T,Heldrup J,et al.High dosemethotrexate treatment in children w ith acute lymphoblastic leukaem iamay be optim ised by a weight-based dose calculation[J].Pediatr Blood Cancer,2011,57(1):41-46.
[5]张春燕,顾健,李玉珍,等.大剂量甲氨蝶呤治疗329例儿童急性淋巴细胞白血病的群体药物动力学研究[J].中国实验血液学杂志,2008,1:106-110.
[6]Xu WQ,Zhang LY,Chen XY,et al.Serum creatinine and creatinine clearance for predicting plasmamethotrexate concentrations after high-dose methotrexate chemotherapy for the treatment for childhood lymphoblastic malignancies[J].Cancer Chemother Pharmacol,2014,73 (1):79-86.
[7]DemianaWF,Jean SH,Saik U,et al.Population pharmacokinetic study of methotrexate in patients w ith lymphoid malignancy[J].Cancer Chemother Pharmacol, 2006,58:626-633.
[8]Cohen IJ,Wolff JE.How long can folinic acid rescue be delayed after high-dose methotrexate w ithout toxicity? [J].Pediatr Blood Cancer.2014,61(1):7-10.
[9]M ikkelsen TS,Sparreboom A,Cheng C,et al.Shortening infusion time for high-dose methotrexate alters antileukem ic effects:a random ized prospective clinical trial [J].JClin Oncol,2011,29(13):1771-1778.
[10]Brugières L,Le Deley MC,Rosolen A,et al.Impact of themethotrexate adm inistration dose on the need for intrathecal treatment in children and adolescents w ith anaplastic large-cell lymphoma:Results of a random ized trial of the EICNHL Group[J].JClin Oncol,2009,27 (6):897-903.
[11]Jacques J,Diane EC,John SH,et al.Prevention of methotrexate cytotoxicity by asparaginase inhibition of methotrexate polyglutamate formation[J].Cancer Res, 1985,45(1):217-220.
A study on pharmacokineticsof high dosemethotrexate(HD-MTX)in adults w ith acute lymphoblastic leukem ia△
LIYuan WANG Ying#LIN dong ZHOU Chun-lin LIU Bing-cheng WEIHui LIWei LIU Kai-qi WEIShu-ning GONG Ben-fa WANG Jin-yu ZHANG Guang-ji LIU Yun-tao ZHAO Xing-li GONG Xiao-yuan LIYan GU Run-xia M IYing-chang WANG Jian-xiang
Leukemia Center,Institute of Hematology&Blood Disease Hospital,
Chinese Academy ofMedical Sciences&Peking Union MedicalCollege,Tianjin 300020,China
ObjectiveTo investigate the plasma pharmacokinetics of high dose methotrexate(HD-MTX)in the treatment of adult acute lymphoblastic leukemia(ALL)and the factors affecting MTX elimination,and to evaluate the roles of various rescue schemes.MethodClinical and laboratory data of 124 adult ALL patients treated w ith HD-MTX in our hospital from 2003 to 2010 were retrospectively analyzed.ResultThe median time for blood concentration of MTX decreased to below 0.1μmol/L was 72(48~342)hours.Of 190 case-times,delayed MTX eliminationswere seen in 76 case-times(40%).More MTX toxicities were observed in delayed group(P<0.05).Body mass index(BM I)and serum creatinine on MTX day 7 in delayed group were higher than those in normal group(P=0.046 and P<0.001,respectively).The rescue regimen of calcium leucovorin(CF)+L-asparaginase was not superior toCF alone(P=0.849).Shortened infusion time of HD-MTX and early CF rescue did not decrease the proportion of delayed MTX elimination,hematologic toxicities were reduced though.ConclusionBM I and serum creatinine impact MTX elimination.Moderately shortened infusion time for HD-MTX and early CF rescue are probably feasible to get adequate MTX elim ination and less toxicity.
acute lymphoblastic leukem ia;methotrexate;blood concertration;delayed elim ination
R733.7
A
10.11877/j.issn.1672-1535.2015.13.01.21
国家自然科学基金青年科学基金(81400136);协和青年基金和中央高校基本科研业务费专项资金(33320140064);“十二五”国家科技支撑计划课题(2014BAI09B12);天津市科技计划项目(12ZCDZSY 17500)
#通信作者(corresponding author),e-mail:wyw jl126@126.com
2014-10-31)

