压力性尿失禁大鼠模型阴道前壁组织中结缔组织生长因子和整合素β1的表达
崔灿 王志莲 郝敏等
[摘要] 目的 探讨结缔组织生长因子(connective tissue growth factor,CTGF)及整合素β1(integrin β1)在压力性尿失禁(stress urinary incontinence,SUI)大鼠模型阴道前壁中的表达。 方法 将健康雌性SD大鼠24只随机分为3组,A组大鼠作为对照组不做任何处理;B组大鼠仅行阴道扩张;C组大鼠行阴道扩张加双侧卵巢切除。于术后第4周测定最大膀胱容量(MBC)和腹压漏尿点压(ALPP),检测压力性尿失禁模型是否建立成功。建模成功4周后处死大鼠后取阴道前壁组织,行免疫组化染色方法和实时荧光定量TR-PCR技术检测CTGF和整合素β1的表达。结果 尿流动力学检测(MBC、ALPP):B、C组较A组明显降低,且各组之间比较均有统计学意义(P<0.05);CTGF mRNA与蛋白质的表达C组低于A组(P<0.05),A、B两组之间比较差异无统计学意义(P>0.05);C组整合素β1 mRNA及蛋白质的表达明显低于A、B组(P<0.05),且A、B两组之间比较差异有统计学意义(P<0.05)。 结论 在SUI大鼠阴道前壁CTGF和整合素β1的低表达可能与压力性尿失禁等盆底支持结构的退行性病变的发生存在密切关系。
[关键词] 压力性尿失禁;结缔组织生长因子;整合素β1
[中图分类号] R694.54 [文献标识码] A [文章编号] 1673-9701(2015)11-0025-04
[Abstract] Objective To investigate the expression of the connective tissue growth factor(CTGF) and integrin β1 in vaginal anterior wall of the model rats with stress urinary incontinence. Methods Twenty-four healthy female SD rats were randomly divided into three groups, group A rats as control group without any treatment;group B rats only with vaginal expansion;group C rats with vaginal expansion and bilateral ovaries removed. At postoperative four weeks to determine the maximum bladder capacity (MBC) and abdominal pressure leakage point pressure (ALPP), to establish detection model for stress urinary incontinence. Modeling successfully executed in rats after four weeks after vaginal anterior wall tissue, immunohistochemical staining method and real-time fluorescent quantitative RT-PCR technique to detect the expression of CTGF and integrin β1. Results The urine flow dynamic detection (MBC, ALPP): B and C group was significantly lower than group A, there were statistically significant differences(P<0.05);CTGF mRNA and protein expression in group C was significantly lower than group A (P<0.05), there were no statistical significance between group A and group B(P>0.05);integrin β1 mRNA and protein in group C expression was lower than that in group A and B(P<0.05), and differences between A and B were statistically significant(P<0.05). Conclusion The anterior wall vaginal CTGF in rats in SUI and low expression of integrin β1 may be related to stress urinary incontinence and other pelvic floor support structure there is a close relationship of the occurrence of degenerative diseases of the pelvic floor support degenerative diseases.
[Key words] Stress urinary incontinence; Connectivetissue growth factor; Integrin β1
压力性尿失禁(stress urinary incontinence,SUI) 定义为在无逼尿肌收缩的情况下,腹压增高引起膀胱内压增高,超过尿道和括约肌产生的压力,尿液自尿道外口漏出的现象[1]。威胁生命且严重影响到患者的心理、生理健康,同时会给社会造成一定程度的经济负担。盆底结缔组织结构改变或功能减弱的分子学机制是目前压力性尿失禁研究的热点[2]。近些年来对于SUI发病机制的研究越来越受到重视,研究表明[3],在SUI患者盆底支持结构中,胶原弹性蛋白含量的减少会导致支持组织弹性减弱,从而出现盆底的松弛,进一步导致SUI。而结缔组织生长因子(connectivetissue growth factor,CTGF)可以刺激成纤维细胞增殖和分泌胶原,在纤维化性疾病创伤后瘢痕形成等方面有较多的研究,含β1亚单位的整合素主要介导细胞与细胞外基质成分之间的黏附,近年研究发现CTGF可以通过与整合素受体结合调节细胞内信号通路的活性。然而关于整合素β1在SUI发生发展机制的相关研究较为少见。本实验的研究目的为检测CTGF和整合素β1在压力性尿失禁大鼠模型的阴道前壁中的表达,进一步探究其在压力性尿失禁发生机制中的作用,以期为压力性尿失禁的预防、治疗提供实验基础及理论依据。
1材料与方法
1.1 实验动物
24只健康雌性SD大鼠由山西医科大学生理实验室提供,体重220~250 g。随机分三组,每组8只:A组不做任何处理;B组行阴道扩张模拟难产;C组模拟难产加双侧卵巢切除。4周后经检测建模是否成功(尿动力学检测和喷嚏实验证实 ),见表1。
1.2 标本采集及处理
造模成功后常规喂养4周后将大鼠处死,取阴道前壁组织两块,约0.5 cm×0.5 cm×0.5 cm,反复、多次用生理盐水洗净,一块放入加有中性缓冲液的10%的甲醛液中固定,准备行免疫组织化学检测。另一块立即放入-80℃液氮中,以避免mRNA降解,待行实时荧光定量TR-PCR技术检测。
1.3 试剂
羊抗兔CTGF、整合素β1和β-actin多克隆抗体(博奥森生物技术有限公司),辣根过氧化酶的山羊抗鼠二抗(购于北京中杉金桥公司),试剂盒、RT-PCR盒及相关试剂(北京全式金生技术有限公司),引物(北京博大泰克生物技术公司)。
1.4 免疫组织化学检测CTGF及整合素β1蛋白的表达
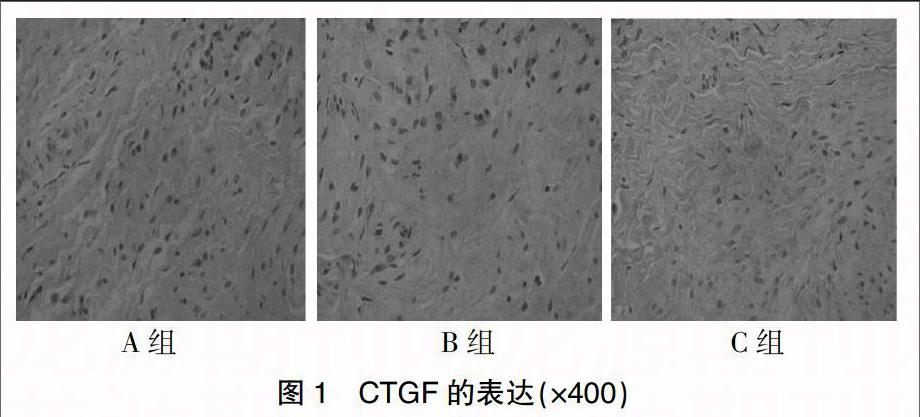
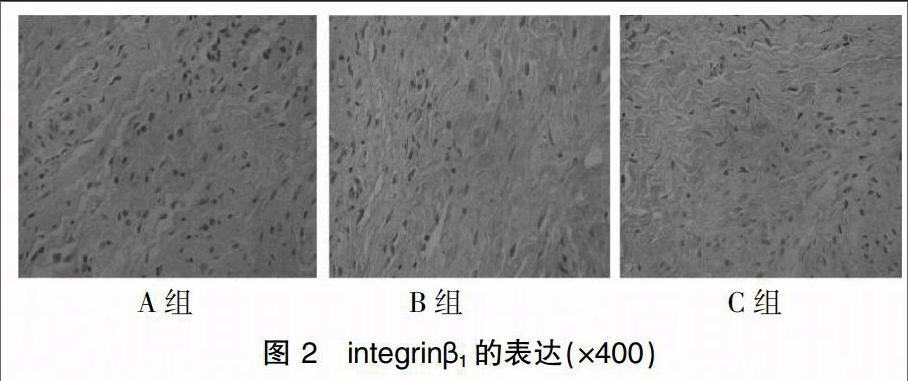
采用SABC法进行免疫组织细胞化学染色。结果判定:细胞外基质染为黄色或棕黄色为CTGF蛋白及β1整合素蛋白阳性。操作步骤按免疫细胞化学检测试剂盒说明书进行。用BI 2000医学图像分析系统采集显微镜下图像,随机在每张免疫组化切片上选择5个视野 (400倍),每个视野拍摄5张照片,根据阳性细胞个数(A)及细胞显色程度(B)计算免疫组化评分(IHS),以其均值进行比较[4]。
1.5 实时荧光定量TR-PCR
按照Trizol试剂使用说明书提取总RNA,经AMV逆转录合成cDNA。引物碱基序列见表2。反应条件为:94℃预变性5 min,94℃预变性2 min,35个循环(94℃变性30 s,58℃退火30 s,72℃延伸2 min),72℃最后延伸5 min。根据实时荧光定量RT-PCR的原理,以β-actin基因mRNA的表达为内对照,首先计算出各目的基因的CT值与β-actin内参基因的CT值的差值,即ΔCT=CT(目的基因)-CT(β-actin),然后计算实验组各样本的ΔCT值与对照组样本的ΔCT值的差值,从而得到ΔΔCT值,即ΔΔCT=ΔCT(实验组)-CT(对照组),利用2-ΔΔCT进行计算,表示实验组测定基因的表达相对于对照组样本基因的表达的变化倍数[5],将2-ΔΔCTx±s作为最后的定量结果用于统计分析。
1.6 统计学方法
采用SPSS 13.0软件进行统计分析,计量资料用均数±标准差(x±s)表示,多组间正态分布采用单因素方差分析,两两之间比较采用LSD-t法;不满足正态性和方差齐性则采用秩和检验。P<0.05为差异有统计学意义。
2结果
2.1 免疫组化检测CTGF、整合素β1蛋白的表达
见图1、2及表3。镜下3组阴道前壁标本均可见CTGF蛋白及整合素β1蛋白表达于成纤维细胞胞浆。A组CTGF蛋白的等级资料免疫组化评分为(7.75±1.49)分,B组免疫组化评分为(6.25±1.91)分,C组免疫组化评分为(5.50±0.93)分,A组与B组比较差异无统计学意义(P>0.05),A组明显高于C组,差异有统计学意义(P<0.05),B组与C组比较差异无统计学意义(P>0.05);A、B、C三组整合素β1蛋白的免疫组化评分分别为(6.13±1.36)分、(5.00±1.07)分、(3.63±0.74)分,A组与B组比较差异无统计学意义(P>0.05),C组明显低于A、B两组,差异有统计学意义(P<0.05)。
2.2 RT-PCR检测CTGF mRNA及整合素β1 mRNA的表达
见表4。B组、C组CTGF mRNA的表达量均低于A组,差异有统计学意义(P<0.05),但B组与C组比较差异无统计学意义(P>0.05);C组整合素β1 mRNA的相对表达量低于A组、B组,差异有统计学意义(P<0.05),但B组与A组比较差异无统计学意义(P>0.05)。
3讨论
压力性尿失禁有“社交癌”之称,严重地影响了女性的社交活动,同时还可引发心理障碍,给家庭和国家医疗服务增加一定的经济负担[5]。由于分娩、手术等原因所造成得盆底组织损伤与女性SUI有直接的关系。
随后Batmunkh等[6]在PDGF诱导下的人类脐静脉内皮细胞培养基中发现CTGF的分泌,并将其首次克隆出来。CTGF也称作CCN2,属于即刻早期基因(CCN)家族的成员之一[7],其编码基因定位于6号染色体长臂(6q23.1)上,是一种由349个氨基酸残基组成的富含半胱氨酸的分泌性多肽[8],分子量为36~38 kD[9]。CTGF的来源细胞种类繁多,如胚胎细胞、肾间质细胞、肾小球系膜细胞、肝星状细胞、血管内皮细胞及平滑肌细胞等。CTGF在人类心脏、胎盘、肺、肝脏及肾脏等多种组织器官中均有表达。在组织损伤修复、纤维化、溃疡愈合及肿瘤发生等多种组织重建相关性疾病中,CTGF均起到重要作用[10,11]。Daniels等[12]研究证实在成纤维母细胞中,少量表达的CTGF可促进胶原的收缩,控制基质金属蛋白酶MMPs的作用,据此推测CTGF在SUI的发生发展中可能与盆底组织损伤后修复有关。目前利用脂肪源性干细胞(ADSC)增殖和分化为成纤维细胞来治疗SUI,是盆底疾病领域的一个研究热点[13,14]。有研究表明,在体外培养的大鼠脂肪干细胞中发现CTGF刺激可以使各型胶原表达逐渐增加,并且随着刺激时间的延长而逐渐上升[15]。本实验结果显示,在压力性尿失禁大鼠模型阴道前壁组织中,阴道扩张加双侧卵巢切除组的CTGF蛋白和mRNA表达水平均明显低于正常组,但阴道扩张组及阴道扩张加双侧卵巢切除组CTGF的蛋白和mRNA水平的比较无明显差异,提示在CTGF表达降低,可能减少刺激成纤维细胞的增殖和胶原的分泌,从而影响盆底结缔组织结构的稳定性及完整性,可能是导致SUI发生的重要原因。
整合素β1是一类近年来新发现的CTGF的细胞表面受体,CTGF可以直接与其细胞表面的整合素β1受体结合进而启动下游细胞信号转导途径,发挥促进纤维化的作用。有研究报道,在肝纤维化发生发展中,整合素β1发挥了调节细胞增殖、黏附等功能。目前国内外主要在心、肝及皮肤瘢痕等组织中对整合素β1进行研究,其过度表达可以导致一些纤维化性或增生性的疾病发生,如肝硬化、肝纤维化等。但是目前在SUI方面的研究较少见。本实验结果显示,在压力性尿失禁大鼠模型阴道前壁组织中,阴道扩张加双侧卵巢切除组的整合素β1蛋白和mRNA表达水平均明显低于正常组及仅阴道扩张组,提示在SUI的发生机制中,整合素β1表达的降低可能影响其作为受体与CTGF结合,将信号传递至细胞内,进一步导致盆底结缔组织损伤后的修复。
综上所述,多种因素综合作用下导致盆底结缔组织中胶原含量的减少及其作用的发挥,最终可能造成SUI的发生。CTGF/整合素β1信号转导通路与SUI的发生机制的相关性研究,目前还在动物组织学水平的实验阶段,根据现有实验结论推测,有效地抑制该通路,可能会引起成纤维分泌胶原蛋白的减少,而导致SUI的发生。如果能以此通路的作用机制作为今后SUI发生的研究靶点,进一步研究二者下游启动哪些信号通路来发挥作用,可能为SUI的预防、治疗提供一定的理论依据。
[参考文献]
[1] Hunskaar S,Burgio K,Clark A,et al. Epedemiology of urinary andfecal incontinence and pelvic organ prolapsed[M]//Abrams P,Cardozo L,Khoury S,et al. Incontinence:3rd international consultation on incont inence[M]. Paris:Health Publication Ltd,2005:255-312.
[2] Koike Y,Furuta A,Suzuki Y,et al. Pathophysiology of urinary incontinence in murine models[J]. Int J Urol,2013,20(1): 64-71.
[3] 曹冬,王建六. 盆底结缔组织胶原代谢异常与压力性尿失禁[J]. 国外医学(妇产科学分册),2006,33(2):89-91.
[4] Soslow RA,Dannenberg AJ,Rush D,et al. Cox-2 is expressed in human pulmonary,colonic,and mammary tumors[J]. Cancer,2000,89:2637-2645.
[5] 朱兰,郎景和,刘春燕,等. 我国成年女性尿失禁患病状况的流行病学研究[J]. 中华妇产科杂志,2009,44(10):776-779.
[6] Batmunkh R,Nishioka Y,Aono Y,et al. CCN6 as a profibrotic mediator that stimulates the proliferation of lung fibroblasts via the integrin beta1/focal adhesion kinase pathway[J]. The journal of medical investigation, 2011,58(3-4):188-196.
[7] Katsube K,Sakamoto K,Tamamura Y,et al. Role of CCN, a vertebrate specific gene family,indevelopment[J]. Dev Growth Differ,2009,51(1):55-67.
[8] Riser BL,Najmabadi F,Perbal B,et al. CCN3 (NOV) is a negative regulator of CCN2(CTGF)and a novel endogenous inhibitor of the fibrotic pathway in an in vitro model of renal disease[J]. Am J Pathol,2009,174(5):1725-1734.
[9] Hao S,Shen H,Hou Y,et al. tPA is a potent mitogen for renal interstitial fibroblasts:Role of beta1 integrin/focal adhesion kinase signaling[J]. The American Journal of Pathology, 2010,177(3):1164-1175.
[10] An J,Zheng L,Xie S,et al. Down-regulation of focal adhesion kinase by short hairpin RNA increased apoptosis of rat hepatic stellate cells[J]. Acta Pathologica, Microbiologica,Etimmunologica Scandinavica,2011,119(6):319-329.
[11] Liu Z,Zhou Y,Wu W. Effect of antisense oligonucleotides targeting focal adhesion kinase on the proliferation and activation of hepatic stellate cells[J]. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi,2008,25(2):419-423.
[12] Daniels JT,Schultz GS,Blalock TD,et al. Mediation of transforming growth factor-beta(1)-stimulated matrix contraction by fibroblasts:A role for connective tissue growth factor in contractile scarring[J]. Am J Pathol,2003,163(5):2043-2052.
[13] Nikolavasky D,Stangel-Wójcikiewicz K,Stec M,et al. Stem cell therapy:A future treatment of stress urinary incontinence[J]. Semin Reprod Med,2011,29(1):61-70.
[14] Stangel-Wójcikiewicz K,Majka M,Basta A,et al. Adult stem cells therapy for urine incontinence in women[J]. Ginekol Pol,2010,81(5):378-381.
[15] Hwang JH,Kim IG,Piao S,et al. Combination therapy of human adipose-derived stem cells and basic fibroblastgrowth factor hydrogel in muscle regeneration[J]. Biomaterials,2013,34(25):6037-6045.
(收稿日期:2015-01-28)

