黄曲霉毒素B1 对雏鸡外周血T 淋巴细胞亚群及 血清IL–2和IFN–γ 的影响
于正强,陈瑾,2,彭西*,方静,陈科杰,何杨
(1.四川农业大学 动物医学院,四川 雅安 625014;2.西昌市畜牧局,四川 西昌 615000 )
黄曲霉毒素(aflatoxins,AFs)主要为黄曲霉菌及寄生曲霉菌产生的次生代谢产物[1–2]。AFs 对粮农产品的污染是全球面临的严重问题[3]。黄曲霉毒素B1(AFB1)急性中毒可引起动物急性肝损伤,严重者甚至死亡。有研究表明,摄食高含量的AFB1是造成肝癌的重要原因[4]。同时,摄食含AFB1的食物,可下调机体内多种免疫因子水平,进而降低其免疫功能[5]。AFs 对哺乳动物的免疫毒性主要表现为T 淋巴细胞增殖受阻、多种细胞因子水平下调[5]。外周血T淋巴细胞亚群是反映体内成熟T 淋巴细胞数量与功能的重要指标。目前,AFB1对雏鸡外周血T 淋巴细胞亚群、IL–2 和IFN–γ 的影响的报道甚少。本试验以1日龄艾维茵肉鸡为研究对象,探究梯度剂量的AFB1日粮对雏鸡外周血T 淋巴细胞亚群、IL–2 和IFN–γ 的影响,旨在为进一步探讨AFB1致免疫功能损伤的机理提供理论依据。
1 材料与方法
1.1 供试动物与日粮
试验选用1日龄艾维茵健康公雏鸡100 只,按初始体重无差异原则随机分为4组,每组25 只,分别采食基础日粮和AFB1Ⅰ、Ⅱ、Ⅲ组日粮。饲养管理与常规育雏一致,自由饮水与采食,试验期21 d。
AFB1日粮的配制方法为:分别将1.5、3、6mg AFB1粉末溶于30mL 甲醇中,再将30mL 溶液逐级掺入10 kg 基础日粮中,然后将掺有甲醇的日粮置于37℃烘箱中烘干,待甲醇挥发后取出。对照组日粮取30mL 甲醇混入10 kg 基础日粮后,以同样方法烘干。由此方法配制而成的对照组、AFB1Ⅰ、Ⅱ组、Ⅲ组日粮中,AFB1的含量分别为0、0.15、0.3、0.6mg/kg。
基础日粮以玉米–豆粕为主配制而成,其中蛋白质含量、能量以及维生素和微量元素添加量均参照肉鸡NRC(2004)的营养标准。基础日粮配方见表1。
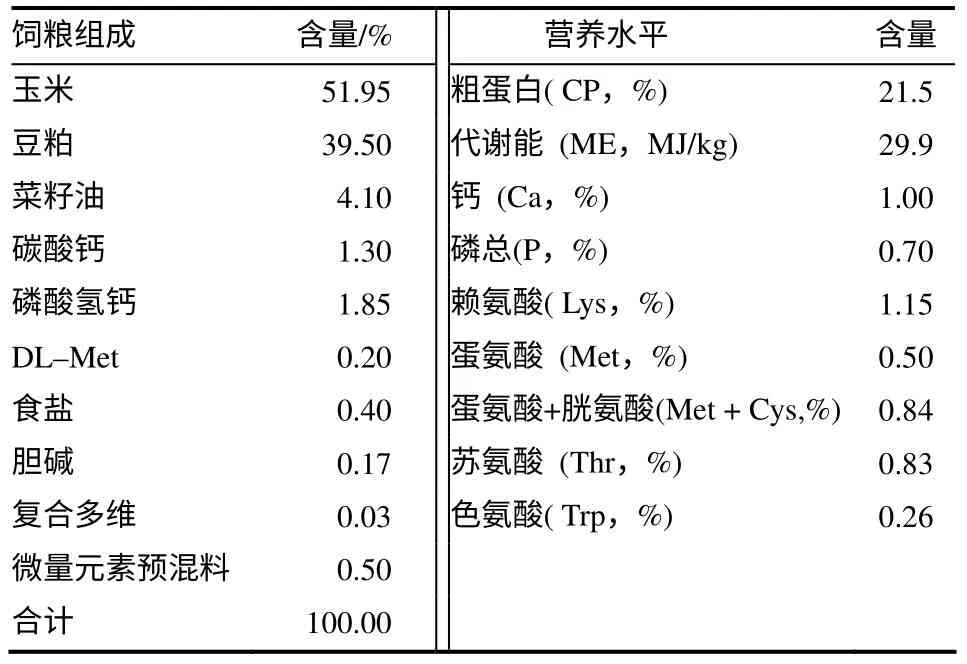
表1 基础日粮配方及营养水平 Table 1 Composition of the experimental diets and nutrition level
1.2 外周血T 淋巴细胞亚群检测
试验第7、14 和21天,每组随机取5 只雏鸡,颈静脉抽取1mL 外周血,EDTA 二钠抗凝。取1mL淋巴细胞分离液于流式管中,将血液沿管壁徐徐加至淋巴细胞分离液之上,保持清晰的分层状态,随后2 000 r/min 离心30min。离心后可见试管内血液明显分为3 层,上层为血浆层,中层为分离液层,底层为红细胞层,用吸管将上层与中层之间的淋巴细胞层吸出,收集到另一流式管中,PBS 洗2次后调节细胞浓度至1×106个/mL,吸取100 μL 细胞悬液于流式管中,加入CD4–FITC(SouthernBiotech, USA)、CD8–PE(SouthernBiotech, USA)和 CD3– SPRD(SouthernBiotech, USA)单克隆抗体,室温下避光反应30min,重悬细胞,流式细胞仪检测后用Cell Quest 软件分析 CD3+T、CD3+CD4+T、CD3+CD8+T 细胞占外周血淋巴细胞的百分比,并计算CD3+CD4+T 与CD3+CD8+T 细胞的比值。
1.3 血清IL–2、IFN–γ 含量检测
试验第7、14 和21天,每组随机取5 只雏鸡,颈静脉采血,3 000 r/min 离心10min,分离血清,4℃保存,备用。用 ELISA 试剂盒检测 IL–2 (11R020,Rapidbio, USA)、IFN–γ(11R046, Rapidbio, USA)含量。
1.4 数据处理
数据均经SPSS16.0 统计软件进行统计。用单因素方差分析法分析试验组与对照组间的差异显著性。
2 结果与分析
2.1 外周血T 淋巴细胞亚群的变化
从表2 可以看出,与对照组比较,Ⅰ组外周血CD3+T、CD3+CD4+T、CD3+CD8+T 细胞亚群所占百分比差异均没有统计学意义(P>0.05);Ⅱ组和Ⅲ组外周血CD3+T、CD3+CD4+T、CD3+CD8+T 细胞亚群所占百分比显著或极显著低于对照组(P<0.05 或P<0.01),各组间的CD4+/CD8+比值差异没有统计学意义(P>0.05)。从流式象限图(图1)可以看出,随着日粮中黄曲霉毒素含量的增加,CD3+CD4+T 细胞和CD3+CD8+T 细胞数量逐渐减少。
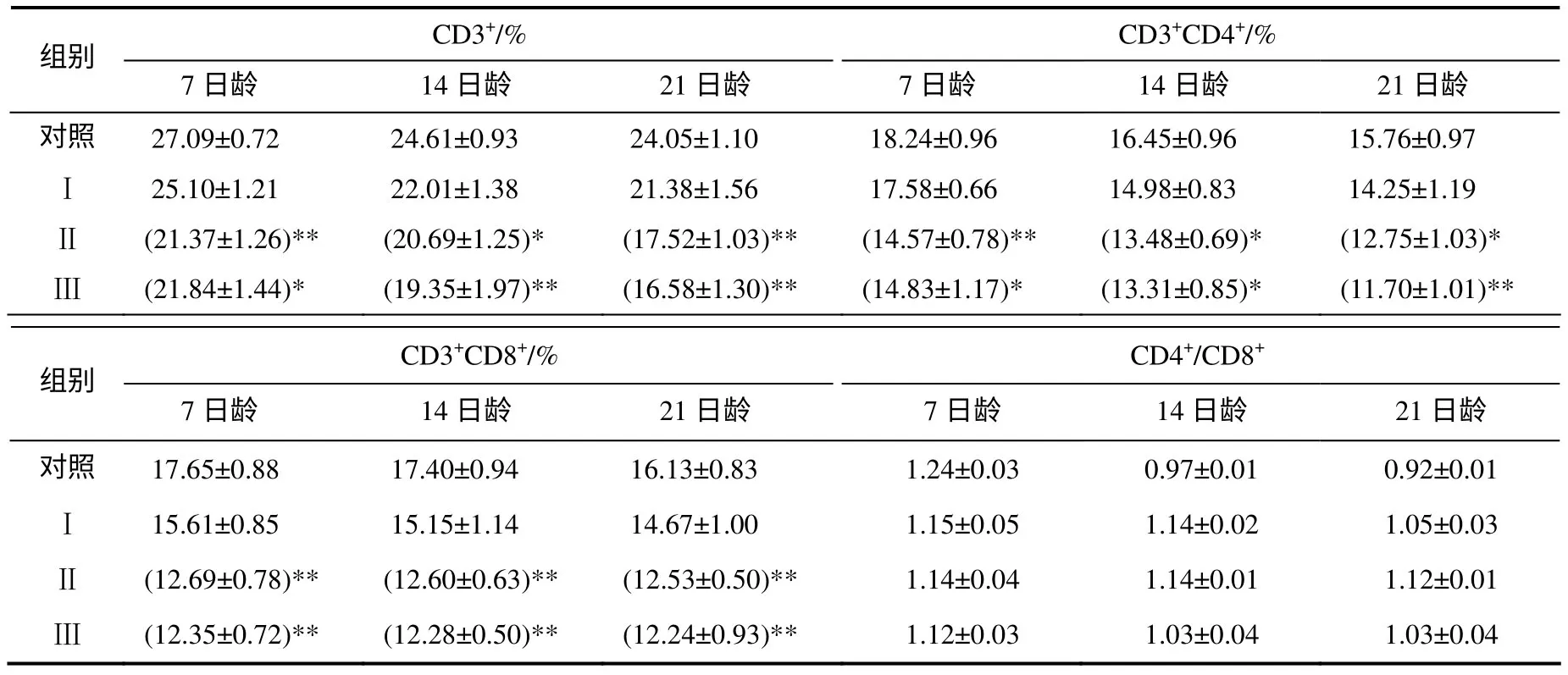
表2 外周血T 淋巴细胞亚群百分比及CD4+/CD8+比率的变化 Table 2 Percentage change of the peripheral blood T-lymphocyte subsets and ratio of CD4+/CD8+

图1 21日龄雏鸡的T 淋巴细胞亚群流式象限图 Fig.1 The quadrantal diagram of T–lymphocyte subsets detected with flow cytometer method at 21 days of age
2.2 血清IL–2、IFN–γ 含量的变化
血清IL–2 检测结果(表3)显示,14日龄时,AFB1Ⅰ组IL–2 含量显著低于对照组(P<0.05);7、14 和21日龄时,Ⅱ组IL–2 含量显著低于对照组(P<0.05);7、14 和21日龄时,Ⅲ组IL–2 含量显著或极显著低于对照组(P<0.05 或P<0.01)。
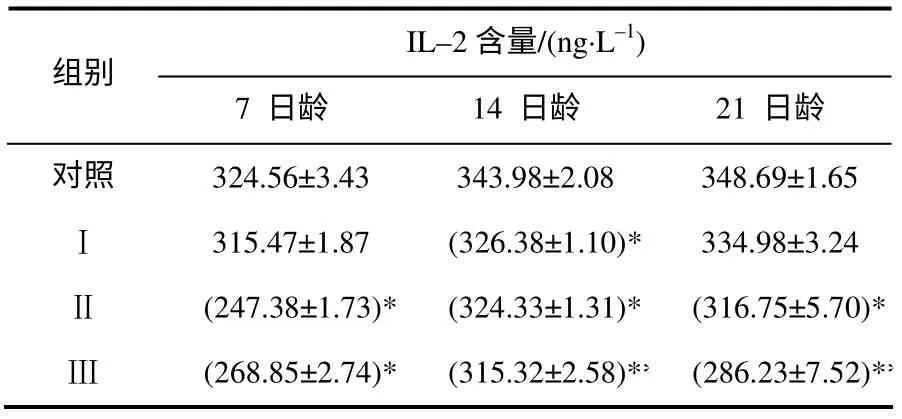
表3 不同日龄雏鸡血清的IL–2 含量 Table 3 Changes of the serum IL–2 content with day of age
血清IFN–γ 检测结果(表4)显示,7日龄时,AFB1Ⅰ、Ⅱ、Ⅲ组IFN–γ 含量显著或极显著低于对照组(P<0.05 或P<0.01);14日龄时血清IFN–γ 含量与对照组比较差异没有统计学意义(P>0.05),但仍呈现降低趋势;21日龄时,AFB1Ⅱ、Ⅲ组IFN–γ含量显著低于对照组(P<0.05)。

表4 不同日龄雏鸡血清的IFN–γ 含量 Table 4 Changes of the serum IFN–γ content with day of age
3 结论与讨论
成熟T 淋巴细胞是机体细胞免疫的重要参与者,其生物学功能由表面的亚群结构决定。CD3 是成熟T 细胞的表面标志,CD4 和CD8 分别表达于不同的亚群之上,CD4+T细胞是辅助性T淋巴细胞,而CD8+T 细胞是毒性T 淋巴细胞,二者均能增强TCR/CD3 复合物结合抗原多肽或MHC 复合物的能力[6]。本试验结果表明,Ⅱ、Ⅲ组(AFB1含量分别为0.3、0.6mg/kg)外周血CD3+、CD3+CD4+和CD3+CD8+T 细胞所占百分比均显著降低,且此效应从7日龄持续到21日龄。Tomková 等[7]和Sabourin 等[8]研究表明,AFB1可明显降低小鼠外周血CD3+T 细胞;Heugten 等[9]和Raisuddin 等[10]分别对猪和小鼠摄食AFB1后免疫功能的研究表明,AFB1可抑制T、B 淋巴细胞的增殖。胸腺为雏鸡中枢免疫器官,是CD4+T 细胞和CD8+T 细胞活化和分化的场所,成熟T 细胞由胸腺转移到外周血和次级免疫器官[11],因而T 细胞亚群的改变可反映机体胸腺功能的变化。AFB1可抑制淋巴细胞mRNA 的转录,同时影响DNA、RNA 的作用和蛋白质的生物合成[7,9,12],扰乱细胞有丝分裂的物质准备。本试验结果外周血T 淋巴细胞亚群比例下降可能是AFB1抑制胸腺淋巴细胞增殖所致,这可能是引起成熟T 淋巴细胞减少的原因。此外,CD4+与CD8+的比值也是衡量机体免疫状态的指标。本试验中AFB1组外周血T 细胞中CD4+与CD8+的比值与对照组比较差异均没有统计学意义,可能是CD3+CD4+和CD3+CD8+T 细胞的比例同时下降的结果。
IL–2 主要是在促有丝分裂素或特异性抗原刺激下,由活化的CD4+Th1 细胞分泌,是T 淋巴细胞从G1期进入S 期的主要刺激因子[6]。IL–2 能促进T 细胞增殖,通过增加T 细胞数量,提高CD4+T细胞活性,以增强机体免疫功能,同时IL–2 可刺激活化的T 细胞产生干扰素,诱导T 细胞产生IL–2[13]。本试验结果显示,AFB1Ⅱ、Ⅲ组血清IL–2含量明显降低,与Dugyala 等[14]用AFB1处理CD–1小鼠,结果显示脾细胞IL–2 表达量及其mRNA 水平显著下降的结果一致。IL–2 表达量的减少可能是AFB1影响淋巴细胞内DNA 转录和mRNA 翻译,最终影响蛋白质的生物合成的结果[14–15]。本试验中同时检测到血清IL–2 含量的减少和CD4+T 淋巴细胞比例降低,这可能与CD4+T 淋巴细胞数量的减少,致其分泌的IL–2 减少,抑制了T 淋巴细胞的增殖有关[16]。Choi 等[17]用AFB1处理鼠脾脏培养细胞,结果细胞中IFN–γ 的表达量明显降低,AFB1能抑制IFN–γ 的表达并呈现出剂量依赖性,本研究结果与其一致。IFN–γ 是由活化的CD4+Th1 细胞分泌的一种细胞因子,IFN–γ 的表达可促进CD8+T 细胞的功能[18],因而IFN–γ 的减少可能是由CD4+T淋巴细胞比例降低所致,同时IFN–γ 含量减少又会影响CD8+T 细胞的正常分化和增殖。在14日龄时,IFN–γ 水平与对照组相比呈下降趋势,但差异无统计学意义,这可能与不同个体对黄曲霉毒素的敏感性不同有关,也可能与机体通过稳态调节使各项机能接近正常有关[19]。
综上所述,雏鸡摄食含AFB1的日粮,可降低外周血T 淋巴细胞亚群数量及血清IL–2 和IFN–γ含量,进而导致其细胞免疫功能受损。
[1] Khare R,Bedi P.Aflatoxins:Occurrence and their effects-a review[J].Current Trends in Biotechnology and Chemical Research,2012,2(1):15–25.
[2] Ellis W,Smith J,Simpson B,et al.Aflatoxins in food:Occurrence,biosynthesis,effects on organisms,detection,and methods of control[J].Critical Reviews in Food Science & Nutrition,1991,30(4):403–439.
[3] Gong Y,Cardwell K,Hounsa A,et al.Dietary aflatoxin exposure and impairedgrowth in young children from benin and togo:Cross sectional study[J].Bmj,2002,325(7354):20–21.
[4] Aguilar F,Hussain S P,Cerutti P.Aflatoxin B1 induces the transversion of G-T in codon 249 of the p53 tumor suppressorgene in human hepatocytes[J].Proceedings of the National Academy of Sciences,1993,90(18):8586–8590.
[5] Jiang Y,Jolly P E,Ellis W O,et al.Aflatoxin B1 albumin adduct levels and cellular immune status inghanaians[J]. International Immunology,2005,17(6):807–814.
[6] Scharton T M,Scott P.Natural killer cells are a source of interferongamma that drives differentiation of CD4+T cell subsets and induces early resistance to leishmania major in mice[J].The Journal of Experimental Medicine,1993,178(2):567–577.
[7] Tomková I,Ševčíková Z,Levkut M,et al.Effect of aflatoxin B1on CD3 T cells andalkaline phosphatase in the intestine of mice[J].Mycopathologia,2002,154(1):15–19.
[8] Sabourin P J,Price J A,Casbohm S L,et al.Evaluation of acute immunotoxicity of aerosolized aflatoxin B1 in female c57bl/6n mice[J].Journal of Immunotoxicology,2006,3(1):11–20.
[9] Van Heugten E,Spears J,Coffey M,et al.The effect of methionine and aflatoxin on immune function in weanling pigs[J].Journal of Animal Science,1994,72(3):658–664.
[10] Raisuddin S,Singh K,Zaidi S,et al.Immunosuppressive effects of aflatoxin ingrowing rats[J].Mycopathologia,1993,124(3):189–194.
[11] Erf G F,Bottje W G,Bersi T K.CD4,CD8 and tcr defined T-cell subsets in thymus and spleen of 2-and 7-week old commercial broiler chickens[J].Veterinary Immunology and Immunopathology,1998,62(4):339–348.
[12] Reddy R,Taylor M,Sharma R.Studies of immune function of CD-1 mice exposed to aflatoxin B1[J]. Toxicology,1987,43(2):123–132.
[13] Jin H,Li X,Yu K.Quantitative measuration of biological activity and characterization of recombinant bovine interleukin-2[J].Chin J Animal Pouh Infect Dis,1998,20(2):79–82.
[14] Dugyala R R,Sharma R P.The effect of aflatoxin B1 on cytokine mrna and corresponding protein levels in peritoneal macrophages and splenic lymphocytes[J]. International Journal of Immunopharmacology,1996,18(10):599–608.
[15] Marin D,Taranu I,Bunaciu R,et al.Changes in performance,blood parameters,humoral and cellular immune responses in weanling piglets exposed to low doses of aflatoxin[J].Journal of Animal Science,2002,80(5):1250–1257.
[16] Abbas A K,Lichtman A H,Pillai S.Cellular and Molecular Immunology[M] . Philadelphia : Elsevier Health Sciences,1994.
[17] Choi K C,Lee B S,Chung W T,et al.Protective effects of apigenin and quercetin on aflatoxin B1-induced immunotoxicity in mice[J].Food Science and Biotech- nology,2010,19(4):987–992.
[18] Seder R A,Ahmed R.Similarities and differences in CD4+ and CD8+ effector and memory t cellgeneration[J]. Nature Immunology,2003,4(9):835–842.
[19] Schroder K,Hertzog P J,Ravasi T,et al.Interferon-γ:An overview of signals,mechanisms and functions[J]. Journal of Leukocyte Biology,2004,75(2):163–189.

